文章信息
- CircHIPK3通过调控p53-Akt-Mdm2通路影响食管鳞癌的恶性表型
- CircHIPK3 Affects Malignant Phenotypes in Esophageal Squamous Cell Carcinoma by Regulating p53-Akt-Mdm2 Signaling Pathways
- 肿瘤防治研究, 2019, 46(11): 987-993
- Cancer Research on Prevention and Treatment, 2019, 46(11): 987-993
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.19.0386
- 收稿日期: 2019-03-25
- 修回日期: 2019-07-29
食管癌是一种高发病率和高死亡率的疾病[1-2],主要由食管黏膜上皮细胞异型增生而来,分为食管鳞癌和食管腺癌两种。发展中国家和亚洲地区食管癌病理类型主要是食管鳞癌,我国约86%以上的患者都属此列[3]。临床上晚期食管鳞癌5年总体生存率低于15%,早期食管鳞癌患者存活率则可以超过80%[4-6]。手术对早期食管鳞癌疗效确切,术后放化疗疗效仍有争议,靶向治疗已被证实对多种恶性肿瘤效果良好,但目前食管鳞癌的靶向治疗仍缺乏更加有效的治疗靶点。
环状RNA是一种非编码RNA,HIPK3可以产生22种环状RNA,其中3种存在于动物体内,其余19种存在于人体细胞。有研究发现CircHIPK3在多个恶性肿瘤内存在表达异常[7-9]。本文研究了食管鳞癌组织中CircHIPK3表达异常对食管鳞癌的影响,以期为食管鳞癌的诊断和靶向治疗提供新的思路。
1 资料与方法 1.1 资料 1.1.1 研究人群及组织样本本研究纳入11例临床患者病理资料,其中男8例、女3例;患者平均年龄(58.82±9.67)岁;1例患者家族中曾患类似疾病,余10例无遗传病史;5例有吸烟史;7例有饮酒史;中段食管鳞癌患者8例,上段和下段食管鳞癌患者分别为1例和2例,排除肿瘤位置位于贲门者(胃食管结合部肿瘤病理及治疗目前暂无确切研究结果,加入可能会影响研究结果);肿瘤组织分型中,高分化2例、中分化6例、低分化3例;所有患者肿瘤分期均为可手术的Ⅰ期或Ⅱ期,其中Ⅰ期患者8例、Ⅱ期患者3例。术前对患者肿瘤大小、分期、肺功能、心功能进行评估,本研究中患者临床及病理分期标准为2013年AJCC分期。
根据术前病理活检进行筛选,对入选患者严格追踪观察,术后病理活检结果确定最终是否纳入研究。癌组织取自患者肿瘤部位,且显微镜下复查可见明显异形细胞;癌旁组织取自远离瘤体≥5 cm的位置,且在显微镜下复查时未观察到肿瘤细胞。
1.1.2细胞EC9706细胞系购于中南大学湘雅医学院细胞库,选取传代少于6月的细胞,培养使用RPMI1640培养基;10%北美胎牛血清;1%双抗,5%CO2、37℃恒温培养。
1.1.3 主要试剂及仪器CCK-8(Sigma, USA)、血清(Boehringer-Ingelheim company)、胎牛血清(Biological Industries, Israel)、Transwell小室(Costar, USA)、Matrigel(Gibco, USA)、TRIzol(Invitrogen, Carlsbad, CA, USA)、ant-P53、ant-Akt和ant-Mdm2抗体购自美国Santa Cruz公司,β-actin鼠抗购自北京中杉金桥公司。过表达病毒及低表达病毒均由美国赛业公司合成构建。
1.2 方法 1.2.1 HIPK3表达量与食管鳞癌发生关系预测通过GEPIA数据库(http://gepia.cancer-pku.cn/)下载食管鳞癌患者相关数据,其中食管鳞癌患者共182例,非癌患者286例。对食管鳞癌患者HIPK3的表达量行数据分析,同时对不同分期的食管鳞癌患者的HIPK3的表达量进行数据分析。
1.2.2 过表达及低表达CircHIPK3食管鳞癌细胞株的构建及检测将食管鳞癌EC9706细胞以5×105个/毫升的密度接种于6孔板中,每组设2个平行孔。对照组加入等体积PBS,12 h后分别更换新鲜培养液,于37℃, 5%CO2, 95%湿度环境中继续孵育。两天后收集细胞,用嘌呤霉素筛选。试验共分四组,高表达组、高表达对照组、低表达组和低表达对照组,见表 1。
取对数生长期的转染细胞,0.25%的胰酶进行消化制成单细胞悬液,CCK-8法进行细胞计数。以每孔1×104个细胞的密度接种于96孔板中并继续孵育,第2、3、4天分别于每孔加入10 μl CCK-8,37℃孵育2 h后用酶标仪测450 nm波长处吸光度值。
1.2.4 细胞迁移实验在24孔板中每孔接种1×105个细胞,加入0.1%BSA-RPMI1640,将Transwell小室置于24孔板中,加入细胞悬液100 μl。36 h后取出小室,甲醛固定,结晶紫染色,擦去滤膜内表面细胞。计数穿过滤膜的细胞数,每膜计数5个随机不同视野,每组设3次重复。
1.2.5 细胞侵袭实验在滤膜内表面涂基质胶形成人工重组基底膜,其余步骤同迁移实验。
1.2.6 细胞凋亡实验取对数生长期的细胞制成单细胞悬液,流式细胞仪检测细胞凋亡。
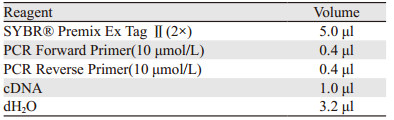
1.2.7 qRT-PCR检测CircHIPK3的表达情况TRIzol提取细胞总RNA,依据反转录试剂盒说明书进行反转录合成cDNA,反应条件为37℃,15 min;85℃,5 s。GAPDH作为内参,反转录得到的cDNA作为模板按照qRT-PCR试剂盒说明书配制10 μl的PCR反应体系,见表 2,反应条件为:95℃ 30 s,1个循环;95℃ 5 s,60℃ 30 s,40个循环。测Ct值,基因的相对表达量采用2-ΔΔCt表示。
通过生物信息学分析的方式,对CircHIPK3基因的下游miRNA和调控通路进行分析,然后再分别通过TargetScan 7(http://www.targetscan.org/mamm_31)、miRBASE(http://www.mirbase.org/)、miRDB(http://mirdb.org/)和DIANA(https://academic.oup.com)四种软件,使用Venn图法,取四种软件预测miRNA的交集进行验证,再通过单一数据库对下游miRNA进行评价预测。
1.2.9 Western blot检测CircHIPK3细胞相关蛋白的表达RIPA提取蛋白,蛋白浓度与5×SDS蛋白上样缓冲液以1:4比例混合,煮沸变性后,10%的SDS-PAGE分离样品,将蛋白转移到PVDF膜上,用含5%脱脂奶粉的TBST室温封闭2 h,将膜与一抗室温孵育2 h,加入辣根过氧化物酶标记的二抗室温孵育2 h,暗室中加入ECL试剂,X线片曝光,显影和定影。在ImageQuant 350电泳凝胶成像分体系统中曝光拍照,并借助Image J软件对吸光度值进行分析。目的蛋白相对表达量=目的蛋白吸光度值/GAPDH蛋白吸光度值。
1.3 统计学方法采用SPSS24.0对实验数据进行分析,并用GraphPad Prism 6.0作图。运用t检验对两组数据进行比较,P < 0.05为差异有统计学意义。
2 结果 2.1 HIPK3与食管鳞癌的关系通过对生物信息数据的分析,发现HIPK3高表达的食管鳞癌患者,生存率显著低于HIPK3低表达患者。对不同分期食管鳞癌患者的HIPK3表达进行分析,发现早期食管鳞癌患者的HIPK3表达较低,而晚期食管鳞癌患者的HIPK3表达较高,见图 1。

|
| ESCA: esophageal carcinoma 图 1 HIPK3与食管鳞癌患者生存率和分期的关系 Figure 1 Relation between HIPK3 and survival rate(A), staging(B) of esophageal carcinoma patients |
CircHIPK3在18例样本中明显高表达,其中高表达的癌组织(n=11)占所有高表达组织的61%,表达量明显高于癌旁组织(P < 0.005)。
2.3 CircHIPK3的异常表达对EC9706细胞增殖的影响CCK-8结果发现:在CircHIPK3高表达时,肿瘤细胞的增殖速度明显加快,低表达的CircHIPK3肿瘤细胞增殖明显被抑制。即pcDNA3.1b-circ > pcDNA3.1b > NC > shRNA,见图 2。

|
| 图 2 CircHIPK3的异常表达对EC9706细胞增殖的影响 Figure 2 Effect of abnormal expression of CircHIPK3 on proliferation of EC9706 cells |
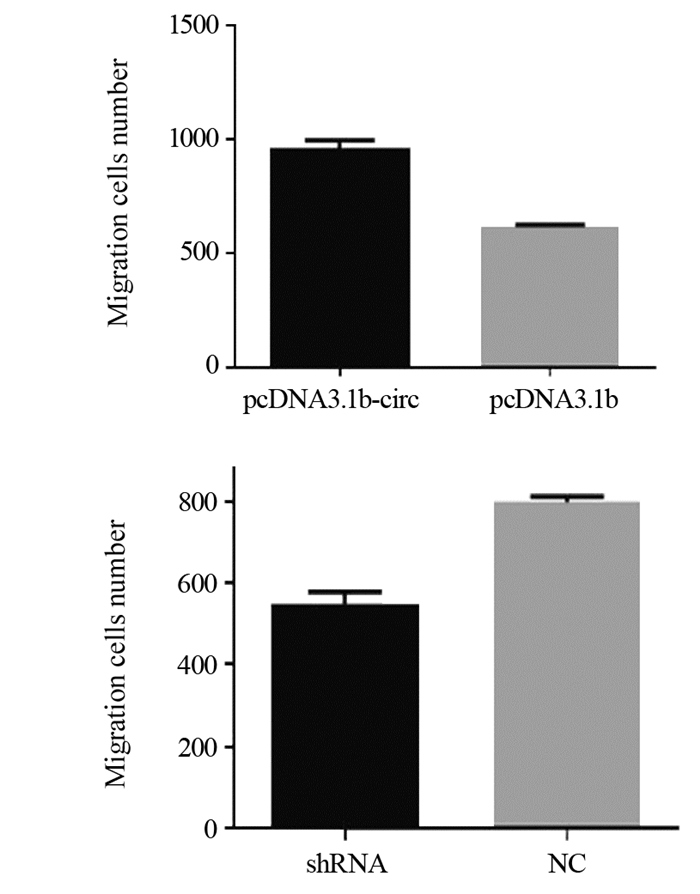
研究结果发现CircHIPK3高表达的EC9706细胞迁移能力高于高表达对照组(P < 0.001);CircHIPK3低表达EC9706细胞的迁移速度明显减慢(P < 0.001),见图 3。
|
| 图 3 CircHIPK3对EC9706细胞迁移能力的影响 Figure 3 Effect of CircHIPK3 on migration ability of EC9706 cells |
研究结果发现CircHIPK3高表达的EC9706细胞侵袭能力高于高表达对照组(P < 0.001);而CircHIPK3低表达的EC9706细胞侵袭能力明显低于低表达对照组(P < 0.001),见图 4。

|
| 图 4 CircHIPK3对EC9706细胞侵袭能力的影响 Figure 4 Effect of CircHIPK3 on invasion ability of EC9706 cells |
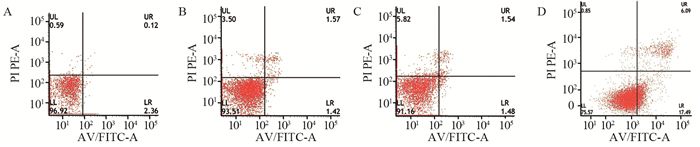
CircHIPK3高表达的EC9706细胞的凋亡速度小于高表达对照组(P < 0.001);而CircHIPK3低表达的EC9706细胞凋亡速度较低表达对照组增快(P < 0.001),见图 5。
|
| A: high expression; B: control (high expression); C: low expression; D: control (low expression) 图 5 CircHIPK3的表达和EC9706细胞凋亡的相关性 Figure 5 Correlation between CircHIPK3 expression and apoptosis of EC9706 cells |
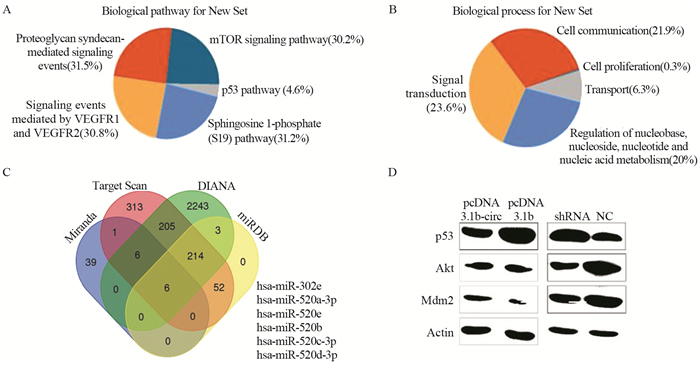
本研究使用Venn图法对四种数据库进行分析,发现CircHIPK3影响的下游miRNA主要包括hsa-miR-302e;hsa-miR-520a-3p;hsa-miR-520e;hsa-miR-520b;hsa-miR-520c-3p;hsa-miR-520d-3p;单一数据库对CircHIPK3和miRNA的通路进行分析(CircHIPK3和miRNA的相关关系评分见表 3),发现其主要功能的实现与p53-Akt-Mdm2通路相关。对四种CircHIPK3不同表达的食管鳞癌细胞的p53-Akt-Mdm2通路相关蛋白进行测定,结果发现:高表达的CircHIPK3细胞内的抑癌基因p53被明显抑制,而细胞内的Akt-Mdm2信号通路则处于激活状态,癌细胞增殖相关蛋白的表达量随之增加,其对癌细胞的影响较大,最重要的是导致癌细胞的生理过程包括增殖、迁移和侵袭以及相关癌症蛋白的表达增加,癌细胞的相关功能增强;反之,低表达的CircHIPK3则对癌细胞的功能有抑制作用,见图 6。
|
| 图 6 CircHIPK3和P53-Akt-Mdm2通路蛋白表达相关性 Figure 6 Correlation between CircHIPK3 and P53-Akt-Mdm2 pathway protein expression |
本研究发现CircHIPK3在11例食管鳞癌标本中和7例癌旁组织中呈上调趋势,4例食管鳞癌旁组织样本中表达下调。基于CircHIPK3表达存在显著差异,本研究在细胞层面对CircHIPK3在食管鳞癌中的表达情况进行了进一步试验,实验结果表明:CircHIPK3表达升高促进食管鳞癌细胞增殖、迁移和侵袭,抑制细胞凋亡,而下调CircHIPK3表达具有相反的作用。有研究表明以上miRNA多与CD44因子和p53-Akt-Mdm2通路的表达相关[10-13]。本研究通过生物信息学对CircHIPK3的下游调控基因及蛋白进行了进一步分析,并使用Western blot进行验证,结果发现,当CircHIPK3低表达时,抑癌基因p53被激活,Akt-Mdm2信号通路被抑制,其表达的相关p53-Akt-Mdm2通路蛋量减少,癌细胞的功能抑制。
研究者们通过对人体肿瘤组织的基因组测序发现,环状RNA在膀胱癌、肠癌、肝癌、肺癌等人体多种实体肿瘤中呈现特异性表达,且通过参与多种肿瘤相关蛋白如WNT和VEGF等的合成过程发挥作用[9, 14-15]。Zheng等[8]研究发现circHIPK3在多种癌症的癌组织和癌旁组织中差异稳定。此后,较多研究[9, 16-17]也得到类似的结果。
肿瘤蛋白p53是抑癌基因的一种。p53基因在各种内外因素的作用下(包括物理辐射、化学污染、生物及病毒因素等多种因素)发生突变后,其空间构象随着改变,此时,p53基因失去了对细胞的正常调控,使细胞和组织癌变。研究表明,在所有恶性肿瘤中,该基因的突变率约50%[18]。
丝氨酸/苏氨酸激酶(Akt)是一种原癌基因,在调控细胞功能方面发挥重要作用[18-20],且其对于肿瘤细胞的调节途径与p53完全相异;Mdm2是一种人体的癌蛋白,是p53基因的主要调节蛋白,Mdm2突变与p53突变不共存,可通过特异性结合p53阻断其生物学活性,与肿瘤的增殖密切相关[21-22]。同时Akt可以稳定Mdm2蛋白的作用,协同Mdm2抑制p53活性[23-25]。因此,我们推测CircHIPK3可能通过该通路调节食管鳞癌细胞的生理活性。
本研究首先通过慢病毒构建具有不同CircHIPK3表达水平的食管鳞癌细胞系,观察到p53-Akt-Mdm2信号转导途径中相关mRNA和蛋白的水平随CircHIPK3的表达不同而改变。在稳定过表达CircHIPK3的细胞中,Akt-Mdm2通路的作用被促进,同时抑癌基因p53作用被抑制,癌细胞的功能增强。CircHIPK3低表达则结果相反。
综上所述,本研究结果发现CircHIPK3促进人食管鳞癌细胞的增殖、迁移和侵袭,并抑制细胞凋亡,这可能通过调节p53-Akt-Mdm2信号通路来实现。因此,CircHIPK3存在作为食管鳞癌潜在靶点的可能性,但本研究对其具体作用通路和机制表述仍不明确,还需要更大样本和更深入的研究。
作者贡献
苟云久:论文撰写、实验指导
马继龙:实验操作
韩松辰:数据分析
金大成:收集临床标本
陈猛:资料检索
王兵:论文修改、图片处理
柏启州:论文修改及质量把控
| [1] |
Lagergren J, Smyth E, Cunningham D, et al. Oesophageal cancer[J]. Lancet, 2017, 390(10110): 2383-2396. DOI:10.1016/S0140-6736(17)31462-9 |
| [2] |
Ferlay J, Soerjomataram I, Dikshit R, et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012[J]. Int J Cancer, 2015, 136(5): E359-E386. DOI:10.1002/ijc.29210 |
| [3] |
Chen W, He Y, Zheng R, et al. Esophageal cancer incidence and mortality in China, 2009[J]. J Thoracic Dis, 2013, 5(1): 19-26. |
| [4] |
Fakhrian K, Ordu AD, Lordick F, et al. Long-term outcomes of trimodality treatment for squamous cell carcinoma of the esophagus with cisplatin and/or 5-FU: More than 20 years' experience at a single institution[J]. Strahlenther Onkol, 2014, 190(12): 1133-1140. DOI:10.1007/s00066-014-0711-4 |
| [5] |
Sjoquist KM, Burmeister BH, Smithers BM, et al. Survival after neoadjuvant chemotherapy or chemoradiotherapy for resectable oesophageal carcinoma: an updated meta-analysis[J]. Lancet Oncol, 2011, 12(7): 681-692. DOI:10.1016/S1470-2045(11)70142-5 |
| [6] |
Zhang Y, Zhang XO, Chen T, et al. Circular intronic long noncoding RNAs[J]. Mol Cell, 2013, 51(6): 792-806. DOI:10.1016/j.molcel.2013.08.017 |
| [7] |
Li Y, Zheng F, Xiao X, et al. CircHIPK3 sponges miR-558 to suppress heparanase expression in bladder cancer cells[J]. EMBO Rep, 2017, 18(9): 1646-1659. DOI:10.15252/embr.201643581 |
| [8] |
Zheng Q, Bao C, Guo W, et al. Circular RNA profiling reveals an abundant circHIPK3 that regulates cell growth by sponging multiple miRNAs[J]. Nat Commun, 2016, 7: 11215. DOI:10.1038/ncomms11215 |
| [9] |
萧志昊, 肖瑶, 卢晓丹, 等. 环状RNA:肺癌潜在生物标志物[J]. 肿瘤防治研究, 2019, 46(7): 654-657. [Xiao ZH, Xiao Y, Lu XD, et al. Circular RNA: A Potential Biomarker for Lung Cancer[J]. Zhong Liu Fang Zhi Yan Jiu, 2019, 46(7): 654-657. DOI:10.3971/j.issn.1000-8578.2019.18.1589] |
| [10] |
Dhar D, Antonucci L, Nakagawa H, et al. Liver Cancer Initiation Requires p53 Inhibition by CD44-Enhanced Growth Factor Signaling[J]. Cancer Cell, 2018, 33(6): 1061-1077. DOI:10.1016/j.ccell.2018.05.003 |
| [11] |
Ishihara Y, Tsuno S, Kuwamoto S, et al. Hsa-miR-520d Converts Fibroblasts into CD105+ Populations[J]. Drugs RD, 2014, 14(4): 253-264. DOI:10.1007/s40268-014-0064-6 |
| [12] |
Ishihara Y, Tsuno S, Ping B, et al. Hsa-miR-520d-5p promotes survival in human dermal fibroblasts exposed to a lethal dose of UV irradiation[J]. NPJ Aging Mech Dis, 2016, 2: 16029. DOI:10.1038/npjamd.2016.29 |
| [13] |
Tsuno S, Wang X, Shomori K, et al. Hsa-miR-520d induces hepatoma cells to form normal liver tissues via a stemness-mediated process[J]. Sci Rep, 2014, 4: 3852. |
| [14] |
Li P, Chen S, Chen H, et al. Using circular RNA as a novel type of biomarker in the screening of gastric cancer[J]. Clin Chim Acta, 2015, 444: 132-136. DOI:10.1016/j.cca.2015.02.018 |
| [15] |
Xuan L, Qu L, Zhou H, et al. Circular RNA: a novel biomarker for progressive laryngeal cancer[J]. Ame J Transl Res, 2016, 8(2): 932-939. |
| [16] |
Yu H, Chen Y, Jiang P. Circular RNA HIPK3 exerts oncogenic properties through suppression of miR-124 in lung cancer[J]. Biochem Biophys Res Commun, 2018, 506(3): 455-462. DOI:10.1016/j.bbrc.2018.10.087 |
| [17] |
Ke Z, Xie F, Zheng C, et al. CircHIPK3 promotes proliferation and invasion in nasopharyngeal carcinoma by abrogating miR-4288-induced ELF3 inhibition[J]. J Cell Physiol, 2019, 234(2): 1699-1706. DOI:10.1002/jcp.27041 |
| [18] |
Abraham AG, O'Neill E. PI3K/Akt-mediated regulation of p53 in cancer[J]. Biochem Soc Trans, 2014, 42(4): 798-803. |
| [19] |
Iyer SV, Iwakuma T. A novel link between the HER2-Akt and MDM2-p53 pathways via CSN6[J]. Cell Cycle, 2012, 11(22): 4112. DOI:10.4161/cc.22606 |
| [20] |
Surget S, Khoury MP, Bourdon JC. Uncovering the role of p53 splice variants in human malignancy: a clinical perspective[J]. Onco Targets Ther, 2013, 7: 57-68. |
| [21] |
Ebrahim M, Mulay SR, Anders HJ, et al. MDM2 beyond cancer: podoptosis, development, inflammation, and tissue regeneration[J]. Histol Histopathol, 2015, 30(11): 1271-1282. |
| [22] |
Wienken M, Dickmanns A, Nemajerova A, et al. MDM2 Associates with Polycomb Repressor Complex 2 and Enhances Stemness-Promoting Chromatin Modifications Independent of p53[J]. Mol Cell, 2016, 61(1): 68-83. DOI:10.1016/j.molcel.2015.12.008 |
| [23] |
Guo Y, Li Y, Xiang B, et al. Nutlin-3 plus Tanshinone IIA Exhibits Synergetic Anti-leukemia Effect with Imatinib by Reactivating p53 and Inhibiting AKT/mTOR Pathway in Ph+ALL[J]. Biochem J, 2017, 474(24): 4153-4170. DOI:10.1042/BCJ20170386 |
| [24] |
Matsuda S, Nakagawa Y, Kitagishi Y, et al. Reactive Oxygen Species, Superoxide Dimutases, and PTEN-p53-AKT-MDM2 Signaling Loop Network in Mesenchymal Stem/Stromal Cells Regulation[J]. Cells, 2018, 7(5): pii: E36. DOI:10.3390/cells7050036 |
| [25] |
Sun W, Tang L. MDM2 increases drug resistance in cancer cells by inducing EMT independent of p53[J]. Curr Med Chem, 2016, 23(40): 4529-4539. DOI:10.2174/0929867323666160926150820 |
 2019, Vol. 46
2019, Vol. 46