文章信息
- 磁共振弥散加权成像评价鼻咽癌调强放疗唾液腺功能的损伤
- Diffusion-weighted Magnetic Resonance Imaging Evaluates Salivary Gland Function Damage in Nasopharyngeal Carcinoma Patients Treated with Intensity-modulated Radiation Therapy
- 肿瘤防治研究, 2019, 46(10): 905-910
- Cancer Research on Prevention and Treatment, 2019, 46(10): 905-910
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.19.0367
- 收稿日期: 2019-03-21
- 修回日期: 2019-04-28
2. 528000 佛山,佛山市第一人民医院影像科;
3. 528000 佛山,佛山市第一人民医院肿瘤放射物理科
2. Department of Radiology, The First People's Hospital of Foshan City, Foshan 528000, China;
3. Department of Tumor Radiophysics, The First People's Hospital of Foshan City, Foshan 528000, China
唾液腺在鼻咽癌常规二维放疗中不可避免地受到功能损伤(口干),口干虽然不会危及生命,但对患者的生活质量产生严重影响[1-2]。调强放射治疗(intensity-modulated radiation therapy, IMRT)是二十世纪末发展并逐渐成熟的放射治疗技术,其优势是可以根据需要对各个方向照射野内的剂量进行调节,从而能更好地使放疗的高剂量区与肿瘤靶区形态一致,提高鼻咽癌的局部控制率的同时,使正常组织功能得到较为有效的保护。虽然鼻咽癌患者采用IMRT治疗后口干的严重程度已有所降低,但口干症仍然是最常见的并发症之一[3-4]。如何客观有效地评价唾液腺功能损伤日益受到关注。磁共振弥散加权成像技术(diffusion-weighted magnetic resonance imaging, DW-MRI)是一种能显示组织内水分子扩散的影像技术,通过可测量的表观扩散系数(apparent diffusion coefficient, ADC)对唾液腺的功能进行评估,具有简便、无创和可量化等优点。本研究的目的是探讨DW-MRI用于评价鼻咽癌患者IMRT后唾液腺功能损伤的价值,并分析其相关影响因素。
1 资料与方法 1.1 病例选择选取在佛山市第一人民医院就诊的初治鼻咽癌患者,病理类型为非角化性癌(分化型或未分化型),肿瘤分期(AJCC第7版)为Ⅰ~ⅣB期,年龄18~70岁,性别不限,预计生存期 > 6月,全身功能状态评分(ECOG)0~2分,心肝肾功能、心电图无明显异常,无明确的放化疗禁忌证。排除标准:(1)既往或目前有唾液腺相关疾病,包括唾液腺可疑原发肿瘤和腮腺内淋巴结转移; (2)既往有唾液腺手术病史; (3)既往有头颈部放疗病史; (4)磁共振检查禁忌证(心脏支架或骨折内固定术等); (5)无自主行为能力。
1.2 临床资料2017年2~10月共入组患者28例,其中男21例,女7例(男女性别比为3:1),年龄21~68岁,中位年龄48岁。采用AJCC第7版分期标准:Ⅰ期1例(3.5%),Ⅱ期2例(7.1%),Ⅲ期13例(46.4%),ⅣA期10例(35.7%),ⅣB期2例(7.1%)。
1.3 治疗和口干评级Ⅲ、ⅣA、ⅣB期的患者放疗前行2~3周期诱导化疗(21天一周期),方案:多西他赛60 mg/m2,第1天,静脉滴注; 顺铂80 mg/m2,第1天,静脉滴注; 氟尿嘧啶800 mg/m2持续静脉微泵灌注96 h。末次诱导化疗结束后2周开始行放疗,除Ⅰ期外其余患者放疗第1天开始行同期化疗,方案为顺铂30 mg/m2,第1天,静脉滴注,每周1次,共6周期。全部患者均采用IMRT,靶区包括GTVnx:原发肿瘤及咽后转移淋巴结; GTVnd:颈部转移淋巴结; GTV1:包括GTVnx+5~10 mm(外扩范围根据临床和解剖结构做相应调整)+鼻咽腔黏膜及黏膜下5 mm; GTV2:包括GTV1+5~10 mm(根据肿瘤侵犯位置和范围做相应调整并包括鼻腔后部、咽旁间隙、颅底、斜坡、部分颈椎、翼腭窝、上颌窦后部和部分后组筛窦)+需预防照射的颈部淋巴结引流区。给予各靶区的计划靶体积的处方剂量分别为:PGTVnx 70.0~71.3 Gy,GTVnd 68.0~70.0 Gy,PTV1 62.0 Gy,PTV2 56.0 Gy,分割次数为31~33次。
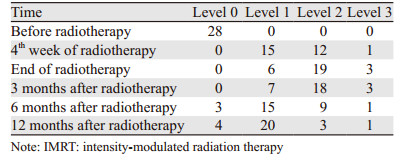
所有患者分别在放疗前、放疗第4周、放疗结束、放疗后3、6和12月行MRI检查,并同时进行口干评级(按照RTOG的分级标准):0级为无口干症状; 1级为感觉轻微口干,不需要汤水也能进食; 2级为感觉中度口干,进食时常需要汤水; 3级为感觉严重口干,夜间常醒来饮水。
1.4 DW-MRI检查方法唾液腺功能检查一般采用酸性物质刺激(临床上常用维生素C、枸橼酸或者柠檬酸等置于舌背或舌缘),使腺体分泌反射性增加,根据腺体本身变化和分泌情况,评估腺体的分泌功能。检查前患者禁食1 h以上。扫描机器为飞利浦1.5T MR系统(Achieva),先行头颈常规MR扫描,然后行轴位DWI扫描,包括整个腮腺和颌下腺,范围从腮腺上极到颌下腺下极区域。DWI序列扫描参数为:TE=80 ms,IR delay=260 ms,矩阵25 cm,层厚5 mm,FOV 250 mm×250 mm,NEX 2,用b=0 s/mm2和b=800 s/mm。先在静息状态下采集1组DWI序列,然后采集酸刺激状态下序列:嘱患者口含维生素C片600 mg(100 mg×6片),在扫描过程中将维生素C含于舌面与上腭之间,每个DWI序列的扫描时间为2 min,间隔1 min进行下一次DWI扫描,共7组酸刺激状态下DWI序列。全部8组DWI序列扫描图像获取时间分别为:静息状态和酸刺激后(口含维生素C)第3、6、9、12、15、18和21分钟。每组DWI序列均获得覆盖整个腮腺和颌下腺的9个层面。
1.5 图像分析采用飞利浦WorkSpace R2.6.3.1工作站进行图像处理,首先用Functiontool软件调节阈值去除背景噪声,然后参考轴位T2W图像在DWI序列图像上勾画腮腺和颌下腺的感兴趣区,尽可能将全部腮腺和颌下腺腺体包含在内,见图 1。所得数据通过逐个像素的计算,自动生成全部DWI图像的表观扩散系数图。ADC值的计算公式如下:S(i)=S0×exp(−bi×ADC),其中S(i)是在第i个b值图像上测量的信号强度,bi是对应的b值,S0是表示b=0 s/mm2的精确信号强度的变量。
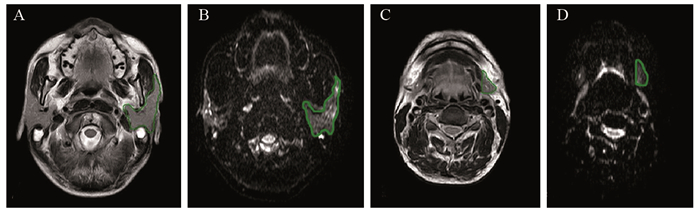
|
| A: the parotid gland outlined on the T2W image; B: the parotid gland outlined on the DWI image with reference to the T2W image; C: the submandibular gland outlined on the T2W image; D: the submandibular gland outlined on the DWI image with reference to the T2W image 图 1 T2W和DWI序列上显示的感兴趣区 Figure 1 Region of interest displayed on T2W (T2 weighted) and DWI (diffusion weighted imaging) sequences |
应用SPSS13.0统计软件包进行统计学处理。所得数据均采用Excel2003进行表格建档,在录入数据前进行严格核对,计数资料以(x±s)表示,两两比较采用方差分析或者成组样本t检验,酸刺激前后的比较采用重复测量方差分析,相关性分析采用Pearson相关分析或偏相关分析,P < 0.05为差异有统计学意义。
2 结果 2.1 治疗完成情况局部晚期患者均按治疗计划完成了2~3程诱导化疗。除Ⅰ期1例患者行单纯放疗,其余27例患者中,完成6次同期化疗2例,完成5次同期化疗10例,完成4次同期化疗11例,完成3次同期化疗2例,完成2次同期化疗1例,完成1次同期化疗1例。仅1例患者因Ⅳ度粒细胞减少暂停放疗2天,其余患者均顺利完成放疗计划。
2.2 患者口干评级情况28例患者放疗前口干评级均为0级,放疗第1周3例患者出现腮腺区轻微疼痛,嘱患者避免进食酸性食物后能自行缓解。放疗第4周、放疗结束口干分级逐步加重,放疗后3月口干恢复不明显,放疗后6、12月口干分级逐步恢复,见表 1。放疗第4周和放疗结束、放疗结束和放疗后3月患者口干分级比较,差异均无统计学意义(P=0.362和P=0.519),放疗后12月和放疗后3月、放疗后12月和放疗结束患者口干分级比较,差异均有统计学意义(P=0.002和P=0.000);放疗后12月患者口干分级与放疗后6月比较,差异无统计学意义(P=0.277)。放疗后6月患者口干分级与放疗后3月比较,差异有统计学意义(P=0.019),放疗后6月与放疗结束比较,差异有统计学意义(P=0.010)。
|
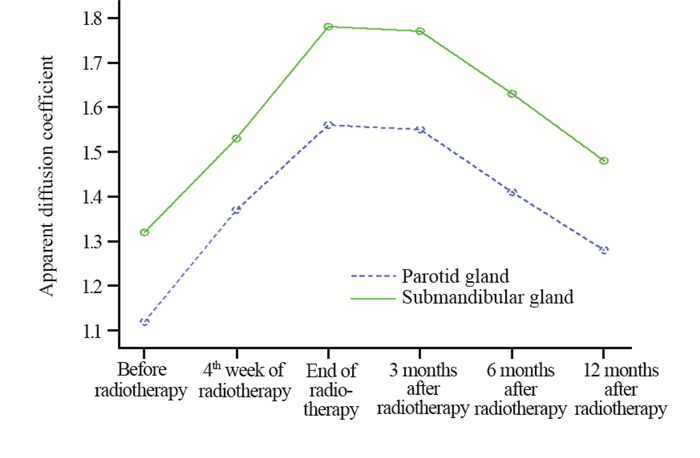
放疗前静息状态下腮腺的ADC值为(1.12±0.11)×10-3 mm2/s,颌下腺的ADC值为(1.32±0.12)×10-3 mm2/s。腮腺和颌下腺放疗第4周、放疗结束ADC值均逐步升高,放疗后3月均稍降低,放疗后6、12月均逐步降低,见图 2。各时间段两两比较,放疗结束和放疗后3月腮腺、颌下腺ADC值比较,差异无统计学意义(P=0.356和P=0.387),其余各阶段比较差异均有统计学意义(腮腺:放疗前和放疗第4周比较P=0.012,放疗第4周和放疗结束比较P=0.015,放疗后3月和6月比较P=0.022,放疗后6月和12月比较P=0.027。颌下腺:放疗前和放疗第4周比较P=0.014,放疗第4周和放疗结束比较P=0.019,放疗后3月和6月比较P=0.023,放疗后6月和12月比较P=0.031)。
|
| 图 2 初诊鼻咽癌患者IMRT前后腮腺、颌下腺静息状态下各随访时间点表观扩散系数的比较 Figure 2 Comparison of apparent diffusion coefficient of parotid gland and submandibular gland at rest in patients with newly-diagnosed nasopharyngeal carcinoma before and after IMRT at different follow-up time points |
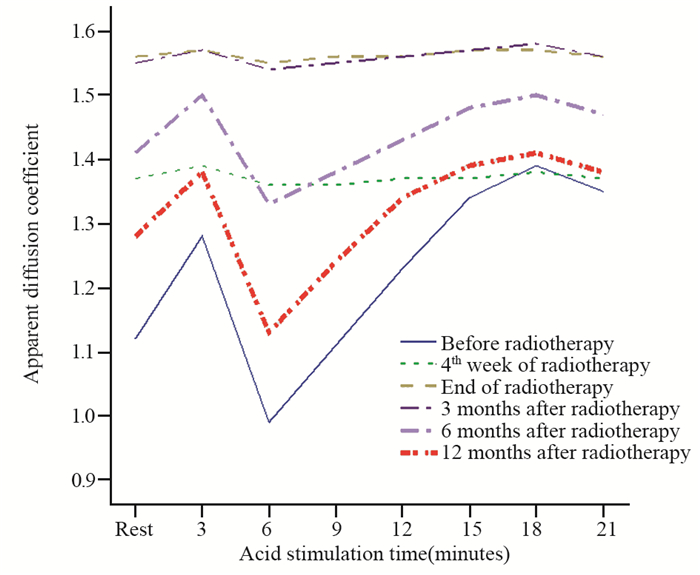
腮腺:放疗前酸刺激状态下腮腺的ADC值呈快速升高后又快速下降,然后出现较长时间的缓慢升高。具体表现为:酸刺激第3分钟腮腺的ADC值出现明显升高(1.28±0.11)×10-3 mm2/s,第6分钟ADC值明显下降至(0.99±0.13)×10-3 mm2/s,第9、12、15、18分钟ADC值呈缓慢升高至(1.39±0.14)×10-3 mm2/s,第21分钟ADC值稍下降(1.35±0.13)×10-3 mm2/s。两两比较静息状态、酸刺激第3和6分钟差异有统计学意义(均P < 0.05),其余各阶段比较差异均无统计学意义(均P > 0.05)。放疗第4周ADC值总体升高,但酸刺激状态下各时间段和静息状态下比较无明显差异(均P > 0.05)。放疗结束、放疗后3月各时间段ADC值相当,并且均高于放疗第4周,酸刺激状态下各时间段和静息状态下比较差异均无统计学意义(均P > 0.05)。放疗后6月和12月ADC值总体逐步降低,且再次出现先升高后下降,然后较长时间缓慢升高,两者酸刺激第3和6分钟比较差异有统计学意义(均P < 0.05),其余各时间段比较差异均无统计学意义(均P > 0.05),见图 3。
|
| 图 3 初诊鼻咽癌患者IMRT前后腮腺酸刺激状态下各时间段表观扩散系数 Figure 3 Apparent diffusion coefficient of parotid gland acid stimulation in patients with newly-diagnosed nasopharyngeal carcinoma at different time points before and after IMRT |
颌下腺:放疗前酸刺激状态下颌下腺的ADC值也呈现先快速升高后快速下降,然后出现较长时间的缓慢升高,但酸刺激的第3分钟时上升幅度不明显,两两比较仅酸刺激第3和6分钟差异有统计学意义(P=0.026),其余各阶段比较差异均无统计学意义(均P > 0.05)。放疗第4周、放疗结束、放疗后3月ADC值总体升高,均表现为酸刺激状态下各时间段和静息状态下比较ADC值无明显差异(均P > 0.05)。放疗后6月和12月ADC值总体逐步降低,再次出现先升高后下降,然后较长时间缓慢升高,但各时间段比较差异均无统计学意义(均P > 0.05),见图 4。
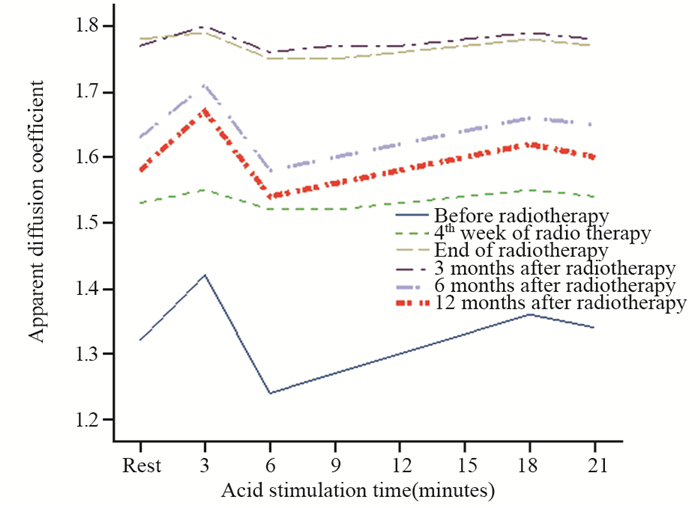
|
| 图 4 初诊鼻咽癌患者IMRT前后颌下腺酸刺激状态下各时间段表观扩散系数 Figure 4 Apparent diffusion coefficient of submandibular gland acid stimulation in patients with newly-diagnosed nasopharyngeal carcinoma at different time points before and after IMRT |
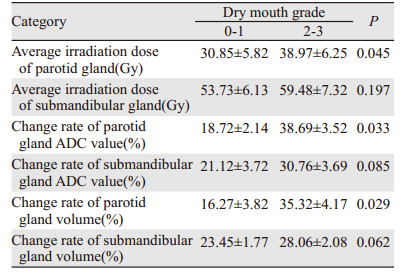
结果显示放疗后6月患者口干开始明显恢复,选择该时间段按口干分级分组进行相关对比分析。所有患者腮腺的平均剂量为34.21 Gy((29.85~41.29)Gy),颌下腺的平均剂量为56.27 Gy((48.13~65.22)Gy),见表 2。ADC值变化率和唾液腺体积变化率呈正相关,ADC值变化率、唾液腺体积变化率分别和平均剂量呈正相关。
|
唾液腺是口腔内分泌唾液的腺体,包含腮腺、颌下腺、舌下腺和散在分布于口腔黏膜的小唾液腺。腮腺、颌下腺邻近鼻咽癌放射治疗的靶区,其中腮腺深叶邻近咽旁,为鼻咽原发病灶及咽后淋巴结的高剂量区,腮腺下缘和颌下腺邻近颈部淋巴结转移高发的ⅡA、ⅡB区,同样容易受到高剂量的照射,即使采用IMRT也无法避免口干的发生,尤其是放疗后3月表现的最为明显[5]。与本研究结果相似,患者在放疗第4周开始出现不同程度的口干症状,在放疗结束和放疗后3月口干评级最严重,放疗后6和12月口干症状逐步缓解。
唾液腺功能损伤的评价方法包括主观评价和客观评价。口干评级为主观评价,而客观评价包括唾液流量测定、唾液腺X线造影以及唾液腺放射性显像技术等。唾液流量测定被认为是目前最有效的口干评价方法,但唾液的收集操作较繁琐、重复性差,可能会影响测量的准确性。唾液腺X线造影需要行涎管插管,具有侵袭性并且操作难度大,易出现并发症(如涎管破裂)。唾液腺放射性显像技术需要注射造影剂和进行扫描,同样具有侵袭性并且增加了额外的辐射。DW-MRI在头颈部方面表现出较高的临床价值[6-8],利用其可量化的ADC值评估唾液腺的功能状况,可能较其他单纯通过影像形态评估的传统方法更准确。以往研究提示放疗后唾液腺的ADC值较放疗前升高[9-10],对放疗后ADC值产生变化的可能的解释是:由于辐射损伤,唾液腺的腺泡细胞数量减少,较低的细胞密度导致水扩散率的增加,从而导致ADC值升高[11]。Juan等[10]研究中,11例鼻咽癌IMRT患者分别在放疗前、放疗后100天内、放疗后100天至1年和放疗后1年以上四个时间段行DW-MRI检查,研究显示放疗后100天内、放疗后100天、放疗后100天至1年腮腺ADC值显著高于放疗前(均P < 0.05),其中放疗后100天内ADC值最高。放疗后1年以上虽然腮腺ADC值仍高于放疗前,但差异无统计学意义(P=0.153)。本研究也观察到静息状态下从放疗第4周开始ADC值逐步升高,到放疗结束和放疗后3月腮腺ADC值达最高峰,放疗后6和12月ADC值逐渐下降但仍明显高于放疗前,放疗后各时间段ADC值与放疗前相比差异均有统计学意义(均P < 0.05)。
李眉等[12]对17例健康志愿者进行了DW-MRI扫描,发现静息状态下的颌下腺ADC值明显高于腮腺,在酸刺激状态下1~2 min腮腺ADC值显著升高、颌下腺ADC值稍升高,2~9 min腮腺和颌下腺ADC值明显下降,第9分钟时ADC值均逐渐上升,16 min时ADC值达高峰。其他研究也观察到类似酸刺激状态下ADC值先升高后降低再缓解升高的表现[3, 9, 13]。Zhang等[13]对26例接受了放疗的鼻咽癌患者进行了DW-MRI扫描,结果表明放疗后2周,腮腺和颌下腺的平均ADC值均显著高于放疗前(P < 0.05);与放疗前相比,放疗期间腮腺ADC增高值和增高率均显著降低(均P < 0.05),颌下腺ADC增高值和增高率均降低但差异无统计学意义(P > 0.05)。本研究也观察到静息状态下颌下腺的ADC值高于腮腺,酸刺激状态下3 min时腮腺ADC值显著升高(P < 0.05)、颌下腺的ADC值稍升高(P > 0.05),6 min时腮腺和颌下腺ADC值均明显下降(均P < 0.05),之后ADC值均逐渐上升,到18 min时ADC值达最高峰,21 min时ADC值稍下降。放疗后腮腺和腮腺和颌下腺静息状态下的ADC值均出现升高,并且表现出对酸刺激的反应减弱,以放疗第4周、放疗结束和放疗后3月最为明显。
研究表明放疗期间唾液腺体积会明显缩小[14]。新加坡的一项研究发现放疗后唾液腺体积缩小率与放疗剂量和唾液流量率下降呈正相关[14]。本研究观察到ADC值变化率和唾液腺体积变化率呈正相关,ADC值变化率、唾液腺体积变化率分别和平均剂量呈正相关。在分层研究时发现,口干评级0~1级的患者腮腺的平均剂量明显低于2~3级的患者(P=0.045),0~1级的患者颌下腺的平均剂量低于2~3级的患者,但差异无统计学意义,提示在放疗期间对腮腺进行剂量限制的重要性可能高于颌下腺。Dirix等[9]对接受腮腺保护性放疗的8例头颈部肿瘤患者进行了DW-MRI扫描。患者放疗后对侧腮腺(平均剂量 < 26 Gy)对酸刺激的反应与放疗前相同,而接受了放疗侧的腮腺则完全丧失对酸刺激的反应,证明放疗后涎腺ADC值变化与功能相关。鼻咽癌照射野包括双侧颈部,即便是N0期的患者仍需要行双上颈预防照射,故腮腺平均剂量 < 26 Gy这一目标较难实现。本研究结果提示放疗后6月口干0~1级患者腮腺的平均照射剂量为30.85 Gy,因此限制腮腺平均照射剂量 < 30 Gy可能对腮腺功能恢复有一定的作用。
综上所述,唾液腺的ADC值与主观口干症状存在相关性,ADC值变化率、唾液腺体积变化率分别和平均剂量呈正相关。DW-MRI扫描在评价鼻咽癌调强放疗唾液腺功能损伤方面具有一定的价值,但研究结果还需要扩大样本量和观察更长的随访时间来进一步验证。
作者贡献
刘桂超:研究设计、实施监督、数据整理及论文撰写
胡学锋:理论指导
赵海、贺小红:磁共振的检查及诊断
滕建建:放射物理方面的工作
郭建贵、吴海军:入组病例资料的收集、整理和分析
| [1] | Buglione M, Cavagnini R, Di Rosario F, et al. Oral toxicity management in head and neck cancer patients treated with chemotherapy and radiation: Dental pathologies and osteoradionecrosis (Part 1) literature review and consensus statement[J]. Crit Rev Oncol Hematol, 2016, 97: 131–142. DOI:10.1016/j.critrevonc.2015.08.010 |
| [2] | Almståhl A, Wikström M, Fagerberg-Mohlin B. Microflora in oral ecosystems and salivary secretion rates- A 3-year follow-up after radiation therapy to the head and neck region[J]. Arch Oral Biol, 2015, 60(9): 1187–1195. DOI:10.1016/j.archoralbio.2015.04.004 |
| [3] | Zhang Y, Ou D, Gu Y, et al. Evaluation of salivary gland function using diffusion-weighted magnetic resonance imaging for follow-up of radiation-induced xerostomia[J]. Korean J Radiol, 2018, 19(4): 758–766. DOI:10.3348/kjr.2018.19.4.758 |
| [4] | McDowell LJ, Rock K, Xu W, et al. Long-term late toxicity, quality of life, and emotional distress in patients with nasopharyngeal carcinoma treated with intensity modulated radiation therapy[J]. Int J Radiat Oncol Bio Phys, 2018, 102(2): 340–352. DOI:10.1016/j.ijrobp.2018.05.060 |
| [5] | Lal P, Nautiyal V, Verma M, et al. Objective and subjective assessment of xerostomia in patients of locally advanced head-and-neck cancers treated by intensity-modulated radiotherapy[J]. J Cancer Res Ther, 2018, 14(6): 1196–1201. |
| [6] | Kanmaz L, Karavas E. The role of diffusion-weighted magnetic resonance imaging in the differentiation of head and neck masses[J]. J Clin Med, 2018, 7(6): pii: E130. DOI:10.3390/jcm7060130 |
| [7] | Chung SR, Choi YJ, Suh CH, et al. Diffusion-weighted magnetic resonance imaging for predicting response to chemoradiation therapy for head and neck squamous cell carcinoma: a systematic review[J]. Korean J Radiol, 2019, 20(4): 649–661. DOI:10.3348/kjr.2018.0446 |
| [8] | Xu J, Zhang K, Wang H, et al. Clinical application of diffusion-weighted magnetic resonance imaging in radiotherapy for nasopharyngeal carcinoma[J]. J Xray Sci Technol, 2019, 27(2): 297–306. |
| [9] | Dirix P, De Keyzer F, Vandecaveye V, et al. Diffusion-weighted magnetic resonance imaging to evaluate major salivary gland function before and after radiotherapy[J]. Int J Radiat Oncol Biol Phys, 2008, 71(5): 1365–1371. DOI:10.1016/j.ijrobp.2007.12.011 |
| [10] | Juan CJ, Cheng CC, Chiu SC, et al. Temporal evolution of parotid volume and parotid apparent diffusion coefficient in nasopharyngeal carcinoma patients treated by intensity-modulated radiotherapy investigated by magnetic resonance imaging: a pilot study[J]. PLoS One, 2015, 10(8): e0137073. DOI:10.1371/journal.pone.0137073 |
| [11] | Teshima K, Murakami R, Yoshida R, et al. Histopathological changes in parotid and submandibular glands of patients treated with preoperative chemoradiation therapy for oral cancer[J]. J Radiat Res, 2012, 53(3): 492–496. |
| [12] | 李眉, 王振常, 戴皓洁, 等. 味觉刺激弥散加权成像评价正常涎腺功能[J]. 中国医学影像技术, 2009, 25(11): 1992–1995. [ Li M, Wang ZC, Dai YJ, et al. Evaluation of normal parotid function by diffusion-weighted imaging of taste stimuli[J]. Zhongguo Yi Xue Ying Xiang Ji Shu, 2009, 25(11): 1992–1995. DOI:10.3321/j.issn:1003-3289.2009.11.016 ] |
| [13] | Zhang Q, Wei YM, Qi YG, et al. Early changes in apparent diffusion coefficient for salivary glands during radiotherapy for nasopharyngeal carcinoma associated with xerostomia[J]. Korean J Radiol, 2018, 19(2): 328–333. DOI:10.3348/kjr.2018.19.2.328 |
| [14] | Sim C, Soong YL, Pang E, et al. Xerostomia, salivary characteristics and gland volumes following intensity-modulated radiotherapy for nasopharyngeal carcinoma: a two-year follow up[J]. Aust Dent J, 2018, 63(2): 217–223. |
 2019, Vol. 46
2019, Vol. 46
