文章信息
- 乳腺癌MCF-7细胞中LncRNA XIST的表达及功能研究
- Expression and Functional of LncRNA XIST in MCF-7 Breast Cancer Cells
- 肿瘤防治研究, 2019, 46(12): 1062-1067
- Cancer Research on Prevention and Treatment, 2019, 46(12): 1062-1067
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.19.0346
- 收稿日期: 2019-03-18
- 修回日期: 2019-10-08
2. 030001 太原,山西医科大学第二医院输血科;
3. 030013 太原,山西省肿瘤医院病理科
2. Department of Blood Transfusion, Second Hospital of Shanxi Medical University, Taiyuan 030001, China;
3. Department of Pathology, Shanxi Provincial Cancer Hospital, Taiyuan 030013, China
乳腺癌是女性常见的恶性肿瘤,严重威胁着全球女性的健康[1]。2019年的癌症统计数据表明,乳腺癌占女性新发肿瘤的30%,病死率为15%,与2018年的癌症统计数据相比,乳腺癌仍位居女性新发肿瘤的第一位、肿瘤相关死亡原因第二位,且病死率呈上升趋势[2-3]。因此,阐明乳腺癌发生发展的病理生理学过程,不仅有利于筛选新的高灵敏度和高特异性生物学分子标志物,也有助于找寻新的分子治疗靶点,从而达到控制乳腺癌发病率、降低乳腺癌死亡率的目的。
lncRNA XIST(X inactive specific transcript)即X染色体失活特异性转录本,是长链非编码RNA(long non-coding RNA, lncRNA)家族成员之一,位于X染色体失活中心[4],是哺乳动物中X染色体失活的主要调节因子。最近的研究表明XIST在结直肠癌[5]、胃癌[6]、骨肉瘤[7]等许多肿瘤的发生发展中发挥着重要作用,而且在不同肿瘤中其作用的分子机制有所不同,但是在乳腺癌中的作用尚未完全阐明。在前期研究中,我们通过文献查阅发现XIST在乳腺癌组织和细胞系中的表达降低[8],并利用qRT-PCR检测了乳腺癌组织及癌旁正常组织中XIST的表达水平,发现XIST在乳腺癌组织中的表达水平明显低于在癌旁正常组织中的表达水平,因此在本研究中我们首先通过qRT-PCR检测人乳腺正常上皮细胞以及乳腺癌细胞系中XIST的表达水平,并通过细胞实验进一步检测XIST对乳腺癌细胞功能的影响,尽可能揭示其中潜在的分子机制。
1 材料与方法 1.1 细胞和主要试剂人乳腺癌细胞系MCF-7和正常乳腺上皮细胞MCF-10A购自中国科学院上海生命科学研究院细胞资源中心。lncRNA XIST过表达质粒及其阴性对照质粒为本课题组构建,miR-130b-3p Inhibitor和miRNA阴性对照购自上海吉玛制药有限公司。
RPMI 1640培养基和DMEM/F12(1:1)培养基购自以色列BI公司,胎牛血清购自四季青公司,胰岛素(INS)和表皮生长因子(EGF)购自加拿大Abm公司,Lipofectamine 2000购自美国Invitrogen公司,TRIzol购自日本TaKaRa公司,InRcute lncRNA cDNA第一链合成试剂盒(去基因组)、lnRcute lncRNA荧光定量检测试剂盒(SYBR Green)、miRcute增强型miRNA cDNA第一链合成试剂盒和miRcute增强型miRNA荧光定量检测试剂盒(SYBR Green)购自天根生化科技有限公司,qRT-PCR所用特异性引物(表 1)由上海生工生物工程股份有限公司合成,噻唑蓝(MTT)和结晶紫购自索莱宝科技有限公司,Transwell小室购自美国Corning公司。
MCF-7细胞用含10%胎牛血清的RPMI1640培养基培养,MCF-10A细胞用含5%胎牛血清、10 μg/ml INS、20 ng/ml EGF和500 ng/ml氢化可的松的DMEM/F12(1:1)培养基中培养。所用的培养基中均添加适量青霉素-链霉素-庆大霉素混合溶液,使其终浓度为100 U/ml的青霉素、100 μg/ml的链霉素和0.05 mg/ml的庆大霉素。MCF-7和MCF-10A细胞均置于37℃、5%CO2的培养箱中培养。
1.2.2 RNA提取、反转录及qRT-PCR检测按照TRIzol说明书提取细胞总RNA;以2 μg总RNA为模板,按照InRcute lncRNA cDNA第一链合成试剂盒(去基因组)和miRcute增强型miRNA cDNA第一链合成试剂盒分别进行反转录,所得cDNA产物保存在-20℃冰箱中;以相应cDNA为模板,按照lnRcute lncRNA荧光定量检测试剂盒(SYBR Green)和miRcute增强型miRNA荧光定量检测试剂盒(SYBR Green)说明书进行qRT-PCR扩增检测,其中lncRNA XIST检测以GAPDH为内参,miRNA检测以U6为内参,根据2-ΔΔCt值计算相对表达量。
1.2.3 细胞转染转染前一天取对数生长期的MCF-7细胞接种于6孔板中,细胞密度达60%~80%时按照Lipofectamine 2000说明书进行操作,将XIST过表达质粒(XIST overexpression)及其阴性对照质粒(Blank)或miR-130b-3p Inhibitor及miRNA阴性对照(Inhibitor N.C)分别转入MCF-7细胞中,转染过程中使用无血清、无抗生素的RPMI1640培养基,转染6 h后更换为含10%胎牛血清的RPMI1640培养基,转染24 h后收集细胞,qRT-PCR检测细胞中lncRNA XIST和miRNA的表达水平,进行后续实验。
1.2.4 MTT法检测细胞增殖能力将转染24 h的细胞消化、重悬,制备单细胞悬液,按每孔2 000个细胞接种于96孔板中,于37℃、5%CO2的培养箱中培养,每组设4个复孔。分别在第1、2、3、4和5天检测MCF-7细胞的增殖能力,具体操作如下:吸去旧培养基,每孔加入200 μl含10%胎牛血清的RPMI1640培养基培养和20 μl MTT溶液,培养箱内孵育4 h;吸去上清液,每孔加入150 μl二甲基亚砜,振荡10 min,用酶标仪在570 nm波长处检测各孔的吸光度值(OD)。
1.2.5 Transwell小室迁移实验将转染24 h的细胞消化、重悬,用无血清的培养基制备单细胞悬液,细胞浓度为3×104个每毫升,Transwell小室的上室中加入200 μl细胞悬液,下室中加入500 μl含10%胎牛血清的RPMI1640培养基培养,于37℃、5%CO2的培养箱中继续培养,每组设3个复孔。24 h后,用棉签小心擦去上室中的细胞,将小室用PBS洗3次,然后用4%多聚甲醛固定液室温固定20 min,用棉签吸去上室中液体,0.1%结晶紫室温避光染色10 min,流水冲洗小室,晾干水分后拍照并计数。
1.2.6 Transwell小室侵袭实验将预冷的Matrigel胶与无血清的RPMI 1640培养基按1:9比例混匀,按每孔80 μl将胶均匀包被于Transwell小室底部膜内,置于培养箱中使之成胶。其余步骤与细胞迁移实验相同。
1.2.7 生物信息学预测XIST靶向的miRNA利用生物信息学数据库(starBase V2.0)在线查找与XIST序列有潜在结合位点的miRNA。
1.3 统计学方法所得数据用平均值±标准差(x±s)表示,采用GraphPad Prism 5.0软件进行统计分析。两组间采用student’s t检验,P < 0.05为差异有统计学意义。
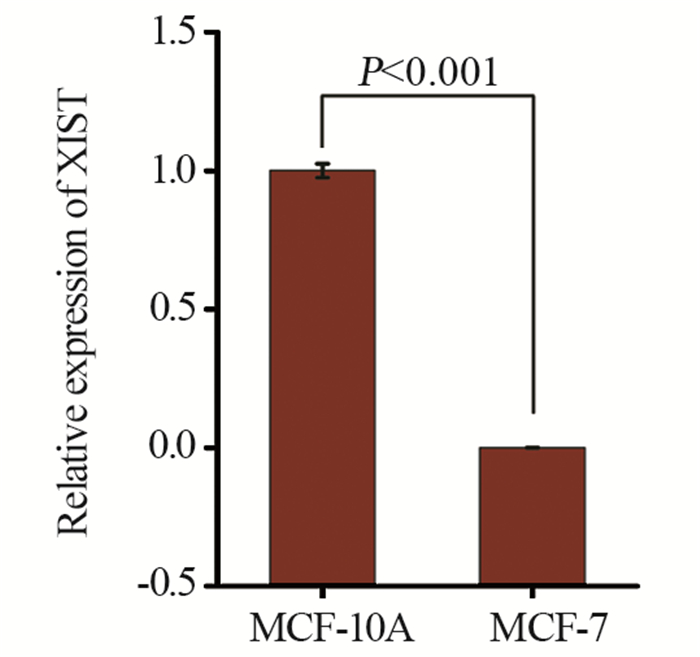
2 结果 2.1 XIST在乳腺癌细胞MCF-7中低表达qRT-PCR检测结果显示,XIST在乳腺癌细胞MCF-7中的表达水平远低于在乳腺正常上皮细胞MCF-10A中的表达水平,且差异有统计学意义(P < 0.001),见图 1。
|
| 图 1 XIST在乳腺癌细胞MCF-7中低表达 Figure 1 XIST expression in MCF-7 breast cancer cells was lower than that in MCF-10A normal breast epithelial cells |
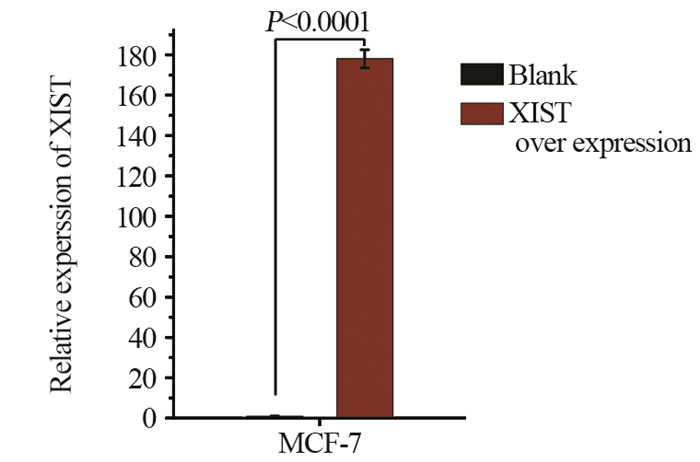
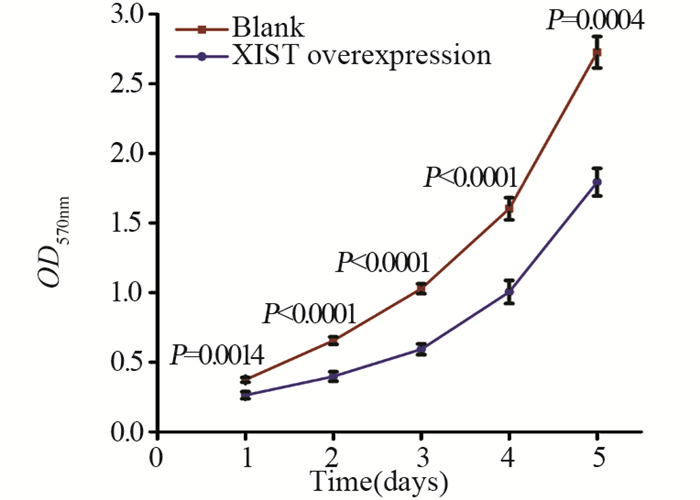
qRT-PCR检测结果显示,与Blank组相比,转染XIST过表达质粒后MCF-7细胞中XIST表达水平明显提高,且差异有统计学意义(P < 0.0001),见图 2。MTT法检测结果显示,与阴性对照组相比,XIST过表达后MCF-7细胞的增殖能力明显受到抑制,且差异有统计学意义(P < 0.001),见图 3。
|
| 图 2 XIST转染后XIST表达水平增加 Figure 2 XIST transfection increased XIST expression in MCF-7 breast cancer cells |
|
| 图 3 XIST过表达可抑制MCF-7细胞的增殖能力 Figure 3 XIST overexpression inhibited proliferation of MCF-7 cells |
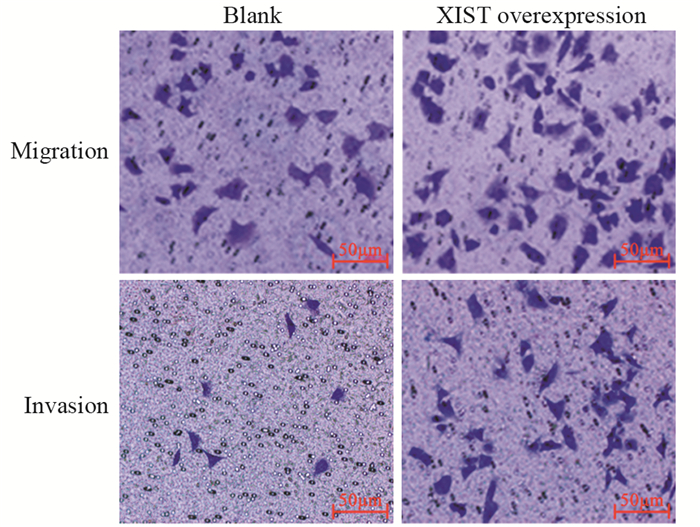
Transwell小室迁移和侵袭实验结果显示,与Blank组相比,XIST overexpression组细胞数量明显增加,表明XIST过表达后MCF-7细胞的迁移和侵袭能力明显增强(P=0.0024),见图 4。
|
| 图 4 XIST过表达可促进MCF-7细胞的迁移和侵袭能力(×100) Figure 4 XIST overexpression promoted migration and invasion of MCF-7 cells (×100) |
starBase V2.0预测结果表明与XIST有潜在结合的miRNA共有8个,分别为miR-130b-3p、miR-10b-5p、miR-92b-3p、miR-454-3p、miR-106a-5p、miR-20a-5p、miR-301a-3p和miR-106b-5p;根据qRT-PCR检测结果筛选出2-ΔΔCt≥2或2-ΔΔCt≤0.5的miRNA作为本实验确定差异表达的miRNA,同时查阅文献寻找与XIST过表达对乳腺癌MCF-7细胞生物学进程影响一致的miRNA,发现miR-130b-3p是唯一符合条件的miRNA,见表 2。
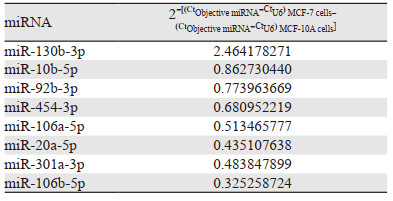
|
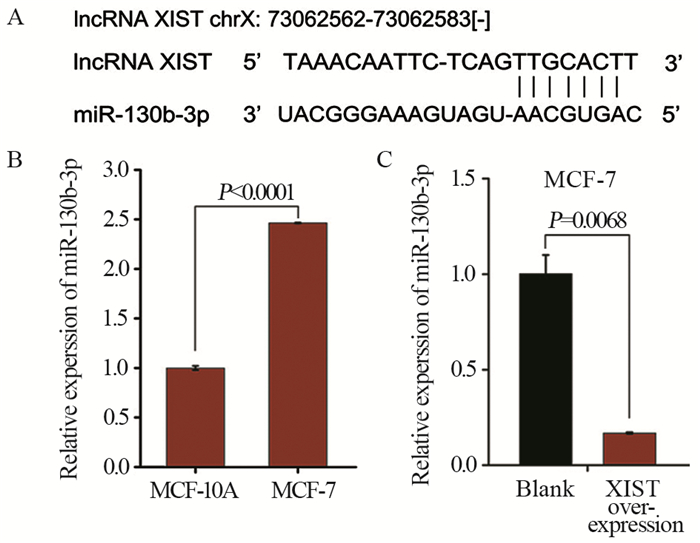
miR-130b-3p序列以及与所研究的XIST序列按照碱基互补配对原则的结合位点见图 5A。qRT-PCR检测结果表明,miR-130b-3p在乳腺癌MCF-7细胞中的表达水平明显高于在乳腺正常上皮细胞MCF-10A中的表达,且差异有统计学意义(P < 0.0001);与Blank组相比,XIST过表达后MCF-7细胞中miR-130b-3p表达水平显著降低(P=0.0068),见图 5B、5C。
|
| A: StarBase V2.0 software was used to predict the binding sites of miR-130b-3p to XIST; B: the expression of microRNA-130b-3p in MCF-10A and MCF-7 cells were detected by qRT-PCR; C: the expression of miR-130b-3p in MCF-7 cells transfected with XIST or its negative control plasmid were detected by qRT-PCR. 图 5 XIST过表达可降低MCF-7细胞中miR-130b-3p的表达水平 Figure 5 Overexpression of XIST reduced expression of microRNA-130b-3p in MCF-7 cells |
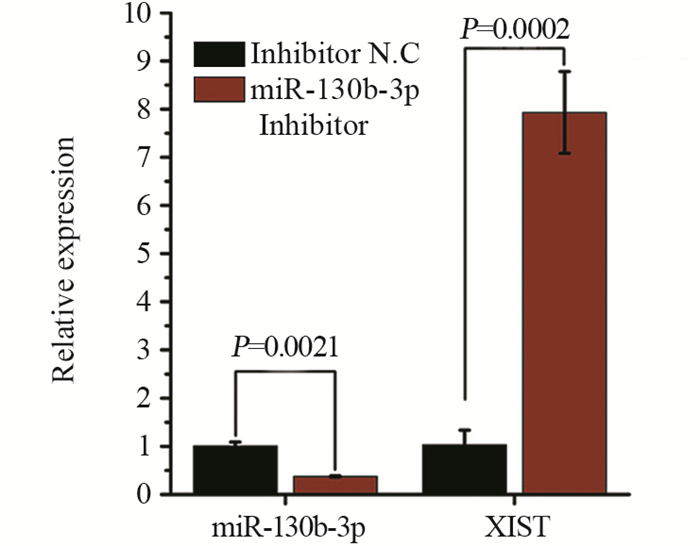
qRT-PCR检测结果表明,miR-130b-3p Inhibitor及Inhibitor N.C瞬时转染乳腺癌MCF-7细胞后,与Inhibitor N.C组相比,miR-130b-3p Inhibitor组miR-130b-3p的表达水平明显降低且差异有统计学意义(P < 0.01);与Inhibitor N.C组相比,miR-130b-3p Inhibitor组细胞中XIST表达水平显著增加(P < 0.001),见图 6。
|
| 图 6 miR-130b-3p低表达可增加MCF-7细胞中XIST的表达水平 Figure 6 Low-expression of miR-130b-3p increased expression of XIST in MCF-7 cells |
随着社会的发展,人们的生活方式、饮食习惯以及自然环境都发生着巨大的变化,乳腺癌发病人数逐年增加。乳腺癌不仅严重威胁患者的健康,还给患者家庭带来沉重的经济负担,而且乳腺癌治疗带来的乳房缺陷、脱发、皮肤颜色改变等各种身体改变会使患者产生明显的羞耻感,也称为病耻感,是一种负面的内在感受,给患者自身、家庭甚至社会带来不良影响远远超出疾病本身[9]。因此,寻找乳腺癌高灵敏度、高特异性的生物学分子标志物和有效的分子治疗靶点迫在眉睫。
研究结果表明lncRNA虽不编码或极少编码蛋白,但在人类基因的表达调控中发挥着重要作用[10],它在表观遗传、转录及转录后水平调控基因表达的机制众多,其中一种机制是lncRNA作为分子海绵,竞争性结合miRNA,从而影响miRNA对靶基因的调控[11]。作为lncRNA家族的成员,XIST在许多肿瘤中表达异常,与肿瘤的发生发展密切相关[5-7]。近年的研究结果表明XIST可作为多种miRNA的分子海绵在特定的肿瘤中发挥调控作用,也可作为一种miRNA的分子海绵在多种肿瘤中发挥调控作用。如XIST在结直肠癌中高表达,其可通过miR-200b-3p调节结直肠癌的进展和转移,也可通过miR-486-5p/神经黏蛋白-2(NRP-2)促进结直肠癌细胞的增殖和上皮-间质转化,还可通过miR-132-3p在结直肠癌中发挥致癌作用[5, 12-13];XIST在胃癌中高表达,可通过miR-497/MACC1促进胃癌细胞生长和侵袭,也可通过miR-185/TGF-β1促进胃癌的发展,还可通过miR-101/EZH2调控胃癌发展的进程[6, 14-15]。而XIST在乳腺癌方面的研究较少,所涉及的miRNA目前只有三种,即miR-155[16]、miR-503[17]和miR-20a[18],且只有miR-155和miR-20a被证实能与XIST通过结合位点直接结合。因此,XIST在乳腺癌细胞中的作用及其对乳腺癌的调控机制具有深入的研究价值。
MTT检测结果表明XIST过表达可抑制MCF-7细胞的增殖,与Zheng[16]和Zhao等[18]的研究结果一致,进一步证实了XIST过表达对乳腺癌细胞增殖的影响,但Transwell小室迁移和侵袭实验结果表明XIST过表达可促进MCF-7细胞的迁移和侵袭,与Zheng[16]和Zhao等[18]的研究结果相反,进一步分析发现,Zheng等[16]主要研究的是chrX:73069396-73069414所转录的XIST片段,Zhao等[18]主要研究的是chrX:73042794-73042817所转录的XIST片段,而本文研究的主要是chrX:73062562-73062583所转录的XIST片段。于是我们推测:这几项研究中XIST过表达对MCF-7细胞迁移和侵袭的影响不同可能是因为XIST序列的不同片段可竞争结合的miRNA不同。我们利用starBase V2.0软件预测与XIST有结合位点的miRNA,并结合qRT-PCR检测结果以及已有的文献资料,发现miR-130b-3p与本研究所构建的XIST过表达序列有结合位点,且miR-130b-3p在乳腺癌细胞MCF-7中的表达水平明显高于人正常乳腺上皮细胞MCF-10A中的表达水平;此外Miao等[19]的研究结果表明miR-130b过表达可促进MCF-7细胞的增殖,Shui等[20]的研究结果表明miR-130b-3p过表达可抑制MCF-7细胞的迁移和侵袭,与本文研究结果一致。本研究中XIST对乳腺癌细胞功能的影响可能是通过XIST作为分子海绵竞争性结合miR-130b-3p,然后抑制miR-130b-3p的表达来实现的。为证实这一推测,本研究利用lncRNA XIST过表达质粒及其阴性对照质粒或miR-130b-3p Inhibitor及Inhibitor N.C瞬时转染MCF-7细胞并用qRT-PCR进行检测,结果表明XIST过表达后MCF-7细胞中miR-130b-3p的表达水平降低,而miR-130b-3p低表达后MCF-7细胞中XIST的表达水平增加。
综上所述,在乳腺癌MCF-7细胞中XIST低表达、miR-130b-3p高表达,二者呈负相关,而XIST过表达可抑制MCF-7细胞增殖、促进细胞迁移和侵袭,这可能是通过抑制miR-130b-3p表达来调控的,但其具体机制需要进一步证实。
作者贡献
侯霞:实验设计、实验实施以及论文撰写
周永安:实验设计、论文修改及研究经费获取
田树雄、李超:实验指导、论文修改
李敏、任蕊蕊、韩雅馨、程建萍:提供技术支持,审阅文章
李星星、李哲、白园:数据采集和统计分析
| [1] |
Akram M, Iqbal M, Daniyal M, et al. Awareness and current knowledge of breast cancer[J]. Biol Res, 2017, 50(1): 33. DOI:10.1186/s40659-017-0140-9 |
| [2] |
Siegel RL, Miller KD, Jemal A. Cancer Statistics, 2019[J]. CA Cancer J Clin, 2019, 69(1): 7-34. DOI:10.3322/caac.21551 |
| [3] |
Siegel RL, Miller KD, Jemal A. Cancer Statistics, 2018[J]. CA Cancer J Clin, 2018, 68(1): 7-30. DOI:10.3322/caac.21442 |
| [4] |
Engreitz JM, Pandya-Jones A, McDonel P, et al. The Xist lncRNA exploits three-dimensional genome architecture to spread across the X chromosome[J]. Science, 2013, 341(6147): 1237973. DOI:10.1126/science.1237973 |
| [5] |
Chen DL, Chen LZ, Lu YX, et al. Long noncoding RNA XIST expedites metastasis and modulates epithelial-mesenchymal transition in colorectal cancer[J]. Cell Death Dis, 2017, 8(8): e3011. DOI:10.1038/cddis.2017.421 |
| [6] |
Ma L, Zhou Y, Luo X, et al. Long non-coding RNA XIST promotes cell growth and invasion through regulating miR-497/MACC1 axis in gastric cancer[J]. Oncotarget, 2017, 8(3): 4125-4135. |
| [7] |
Wang W, Shen H, Cao G, et al. Long non-coding RNA XIST predicts poor prognosis and promotes malignant phenotypes in osteosarcoma[J]. Oncol Lett, 2019, 17(1): 256-262. |
| [8] |
Chaligné R, Popova T, Mendoza-Parra MA, et al. The inactive X chromosome is epigenetically unstable and transcriptionally labile in breast cancer[J]. Genome Res, 2015, 25(4): 488-503. DOI:10.1101/gr.185926.114 |
| [9] |
Odigie VI, Tanaka R, Yusufu LM, et al. Psychosocial effects of mastectomy on married African women in Northwestern Nigeria[J]. Psychooncology, 2010, 19(8): 893-897. |
| [10] |
Lipovich L, Johnson R, Lin CY. MacroRNA underdogs in a microRNA world: evolutionary, regulatory, and biomedical significance of mammalian long non-protein-coding RNA[J]. Biochim Biophys Acta, 2010, 1799(9): 597-615. DOI:10.1016/j.bbagrm.2010.10.001 |
| [11] |
Du Z, Sun T, Hacisuleyman E, et al. Integrative analyses reveal a long noncoding RNA-mediated sponge regulatory network in prostate cancer[J]. Nat Commun, 2016, 7: 10982. DOI:10.1038/ncomms10982 |
| [12] |
Liu A, Liu L, Lu H. LncRNA XIST facilitates proliferation and epithelial- mesenchymal transition of colorectal cancer cells through targeting miR-486-5p and promoting neuropilin-2[J]. J Cell Physiol, 2019, 234(8): 13747-13761. DOI:10.1002/jcp.28054 |
| [13] |
Song H, He P, Shao T, et al. Long non-coding RNA XIST functions as an oncogene in human colorectal cancer by targeting miR-132-3p[J]. J BUON, 2017, 22(3): 696-703. |
| [14] |
Zhang Q, Chen B, Liu P, et al. XIST promotes gastric cancer (GC) progression through TGF-β1 via targeting miR-185[J]. J Cell Biochem, 2018, 119(3): 2787-2796. DOI:10.1002/jcb.26447 |
| [15] |
Chen DL, Ju HQ, Lu YX, et al. Long non-coding RNA XIST regulates gastric cancer progression by acting as a molecular sponge of miR-101 to modulate EZH2 expression[J]. J Exp Clin Cancer Res, 2016, 35(1): 142. DOI:10.1186/s13046-016-0420-1 |
| [16] |
Zheng R, Lin S, Guan L, et al. Long non-coding RNA XIST inhibited breast cancer cell growth, migration, and invasion via miR-155/CDX1 axis[J]. Biochem Biophys Res Commun, 2018, 498(4): 1002-1008. DOI:10.1016/j.bbrc.2018.03.104 |
| [17] |
Xing F, Liu Y, Wu SY, et al. Loss of XIST in breast cancer activates MSN-c-Met and reprograms microglia via exosomal miRNA to promote brain metastasis[J]. Cancer Res, 2018, 78(15): 4316-4330. DOI:10.1158/0008-5472.CAN-18-1102 |
| [18] |
Zhao L, Zhao Y, He Y, et al. The functional pathway analysis and clinical significance of miR-20a and its related lncRNAs in breast cancer[J]. Cell Signal, 2018, 51: 152-165. DOI:10.1016/j.cellsig.2018.08.004 |
| [19] |
Miao Y, Zheng W, Li N, et al. MicroRNA-130b targets PTEN to mediate drug resistance and proliferation of breast cancer cells via the PI3K/Akt signaling pathway[J]. Sci Rep, 2017, 7: 41942. DOI:10.1038/srep41942 |
| [20] |
Shui Y, Yu X, Duan R, et al. MiR-130b-3p inhibits cell invasion and migration by targeting the Notch ligand Delta-like 1 in breast carcinoma[J]. Gene, 2017, 609: 80-87. DOI:10.1016/j.gene.2017.01.036 |
 2019, Vol. 46
2019, Vol. 46