文章信息
- GSTP-1基因遗传变异对术后接受替莫唑胺联合放疗的脑胶质瘤患者预后的影响
- Influence of GSTP-1 Genetic Variation on Prognosis of Postoperative Glioblastoma Patients Received Temozolomide Combined with Radiotherapy Regimens
- 肿瘤防治研究, 2019, 46(11): 982-986
- Cancer Research on Prevention and Treatment, 2019, 46(11): 982-986
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.19.0344
- 收稿日期: 2019-05-20
- 修回日期: 2019-07-25
脑胶质瘤(Glioblastoma)起源于神经胶质细胞,目前脑胶质瘤在我国每年新发病例5万人左右[1]。近年来,术后放疗联合替莫唑胺的耐药机制以及探讨对同步放化疗敏感的生物标志物是当前脑胶质瘤领域的研究热点。
1.8~2.0 Gy/次共计54~60 Gy仍然是目前治疗高级别胶质瘤的标准剂量方案。另外,替莫唑胺具有广谱的抗肿瘤活性,通过口服吸收,以接近100%的生物利用度进入全身血液循环,通过甲基化加成物的错配修复发挥细胞毒作用[2]。因此,替莫唑胺同步放疗成为术后高级别脑胶质瘤的标准治疗。
谷胱甘肽S-转移酶P-1(Glutathione S-Transferase P-1, GSTP-1)基因位于11q13.2,包含7个外显子。在中国人群中,对该基因多态性的研究尚不多。研究发现,在接受同步放化疗治疗的高加索人群的胶质瘤患者中,位于GSTP-1基因编码区的Ile105Val位点和总生存期相关[3],也有研究表明该位点与接受以铂类为基础的化疗药物引起的骨髓抑制显著相关[4]。因此,本研究旨在探讨GSTP-1基因遗传变异对术后接受替莫唑胺联合放疗的脑胶质瘤患者预后的影响,并探讨该位点和GSTP-1 mRNA表达的相关性。
1 资料与方法 1.1 研究设计及治疗方案回顾性分析2010年1月—2018年6月河南省肿瘤医院脑外科术后接受替莫唑胺联合放疗的脑胶质瘤患者175例,入组标准:组织学确诊为高级别胶质瘤且接受手术切除治疗;年龄≥18岁;ECOG评分0~2分;肝肾功能、血常规正常(中性粒细胞计数≥1.5×109/L,血小板计数≥100×109/L)。排除标准:合并其他肿瘤或严重疾病的患者;没有接受术后替莫唑胺联合放疗的患者。主要研究终点为无进展生存期(PFS),次要终点为总生存期(OS)以及药物基因组学分析。
放疗的实施方案为:接受手术切除后6周以内开始放疗计划,结合患者情况给予总剂量54 Gy或60 Gy,30次分割,1.8或2.0 Gy/次,每天1次,每周前5天,共计6周。替莫唑胺用法用量为:同步放疗期间,和化疗同一天开始,75 mg/m2每天,共计42天,治疗过程中根据患者耐受情况可暂停用药,但总服药期不超过49天。同步放化疗结束后4周,患者接受6周期的替莫唑胺单药辅助化疗,第1个周期150 mg/m2,随后每周期200 mg/m2,第1~5天,28天一个周期。治疗过程中根据患者的耐受情况调整替莫唑胺的治疗周期。本研究得到医院伦理委员会的批准,每个入组的患者或者家属均签署了知情同意书。根据RECIST 1.1标准进行疗效评估。
1.2 标本收集及基因分型入组的患者在接受放化疗前用EDTA抗凝管收集外周血样本4 ml,用苯酚氯仿法提取基因组DNA,进行后续PCR扩增。GSTP-1基因Ile105Val(rs1695)位点的基因分型通过限制性片段长度多态性聚合酶链反应(PCR-RFLP)方法进行。扩增包含该位点的PCR产物的上游引物为:5'-CCCCAGTGACTGTGTGTTGA-3',下游引物为:5'-CAAGAAGCCCCTTTCTTTGT-3'。PCR产物大小为226 bp,通过限制性内切酶Tail对产物进行孵育消化,通过条带的大小判断基因型。
1.3 PBMC样本收集及GSTP-1 mRNA表达分析从入组的175例患者中另外收集接受放化疗前的新鲜外周血样本,用来提取外周血单核细胞(peripheral blood mononuclear cell, PBMC),最终纳入表达分析的PBMC标本为78例,液氮保存。TRIzol试剂进行RNA提取,上游引物为:5'-GTAGTTTGCCCAAGGTCAAG-3',下游引物为:5'-AGCCACCTGAGGGGTAAG-3',扩增产物大小为498 bp。实时定量PCR反应体系如下:SYBN Premix Ex Tag溶液10 μl,GSTP-1上游引物(20 μmol/L)0.2 μl,下游引物(20 μmol/L)0.2 μl,ddH2O 7.6 μl,cDNA 2 μl,反应体系总计20 μl,之后用罗氏Real-time PCR仪器进行GSTP-1 mRNA表达实验,用相对定量法2 -ΔΔCt进行计算。
1.4 统计学方法所有变量均采用SPSS19.0统计软件进行分析。在基线临床资料当中,离散型的变量和Ile105Val位点不同基因型的分布采用χ2检验。连续型的变量和该位点不同基因型的分析采用非参检验的Mann-Whitney U检验。用Stata14.0绘制Kaplan-Meier曲线比较不同基因型患者PFS和OS的差异,曲线间的差异用对数秩检验进行统计学差异的比较。PFS为患者接受手术切除治疗的时间到出现肿瘤进展或者死亡的时间。OS为患者接受手术切除治疗到死亡的时间。多变量分析时,对OS的多变量分析构建Cox风险比例模型,P < 0.05为差异有统计学意义。
2 结果 2.1 患者基线临床资料及GSTP-1 Ile105Val位点基因分型情况纳入研究的175例脑胶质瘤患者的基线临床资料见表 1。Ile105Val位点的基因分型结果为:G/G型119例(68.00%),G/A型51例(29.14%),A/A型5例(2.86%),最小等位基因频率为0.17,该位点基因型分布频率符合Hardy-Weinberg平衡(P=0.868)。由于A/A型患者较少,后期分析中将G/A型和A/A型患者合并。Ile105Val位点不同基因型患者在基线临床资料中分布均衡。

|
随访截至2018年10月,中位随访时间为29.5月(0.9~40月)。无进展生存期的分析,见图 1,携带A等位基因的G/A+A/A基因型和G/G基因型患者的中位无进展生存期(mPFS)分别为4.4和6.9月,差异有统计学意义(P=0.005)。
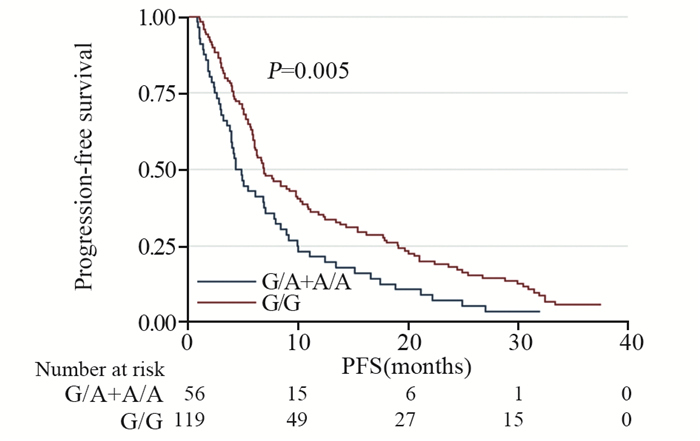
|
| 图 1 基因Ile105Val位点不同基因型的175例脑胶质瘤患者的无进展生存曲线 Figure 1 PFS curves of 175 glioblastoma patients according to GSTP-1 Ile105Val genotype status |
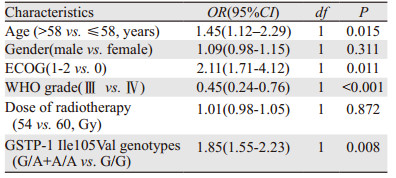
G/A+A/A型和G/G基因型患者的中位总生存期(mOS)分别为11.0和15.3月,差异有统计学意义(P < 0.001),见图 2。另外,为了校正其他混杂因素对OS的影响,本研究构建了Cox风险比例模型,将可能影响OS的风险因素,如年龄、性别、ECOG评分(1~2分为一组)、WHO分级、放疗剂量以及Ile105Val位点纳入该模型。经过多变量校正后结果,见表 2,Ile105Val位点对OS仍然具有独立的影响意义(OR=1.85, P=0.008)。另外其他的基线资料在Cox模型当中对OS具有独立影响意义的有年龄(OR=1.45, P=0.015)、ECOG评分(OR=2.11, P=0.011)、WHO分级(OR=0.45, P < 0.001)。
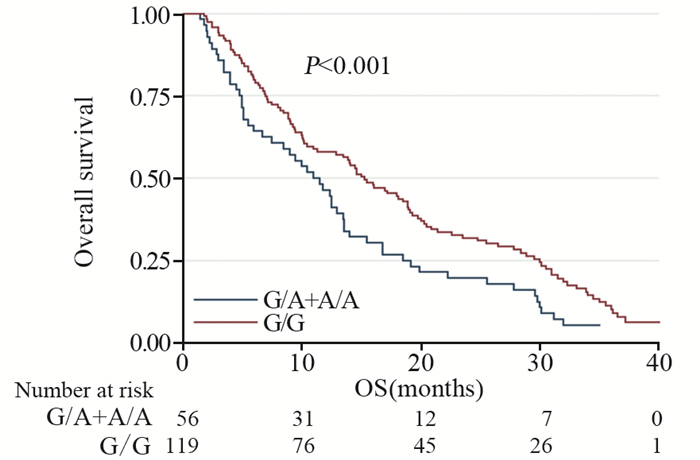
|
| 图 2 GSTP-1基因Ile105Val位点不同基因型的175例脑胶质瘤患者的总生存期曲线 Figure 2 Overall survival curves of 175 glioblastoma patients according to GSTP-1 Ile105Val genotype status |
|
在78例PBMC标本中,G/G型53例,G/A型23例,A/A型2例,三种基因型分布频率同样符合哈迪温伯格平衡(P=0.790)。A/A型患者相对较少,随后的分析中将A/A型和G/A型合并,共计25例。G/A+A/A基因型相对于野生型的G/G型患者,PBMC中GSTP-1 mRNA的相对表达明显较高(4.01±0.472 vs. 2.76±0.624),差异有统计学意义(P < 0.001),见图 3。
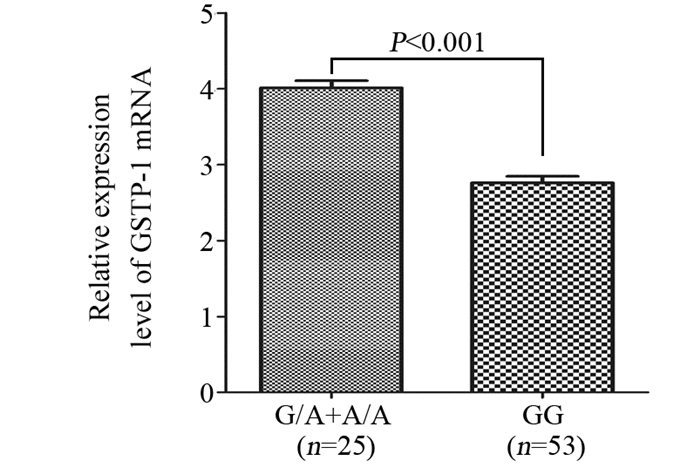
|
| 图 3 78例PBMC样本中GSTP-1基因Ile105Val位点不同基因型GSTP-1 mRNA相对表达情况 Figure 3 Relative GSTP-1 mRNA expression of 78 case of peripheral blood mononuclear cell (PBMC) specimens according to GSTP-1 Ile105Val genotype status |
本研究通过对GSTP-1基因Ile105Val位点基因分型并和患者的预后进行关联性分析,发现Ile105Val位点G/A+A/A基因型患者PFS和OS较差,另外在78例具有PBMC标本患者的mRNA表达水平分析中发现,该位点不同的基因型患者GSTP-1 mRNA表达水平呈现较大的差异。结果表明Ile105Val位点可能通过影响GSTP-1 mRNA的表达进而影响术后接受替莫唑胺同步放疗的脑胶质瘤患者的预后。
脑胶质瘤是异质性较强的恶性肿瘤,近年来给患者带来生存获益的治疗进展较为缓慢。目前,研究结果表明最大安全切缘的手术切除可以进一步明确诊断,改善神经功能症状并为术后辅助放化疗提供有利条件[5]。另外,大量的证据表明术后同步放化疗无论对于低级别还是高级别脑胶质瘤患者均具有明显的生存获益[6]。然而术后脑胶质瘤患者接受同步放化疗在临床治疗结果和预后上也有较大的个体差异,明确影响术后放化疗的预后因素有助于提高临床治疗脑胶质瘤的整体疗效。药物基因组学方面目前已经有较多预测脑胶质瘤预后的生物标志物的研究成果:2018年报道的血管内皮生长因子遗传变异位点rs1005230和胶质瘤的发病风险和预后显著相关[7]。2017年报道的MGMT基因启动子区域的多态性位点rs1625649对甲基化的脑胶质瘤患者预后具有显著影响[8]。随后报道的MC4R基因多态性rs489693位点在接受同步放化疗的脑胶质瘤患者中的疗效有预测价值[9]。
本研究结果发现在中国脑胶质瘤患者接受同步放化疗后,GSTP-1基因Ile105Val位点对患者预后具有明显的影响。首先,本研究中Ile105Val位点的最小等位基因频率为0.17,这和NCBI数据库中中国人群中的突变频率基本一致,但是从高加索人群的结果来看[10],该位点的基因型分布频率具有较大的种族差异。预后结果上,意大利Pasqualetti团队的研究[3]纳入50例IDH1/2基因野生型的接受同步放化疗的脑胶质瘤患者,分析了XRCC1、XRCC3、RAD51和GSTP-1基因多态性和PFS以及OS的关联,结果发现了GSTP-1基因rs1695位点A/A型患者预后较差,这和本研究中G/A+A/A基因型患者较差的预后基本一致。另外,在亚洲人群中,日本学者Yoshihama团队[11]的研究纳入了320例接受卡铂联合紫杉醇治疗的妇科肿瘤患者,分析了GSTP-1基因rs1695位点对患者的预后及安全性的影响,结果发现rs1695位点GG型患者与较高的血液学毒性相关,另外A等位基因携带者具有较差的预后,这和本研究的结果基本一致,但是该研究并没有评估此位点和GSTP-1 mRNA表达的关系。另外有研究发现,rs1695位点和接受顺铂为基础的化疗出现的不良反应有关,法国Lui团队[12]的研究纳入了161例接受顺铂或卡铂治疗的儿童肿瘤患者,结果发现rs1695位点A/A基因型患者和较多的耳毒性显著相关,这说明了该位点会对化疗药物有一定的作用,本研究未评估该位点和不良反应的关联,需进一步探索。
GSTP-1基因是谷胱甘肽S-转移酶家族中的一员,通过催化许多疏水和亲电化合物与还原型谷胱甘肽的结合进而发挥生物解读或生物转化的作用[13]。Ile105Val位点为非同义突变,位于该基因编码区改变了氨基酸序列,可能会影响GSTP-1基因表达以及GSTP-1蛋白的功能。关于GSTP-1基因表达水平和患者预后目前尚没有统一结论,目前有研究报道了GSTP-1在结直肠癌等肿瘤中为高表达状态[14]。Theisen团队的研究纳入32例晚期食管癌患者,通过分析GSTP-1基因表达状态和治疗反应率的相关性后发现,GSTP-1表达较低的患者具有较好的预后[15]。这和本研究mRNA表达分析的结果具有一致的趋势。GSTP-1基因在胶质瘤细胞外源性物质解毒过程中具有重要作用,因此阻止了外源性物质和胞内蛋白核酸的相互作用。早前有研究表明谷胱甘肽S-转移酶家族的蛋白在很多药物耐药的细胞系中具有较多的表达[16]。因此,GSTP-1蛋白阻止了替莫唑胺和肿瘤细胞核酸的结合从而使其部分损失了细胞毒作用,因此较高的GSTP-1表达通常会伴随着较差的替莫唑胺疗效及预后。
本研究也有局限性,首先纳入研究的样本量不大。另外,研究为回顾性的分析有一些偏倚无法避免。但本研究相对充分地对GSTP-1基因Ile105Val位点的预后影响意义进行了评估,同时也从mRNA表达层面揭示了该位点造成预后差异的部分原因,对术后接受替莫唑胺联合放疗的脑胶质瘤患者的预后评估具有一定的临床指导意义。
作者贡献
赵克:样本收集,临床资料整理、随访及预后评价,研究的整体设计,文章撰写
倪峰:数据处理,统计学分析,图表制作
刘康栋:研究的可行性及创新性评估,研究的宏观指导,研究经费的资助
| [1] |
Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132. DOI:10.3322/caac.21338 |
| [2] |
Jiapaer S, Furuta T, Tanaka S, et al. Potential Strategies Overcoming the Temozolomide Resistance for Glioblastoma[J]. Neurol Med Chir (Tokyo), 2018, 58(10): 405-421. DOI:10.2176/nmc.ra.2018-0141 |
| [3] |
Pasqualetti F, Gonnelli A, Cantarella M, et al. Association of Glutathione S-Transferase P-1 (GSTP-1) rs1695 polymorphism with overall survival in glioblastoma patients treated with combined radio-chemotherapy[J]. Invest New Drugs, 2018, 36(2): 340-345. DOI:10.1007/s10637-017-0516-2 |
| [4] |
Lv F, Ma Y, Zhang Y, et al. Relationship between GSTP1 rs1695 gene polymorphism and myelosuppression induced by platinum-based drugs: a meta-analysis[J]. Int J Biol Markers, 2018, 1724600818792897. |
| [5] |
Laprie A, Ken S, Filleron T, et al. Dose-painting multicenter phase Ⅲ trial in newly diagnosed glioblastoma: the SPECTRO-GLIO trial comparing arm A standard radiochemotherapy to arm B radiochemotherapy with simultaneous integrated boost guided by MR spectroscopic imaging[J]. BMC Cancer, 2019, 19(1): 167. DOI:10.1186/s12885-019-5317-x |
| [6] |
Herrlinger U, Tzaridis T, Mack F, et al. Lomustine-temozolomide combination therapy versus standard temozolomide therapy in patients with newly diagnosed glioblastoma with methylated MGMT promoter (CeTeG/NOA-09): a randomised, open-label, phase 3 trial[J]. Lancet, 2019, 393(10172): 678-688. DOI:10.1016/S0140-6736(18)31791-4 |
| [7] |
Linhares P, Viana-Pereira M, Ferreira M, et al. Genetic variants of vascular endothelial growth factor predict risk and survival of gliomas[J]. Tumour Biol, 2018, 40(3): 1010428318766273. |
| [8] |
Hsu CY, Ho HL, Lin SC, et al. The MGMT promoter single-nucleotide polymorphism rs1625649 had prognostic impact on patients with MGMT methylated glioblastoma[J]. PLoS One, 2017, 12(10): e0186430. DOI:10.1371/journal.pone.0186430 |
| [9] |
Pasqualetti F, Orlandi P, Simeon V, et al. Melanocortin Receptor-4 Gene Polymorphisms in Glioblastoma Patients Treated with Concomitant Radio-Chemotherapy[J]. Mol Neurobiol, 2018, 55(2): 1396-1404. DOI:10.1007/s12035-017-0414-9 |
| [10] |
Rezaei M, Saadat M. Association Between GSTP1 Ile105Val Genetic Polymorphism and Dependency to Heroin and Opium[J]. Biochem Genet, 2019, 57(2): 214-221. |
| [11] |
Yoshihama T, Fukunaga K, Hirasawa A, et al. GSTP1 rs1695 is associated with both hematological toxicity and prognosis of ovarian cancer treated with paclitaxel plus carboplatin combination chemotherapy: a comprehensive analysis using targeted resequencing of 100 pharmacogenes[J]. Oncotarget, 2018, 9(51): 29789-29800. |
| [12] |
Lui G, Bouazza N, Denoyelle F, et al. Association between genetic polymorphisms and platinum-induced ototoxicity in children[J]. Oncotarget, 2018, 9(56): 30883-30893. |
| [13] |
Wang S, Zhang J, Jun F, et al. Glutathione S-transferase pi 1 variant and squamous cell carcinoma susceptibility: a meta-analysis of 52 case-control studies[J]. BMC Med Genet, 2019, 20(1): 22. DOI:10.1186/s12881-019-0750-x |
| [14] |
Zhang R, Kang KA, Piao MJ, et al. Epigenetic alterations are involved in the overexpression of glutathione S-transferase π-1 in human colorectal cancers[J]. Int J Oncol, 2014, 45(3): 1275-1283. DOI:10.3892/ijo.2014.2522 |
| [15] |
Theisen J, Danenberg K, Ott K, et al. Predictors of response and survival for neoadjuvant treated patients with esophageal adenocarcinoma[J]. Dis Esophagus, 2008, 21(7): 601-606. DOI:10.1111/j.1442-2050.2008.00820.x |
| [16] |
Tew KD. Glutathione-associated enzymes in anticancer drug resistance[J]. Cancer Res, 1994, 54(16): 4313-4320. |
 2019, Vol. 46
2019, Vol. 46


