文章信息
- 沉默ANLN基因对胃癌细胞侵袭、迁移、增殖和凋亡的影响
- Effect of ANLN Gene Silencing on Invasion, Migration, Proliferation and Apoptosis of Gastric Cancer Cells
- 肿瘤防治研究, 2019, 46(10): 884-889
- Cancer Research on Prevention and Treatment, 2019, 46(10): 884-889
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.19.0338
- 收稿日期: 2019-03-18
- 修回日期: 2019-08-07
2. 201306 上海,上海市第六人民医院东院普外科;
3. 201306 上海,上海健康医学院附属第六人民医院东院普外科
2. Department of General Surgery, Shanghai Sixth People's Hospital East Campus, Shanghai 201306, China;
3. Department of General Surgery, Shanghai Sixth People's Hospital East Campus Affiliated to Shanghai University of Medicine & Health Sciences, Shanghai 201306, China
胃癌是一种消化道恶性肿瘤,目前仍然是一种重要的全球性癌症[1-3],是世界第五大常见癌症,第三大癌症死亡原因[4-5]。2018年新发现超过1 000 000新病例,并预计会有783 000例胃癌患者面临死亡。其中男性患者是女性患者的两倍。在最新发布的2016年中国城市恶性肿瘤中,胃癌位于第二位,仅次于肺癌[4]。由于早期症状缺乏特异性,大部分患者确诊已处于中晚期。胃癌的高发病率已经严重威胁到人类健康,尤其是东亚地区的中国,胃癌死亡率始终居高不下[4]。目前胃癌发病机制仍不明确[6],因此,对胃癌发生发展具体机制的研究十分迫切。
Anillin(ANLN)是一种编码肌动蛋白结合蛋白的基因,被认为是细胞分裂的重要组成部分[7]。ANLN蛋白是参与有丝分裂/胞质分裂的蛋白簇,是卵裂沟的一部分[8]。近来研究发现ANLN参与到多种恶性肿瘤发生、发展过程中,能够促进肿瘤细胞的生长、迁移和侵袭[9-13]。本研究通过沉默ANLN基因,研究其对胃癌细胞迁移、侵袭和凋亡的影响。
1 资料与方法 1.1 资料人胃癌细胞系MGC-803、SGC-7901与正常胃黏膜细胞GES-1购自中国科学院上海生命研究院细胞资源中心。
1.2 培养基与试剂胎牛血清(FBS)、Opti-MEM和RPMI1640培养基购自美国Gibco公司;细胞裂解液RIPA、ECL化学发光试剂盒、BCA检测试剂盒及DAPI染液购自上海碧云天生物技术有限公司;qRT-PCR引物、反转录试剂盒和PCR试剂盒均购自生工生物工程(上海)股份有限公司;凋亡试剂盒购自美国BD公司;TRITC标记鬼笔环肽购自上海翊圣生物科技有限公司。
1.3 实验方法 1.3.1 数据库数据获取从TCGA(https://cancergenome.nih.gov/)、Oncomine(https://www.oncomine.org/resource/main.html)和Xena Kaplan-Meier Plot Help(https://xena.ucsc.edu/survival-plots/)数据库获取231例胃腺癌及胃管状腺癌组织中ANLN表达量相关生存率情况的数据。从Oncomine(https://www.oncomine.org/resource/main.html)获取51例弥漫性胃癌及胃组织中ANLN表达量数据。
1.3.2 细胞培养人胃癌细胞SGC-7901、MGC-803及正常胃黏膜GES-1细胞培养于RPMI 1640培养基中(含8%胎牛血清(FBS)),37℃、5%CO2培养箱培养,用0.25%含EDTA的胰酶溶液进行常规消化。取对数生长期细胞进行后续实验。培养基中加入1%青霉素(100 u/ml)和链霉素(0.1 mg/ml)。每2天换液,3天传代一次。
1.3.3 siRNA合成与转染由广州市锐博生物科技有限公司设计并合成3条ANLN基因的编码区siRNA片段(siANLN-1、siANLN-2、siANLN-3),见表 1。将MGC-803、SGC-7901细胞按每孔1×105个细胞分别铺板六孔板。用不含抗生素的8%胎牛血清培养基培养至贴壁,融合度达70%~90%时转染。转染后6 h更换新的不含抗生素的8%胎牛血清培养基继续培养。siRNA干扰的MGC-803细胞和未转染的MGC-803细胞分别作为后续实验的实验组和对照组。
用TRIzol提取细胞中的总RNA,测定RNA的浓度和纯度。通过反转录试剂盒进行反转录。反转录完成后的cDNA稀释3~5倍,以其为模板进行qRT-PCR反应,以β-actin为内参,引物序列见表 2。每个样本设3个复孔。反应条件:95℃预变性3 min,95 ℃ 3 s,62℃ 30 s,72℃ 10 s,40个循环。
向六孔板细胞加入100 µl细胞裂解液(RIPA:PMSF=100:1),搜集细胞裂解液加入SDS上样缓冲液,煮沸10 min。电泳,转膜至NC膜上,10%脱脂奶粉室温封闭1 h,一抗室温孵育2 h,二抗室温孵育1 h,ECL显影拍照。抗体ANLN购于美国Abcam公司,辣根过氧化物酶标记的山羊抗鼠或山羊抗兔IgG购自上海碧云天生物技术有限公司。Western blot结果通过Image J软件进行灰度值分析。
1.3.6 细胞划痕实验将细胞按每孔加入5×105个细胞接种至6孔板并培养24 h;贴壁后转染24 h,用200 µl枪头垂直孔板上画线;PBS洗去悬浮细胞,RPMI1640培养基培养,放入37℃、5%CO2培养箱培养,按0、24、48 h取样拍照。根据划痕距离计算细胞迁移速率。
1.3.7 Transwell实验在24孔Transwell板上室加入80 μl基质胶(用无血清培养液按1:3稀释),放入37℃、5%CO2培养箱4 h;上室种植细胞密度为每孔2×105个细胞,实验开始后使用无血清的培养基;下室使用完全培养基;置于5%CO2、37℃的培养箱中培养;培养8 h后,上室弃去培养基,小心取出上室,擦去膜上未穿膜的细胞,40 g/L多聚甲醛固定,结晶紫染色,倒置显微镜下观察穿膜细胞,记录穿膜细胞数。
1.3.8 CCK-8法检测增殖实验转染后24 h取细胞,按每孔5 000个细胞种植在96孔板中,置于5%CO2、37℃的培养箱中培养;分别在0、1、2、3天每孔加10 μl CCK-8试剂,2 h后酶标仪检测450 nm波长处的光密度。
1.3.9 细胞荧光染色实验转染后24 h取细胞,PBS清洗2次后固定;Triton X-100溶液透化处理;TRITC标记鬼笔环肽染色30 min;DAPI染色30 s;荧光显微镜下拍照。
1.3.10 细胞周期实验转染后24 h取细胞,PBS清洗后70%乙醇固定,PI染色后常温避光30 min上机,流式细胞仪检测细胞周期。
1.3.11 细胞凋亡实验转染后24 h收集细胞,离心去上清液;用PI和FITC染料染色,常温避光15 min后在0.5 h内上机,流式细胞仪检测细胞凋亡率。
1.4 统计学方法所有实验均至少重复3次,采用SPSS19.0统计软件分析结果,计量资料用均数±标准差(x±s)表示。多组均数间的比较用单因素方差分析。检验水准α=0.05。
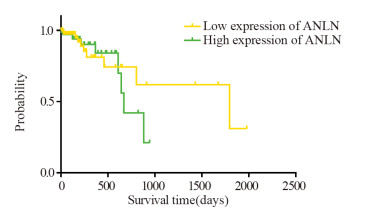
2 结果 2.1 ANLN异常表达影响胃癌生存率从TCGA/Oncomine/Xena Kaplan-Meier plot help数据库中获取的231例ANLN与胃癌生存率的数据显示ANLN高表达显著降低胃癌患者的总生存期,见图 1。
|
| 图 1 TCGA数据库获取231例胃腺癌及胃管状腺癌生存情况 Figure 1 Survival of 231 cases of gastric adenocarcinoma and gastric tubular adenocarcinoma obtained from TCGA database |
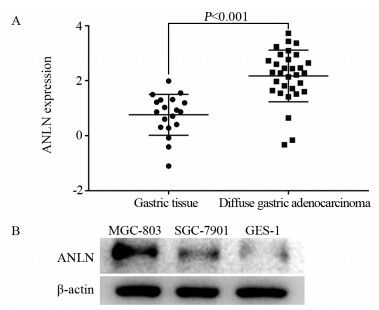
从Oncomine数据库上获取的51例弥漫性胃癌组织(31例)和正常胃组织(20例)中ANLN的表达量数据,结果显示与正常胃组织相比,胃癌组织中ANLN的表达显著高于正常组织,见图 2A。细胞实验也发现,胃癌细胞株中的ANLN表达量显著高于胃黏膜细胞(P < 0.05),见图 2B。
|
| 图 2 Oncomine获取的51例弥漫性胃癌和正常胃组织(A)及GES-1、SGC-7901、MGC-803细胞株(B)中ANLN的表达情况 Figure 2 Expression of ANLN in 51 cases of diffuse gastric cancer and normal gastric tissues obtained by Oncomine(A) and GES-1, SGC-7901, MGC-803 cell lines(B) |
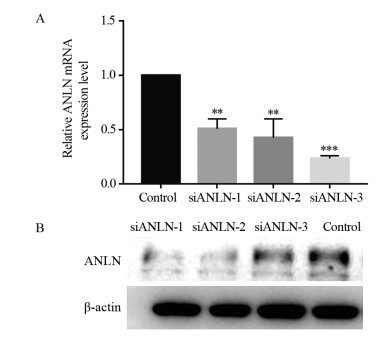
为验证干扰效率,将3条siRNA干扰片段转染到MGC-803细胞后,通过Western blot和qRT-PCR对干扰效率进行验证,结果发现与对照组相比,转染的细胞中蛋白表达量和mRNA均显著降低,见图 3。结果证明3条siRNA可以沉默后续实验中实验组的ANLN基因(均P < 0.01)。
|
| **: P < 0.01, ***: P < 0.001, compared with control group 图 3 qPCR(A)和Western blot(B)分析siANLN-1、siANLN-2和siANLN-3转染效率 Figure 3 Transfection efficiency of siANLN-1, siANLN-2 and siANLN-3 analyzed by qPCR(A) and Western blot(B) |
划痕实验结果显示:对ANLN敲减后,MGC-803细胞迁移能力显著降低(siANLN-1:P=0.0011; siANLN-2: P=0.0060; siANLN-3:P=0.0050),见图 4A。Transwell侵袭实验结果显示:24 h后siANLN-1、siANLN-2和siANLN-3的细胞侵袭细胞数分别为:(68.3±27.5)、(56.6±2.8)、(36.6±2.8)个,对照组侵袭细胞数为(130±30)个(siANLN-1: P=0.0154; siANLN-2: P=0.0060; siANLN-3: P=0.0013),见图 4B。两项实验的实验组与对照组差异均有统计学意义(P < 0.05)。
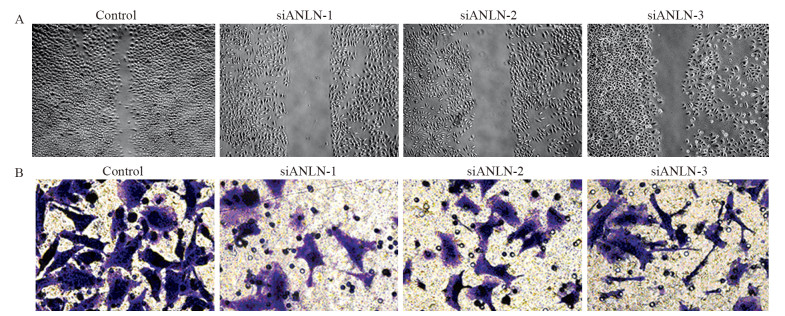
|
| 图 4 倒置显微镜观察转染48h后ANLN基因沉默对细胞迁移的影响(A ×10)及转染24h后ANLN基因沉默对细胞侵袭影响(B ×40) Figure 4 Effect of ANLN gene silencing migration of gastric cancer cells 48h after transfection(A ×10) and cell invasion 24h after transfection(B ×40) observed by inverted microscope |
流式细胞术检测结果显示:G1期细胞显著下降,S期细胞显著升高,实验组与对照组差异有统计学意义(P < 0.0001),见图 5A。染色结果显示:与对照组相比,大多数敲减ANLN基因的细胞出现两个细胞核分不开的情况,见图 5B。凋亡实验结果显示:对照组和干扰组凋亡率分别为16.9%、26.5%、27.6%及18.3%,干扰组凋亡率明显高于对照组,见图 5C。CCK-8法检测结果显示:敲减ANLN对MGC-803细胞的增殖具有抑制作用(均P < 0.0001),见图 5D。
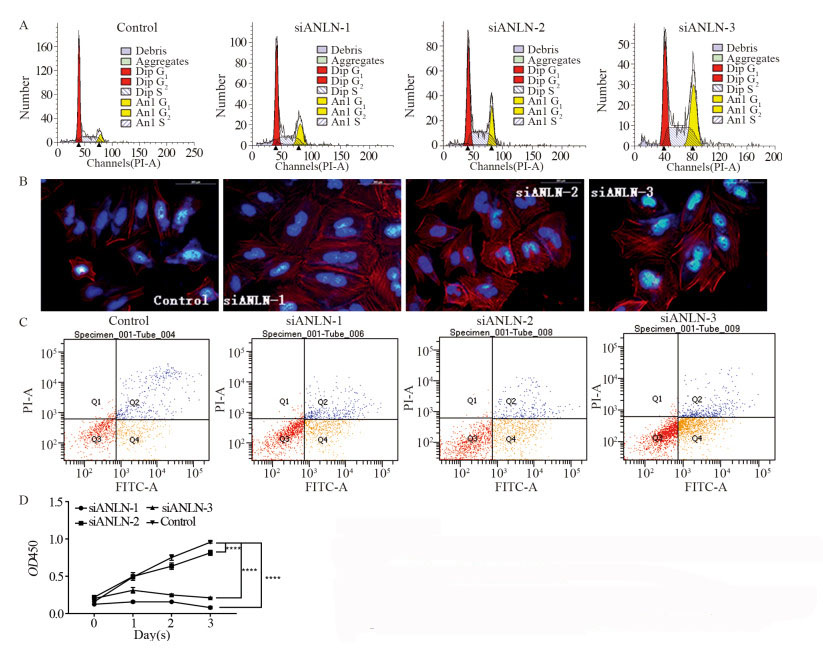
|
| ****: P < 0.0001 图 5 ANLN基因沉默对MGC-803细胞周期(A)、细胞核和肌动蛋白染色情况(B)、凋亡(C)和增殖(D)的影响 Figure 5 Cell cycle(A), staining of nucleus and actin(B), apoptosis(C) and proliferation(D) of MGC-803 cells after ANLN gene silencing |
流式细胞术检测结果显示:下调ANLN基因能够抑制GES-1细胞的凋亡,对照组与干扰组的凋亡率分别为:39.4%、15.8%和21.4%(siANLN-2: P=0.002; siANLN-3: P=0.005),见图 6A。与对照组相比,实验组的敲减效果显著(P < 0.0001),见图 6B。
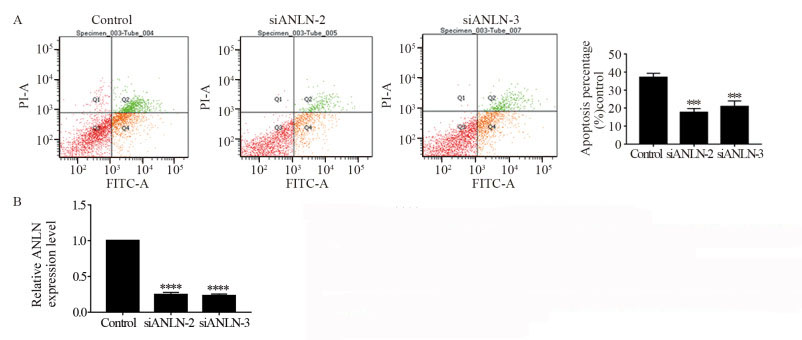
|
| ***: P < 0.001, ****: P < 0.0001, compared with control group 图 6 流式细胞术检测ANLN基因沉默后细胞凋亡情况(A)及qPCR检测siANLN-2与siANLN-3在GES-1细胞中的沉默效率(B) Figure 6 Cell apoptosis after ANLN gene silencing detected by flow cytometry(A) and silencing efficiency of siANLN-2 and siANLN-3 in GES-1 cells detected by qPCR(B) |
胃癌是常见的消化道肿瘤,目前的主要治疗手段为手术切除、放疗和化疗,治疗和预后效果都不理想,所以胃癌的诊断及预后评估面临着严峻的挑战,不管是WHO分型还是Lauren分型系统都不能充分评估患者的预后,因而寻找同预后有关的分子对于胃癌患者的干预有着重要指导意义[14]。
ANLN蛋白是一类肌动蛋白结合蛋白,它能够与GTP-Rho[15]、F-肌动蛋白[16]及隔膜蛋白[17]等结合,影响肿瘤细胞的发生发展。目前已经有研究发现ANLN在肿瘤发生发展中发挥着重要的作用,影响肿瘤细胞的增殖、迁移和侵袭。在膀胱癌中,ANLN表达下调显著降低细胞的增殖、迁移和侵袭能力,还能改变细胞的周期[9]。在肝癌中,ANLN基因能够提高肝细胞多倍体细胞,从而有效防止抑癌基因的丢失[10, 18]。白血病中,ANLN可以与ETV6融合。ETV6基因编码ETS家族的一个转录因子,这个转录因子参与了血液学恶性肿瘤和其他肿瘤中大量的染色体重排。ETV6与ANLN融合后会增强ANLN的功能,使细胞增殖显著增强,很有可能促进了白血病的发展[13, 19]。以上研究说明ANLN作为肿瘤预后标志物具有潜在的应用价值。然而,Pandi等[20]研究报道,通过芯片筛选胃癌相关的Wnt/β-catenin信号通路中的有关蛋白,证明了ANLN的存在。ANLN在胃癌组织中的表达同临床预后间的关系及功能研究未见有关报道。既往关于ANLN在肿瘤细胞中的功能研究主要集中在细胞增殖和细胞周期,随着ANLN在细胞间紧密连接作用的发现,ANLN在调节细胞迁移、侵袭及凋亡等方面的研究值得进一步探索。
本研究获取的数据库数据提示,胃癌组织中ANLN基因的表达显著高于胃正常组织。在胃癌组织中,ANLN高表达会降低患者的生存率,提示ANLN基因可能与胃癌的发生发展相关。ANLN基因的敲减显著降低MGC-803细胞的迁移、侵袭能力,这可能是由于ANLN蛋白的AH域对RhoA是十分必要的,通过调控ANLN的表达能够直接调节细胞内GTP-Rho的表达量,进而直接影响细胞的迁移和侵袭。另外本研究还发现下调ANLN基因不仅会抑制MGC-803细胞的增殖能力,还能进一步促进MGC-803细胞的凋亡。细胞周期实验表明,MGC-803细胞敲减后G1期细胞所占百分比显著下降,而S期细胞所占百分比显著升高。可能是ANLN基因沉默后将细胞阻滞在S期,阻碍细胞周期发展,由于缺少ANLN蛋白与F-肌动蛋白的结合,使S期细胞中肌动蛋白的收缩作用降低,而停留在S期的细胞需要更多的能量来使细胞分裂开,细胞自身能量供给不足抑制了细胞的增殖,最终使细胞走向了凋亡。
综上所述,下调胃癌细胞中肌动蛋白结合蛋白ANLN的表达会显著降低细胞的增殖、凋亡、迁移和侵袭能力。ANLN可能在胃癌发生发展中发挥着重要的作用,有希望成为治疗胃癌的新的靶点。
作者贡献
孙慧:参与部分实验,文章撰写及修改
陈风:实验思路及研究设计,文章修改
刘东洋:数据库数据获取,参与部分实验
史珂、彭晴:参与部分实验
| [1] | Jiao S, Wang H, Shi Z, et al. A peptide mimicking VGLL4 function acts as a YAP antagonist therapy against gastric cancer[J]. Cancer Cell, 2014, 25(2): 166–180. |
| [2] | Xing R, Li W, Cui J, et al. Gastrokine 1 induces senescence through p16/Rb pathway activation in gastric cancer cells[J]. Gut, 2012, 61(1): 43–52. |
| [3] | Zhuo W, Liu Y, Li S, et al. Long Noncoding RNA GMAN, Up-regulated in Gastric Cancer Tissues, Is Associated With Metastasis in Patients and Promotes Translation of Ephrin A1 by Competitively Binding GMAN-AS[J]. Gastroenterology, 2019, 156(3): 676–691. |
| [4] | Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394–424. DOI:10.3322/caac.21492 |
| [5] | Bang YJ, Xu RH, Chin K, et al. Olaparib in combination with paclitaxel in patients with advanced gastric cancer who have progressed following first-line therapy (GOLD): a double-blind, randomised, placebo-controlled, phase 3 trial[J]. Lancet Oncol, 2017, 18(12): 1637–1651. DOI:10.1016/S1470-2045(17)30682-4 |
| [6] | Wang R, Song S, Harada K, et al. Multiplex profiling of peritoneal metastases from gastric adenocarcinoma identified novel targets and molecular subtypes that predict treatment response[J]. Gut, 2019, pii: gutjnl-2018-318070. |
| [7] | Gbadegesin RA, Hall G, Adeyemo A, et al. Mutations in the gene that encodes the F-actin binding protein anillin cause FSGS[J]. J Am Soc Nephrol, 2014, 25(9): 1991–2002. DOI:10.1681/ASN.2013090976 |
| [8] | Field CM, Alberts BM. Anillin, a contractile ring protein that cycles from the nucleus to the cell cortex[J]. J Cell Biol, 1995, 131(1): 165–178. DOI:10.1083/jcb.131.1.165 |
| [9] | Zeng S, Yu X, Ma C, et al. Transcriptome sequencing identifies ANLN as a promising prognostic biomarker in bladder urothelial carcinoma[J]. Sci Rep, 2017, 7(1): 3151. |
| [10] | Zhang S, Zhou K, Luo X, et al. The Polyploid State Plays a Tumor-Suppressive Role in the Liver[J]. Dev Cell, 2018, 44(4): 447–459. |
| [11] | Suzuki C, Daigo Y, Ishikawa N, et al. ANLN plays a critical role in human lung carcinogenesis through the activation of RHOA and by involvement in the phosphoinositide 3-kinase/AKT pathway[J]. Cancer Res, 2005, 65(24): 11314–11325. DOI:10.1158/0008-5472.CAN-05-1507 |
| [12] | Wang G, Shen W, Cui L, et al. Overexpression of Anillin (ANLN) is correlated with colorectal cancer progression and poor prognosis[J]. Cancer Biomark, 2016, 16(3): 459–465. DOI:10.3233/CBM-160585 |
| [13] | Campregher PV, Pereira WO, Lisboa B, et al. Identification of ANLN as ETV6 partner gene in recurrent t(7;12)(p15;p13): a possible role of deregulated ANLN expression in leukemogenesis[J]. Mol Cancer, 2015, 14: 197. DOI:10.1186/s12943-015-0471-5 |
| [14] | Corso S, Giordano S. How Can Gastric Cancer Molecular Profiling Guide Future Therapies?[J]. Trends Mol Med, 2016, 22(7): 534–544. DOI:10.1016/j.molmed.2016.05.004 |
| [15] | Wang J, Zhang L, Qu R, et al. Rho A Regulates Epidermal Growth Factor-Induced Human Osteosarcoma MG63 Cell Migration[J]. Int J Mol Sci, 2018, 19(5): pii: E1437. DOI:10.3390/ijms19051437 |
| [16] | Piekny AJ, Maddox AS. The myriad roles of Anillin during cytokinesis[J]. Semin Cell Dev Biol, 2010, 21(9): 881–891. DOI:10.1016/j.semcdb.2010.08.002 |
| [17] | Marquardt J, ChenX, Bi E. Architecture, remodeling, and functions of the septin cytoskeleton[J]. Cytoskeleton (Hoboken), 2019, 76(1): 7–14. |
| [18] | Gentric G, Desdouets C. Polyploidization in liver tissue[J]. Am J Pathol, 2014, 184(2): 322–331. |
| [19] | Zhou F, Chen B. Acute myeloid leukemia carrying ETV6 mutations: biologic and clinical features[J]. Hematology, 2018, 23(9): 608–612. DOI:10.1080/10245332.2018.1482051 |
| [20] | Pandi SN, Manimuthu M, Harunipriya P, et al. In silico analysis of expression pattern of a Wnt/beta-catenin responsive gene ANLN in gastric cancer[J]. Gene, 2014, 545(1): 23–29. |
 2019, Vol. 46
2019, Vol. 46