文章信息
- 早期胃癌患者ESD术后并发肺炎相关因素分析及风险模型预测
- Related Factors and Risk Model Prediction of Pneumonia After ESD in Patients with Early Gastric Cancer
- 肿瘤防治研究, 2019, 46(10): 916-920
- Cancer Research on Prevention and Treatment, 2019, 46(10): 916-920
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.19.0337
- 收稿日期: 2019-03-18
- 修回日期: 2019-07-29
胃癌发病率在我国消化道肿瘤中居第二位,好发于50岁以上男性[1]。早期胃癌是指癌组织限于胃黏膜层及黏膜下层,不论其范围大小和是否有淋巴结转移[2]。内镜黏膜下剥离术(endoscopic submucosal dissection, ESD)是在内镜下黏膜切除术(EMR)基础上应运而生的新手术方式,尤其适用于早期消化道肿瘤[3-4]。其在内镜黏膜注射条件下,采用特殊高频电刀把病变所在的黏膜进行分离可达到完整切除浸润深度的效果,从而实现根治消化道肿瘤的目的[5]。因为ESD术中切除的黏膜面积较广,且一般手术时间较长,所以出血[6]及穿孔[7]等并发症的发生率也较高。近年来有文献报道胃癌患者ESD术后常常伴随着肺炎的发生[8],在增加患者医疗成本的同时,也严重影响着胃癌患者术后的恢复情况。早期对ESD术后患者进行及时有效的肺炎风险筛查,对于胃癌患者的恢复、预防各种并发症及患者的生命质量有重要意义。本研究选取2016年5月—2019年2月六安市人民医院171例接受治疗的早期胃癌患者,所有患者均接受内镜黏膜下剥离术(ESD),采用Logistic回归分析和列线图模型的建立来对早期胃癌患者ESD术后并发肺炎的风险进行预测。
1 资料与方法 1.1 一般资料选取2016年5月—2019年2月六安市人民医院171例接受治疗的早期胃癌患者,所有患者均接受ESD术。纳入标准:(1)符合《早期胃癌内镜黏膜切除术和黏膜下剥离术治疗指南》[9]中胃癌临床诊断的标准,且病理证实为早期胃癌患者; (2)符合2016年《中国成人社区获得性肺炎诊断和治疗指南》[10]中肺炎临床诊断的标准。排除标准:(1)有精神病史或者无认知功能患者; (2)有重大疾病史或者重要器官功能受损者; (3)有凝血功能障碍性疾病; (4)患者基本资料或者病历信息不全。171例接受治疗的早期胃癌患者中,其中男81例、女90例; 年龄在39~67岁之间,平均年龄为49.82±9.85岁。其中合并肺炎患者32例、未合并肺炎患者139例。
1.2 手术方式ESD为先进行黏膜下注射然后采用特殊电刀慢慢剥离固有肌层和黏膜层间的组织,把病变黏膜及黏膜下层完整剥离的手术方式。具体操作方法:标记病变周围; 在黏膜下注射让病灶抬举; 切开环周的黏膜; 于黏膜下进行剥离,将固有肌层与黏膜间组织完全分开,一次完整切除病灶; 最后进行创面处理。
1.3 观察指标调取所有纳入患者的一般临床资料、临床病理资料、手术相关资料及实验室检查等详细记录,并作回顾性分析。一般临床资料包括性别、年龄、高血压、高血糖、BMI、高血脂、抗菌药物使用、是否入住ICU、是否吞咽障碍及住院时间; 临床病理资料包括病理类型、有无溃疡、手术时间、麻醉时间、肿瘤直径、浸润深度、术中出血量、上腹部手术史、口腔护理、术后发生误吸及留置胃管等。
1.4 统计学方法试验数据采用SPSS20.0统计软件进行分析,计量资料采用(x±s),用t检验,计数资料采用χ2检验,P < 0.05为差异有统计学意义。筛选独立危险因素选用Logistic回归方程,列线图采用R(R3.5.3)软件包,应用rms程序包,建立列线图预测模型。同时应用caret程序包进行Bootstrap法做内部验证,采用rms程序包计算一致性指数(C-index)。采用ROCR及rms程序包作ROC曲线。
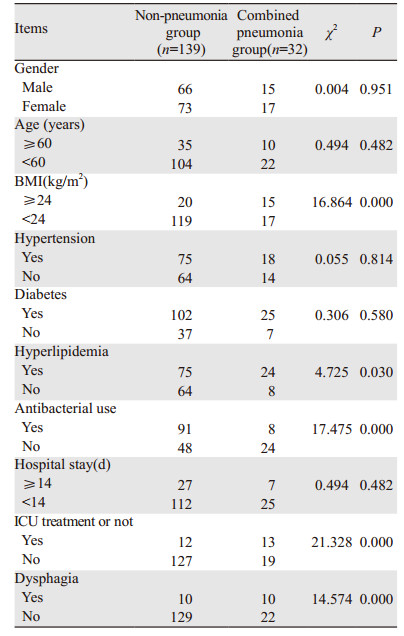
2 结果 2.1 两组一般临床资料对比通过对两组的一般临床资料做单因素分析发现:两组性别、年龄、高血压、高血糖及住院时间差异均无统计学意义(P > 0.05),两组BMI、高血脂、抗菌药物使用、是否入住ICU及是否吞咽障碍差异有统计学意义(P < 0.05),见表 1。
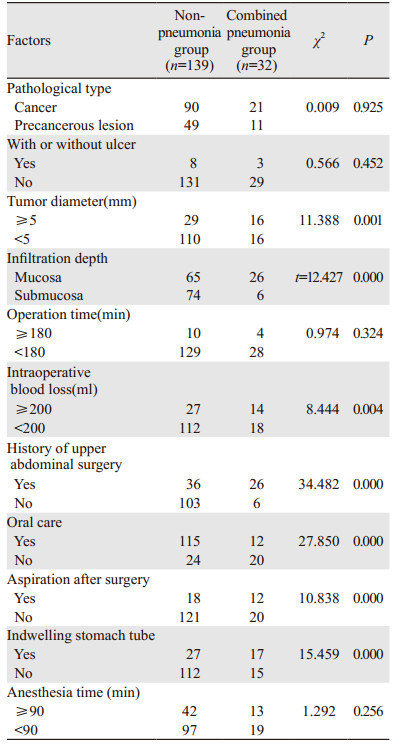
通过对两组临床病理资料及手术资料单因素分析发现:两组病理类型、有无溃疡、手术时间及麻醉时间差异均无统计学意义(P > 0.05),两组肿瘤直径、浸润深度、术中出血量、上腹部手术史、口腔护理、术后发生误吸及留置胃管等差异有统计学意义(P < 0.05),见表 2。
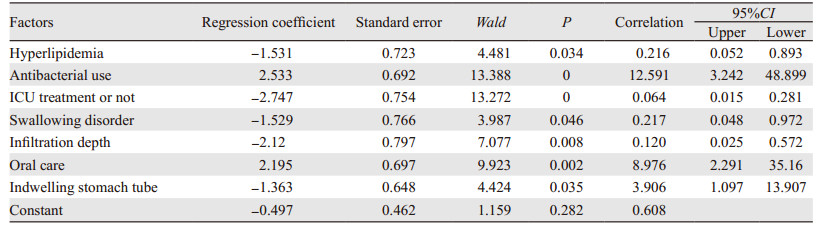
依据未合并肺炎组与合并肺炎组一般临床资料、临床病理资料及手术相关资料对比结果,对BMI、高血脂、抗菌药物使用、是否入住ICU、是否吞咽障碍、肿瘤直径、浸润深度、术中出血量、上腹部手术史、口腔护理、术后发生误吸及留置胃管作Logistic回归分析,结果表明:BMI、肿瘤直径、术中出血量、上腹部手术史及术后发生误吸均P > 0.05,因此予以剔除,筛选出高血脂(OR=0.216, 95%CI: 0.052~1.274)、抗菌药物使用情况(OR=12.591, 95%CI: 3.242~48.899)、是否入住ICU(OR=12.591, 95%CI: 0.015~0.281)、是否吞咽障碍(OR=0.217, 95%CI: 0.048~0.972)、浸润深度(OR=0.12, 95%CI: 0.025~0.572)、口腔护理(OR=8.976, 95%CI: 2.291~35.16)及留置胃管(OR=3.906, 95%CI: 1.097~13.907)为ESD术后并发肺炎的独立危险因素,差异有统计学意义(P < 0.05),均与早期胃癌患者ESD术后并发肺炎高度相关,见表 3。
|
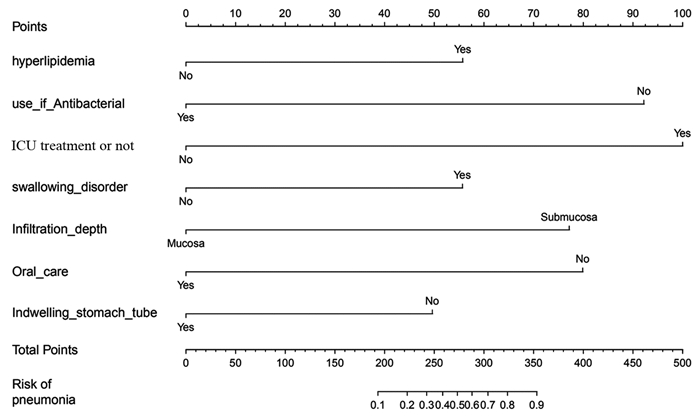
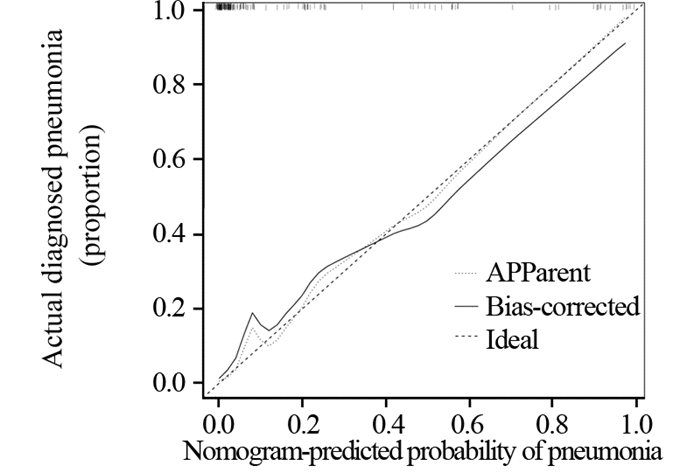
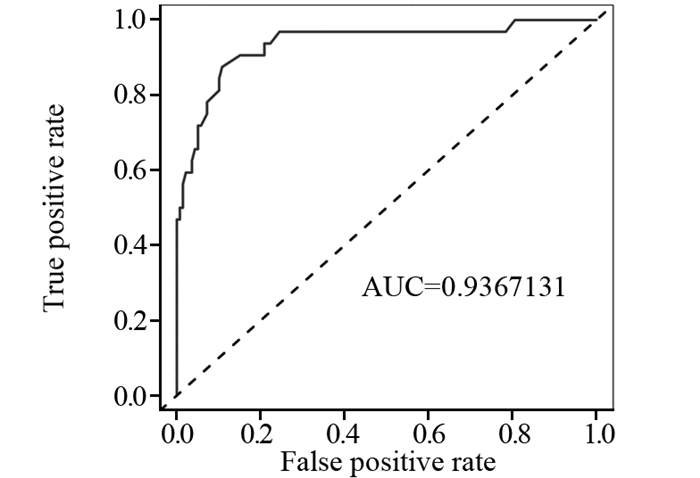
本研究基于高血脂、抗菌药物使用情况、是否入住ICU、是否吞咽障碍、浸润深度、口腔护理及留置胃管7项ESD术后并发肺炎的独立危险因素,建立预测ESD术后并发肺炎风险的列线图模型,见图 1,并对该模型进行验证,见图 2,预测值和观察值基本一致,说明本研究的列线图预测模型具有较好的预测能力,同时本研究使用Bootstrap内部验证法对ESD术后并发肺炎的列线图模型进行验证,C-index指数高达0.937(95%CI: 0.929~0.945),见图 3,说明本研究列线图模型具有良好的精准度和区分度。
|
| 图 1 预测内镜黏膜下剥离术后并发肺炎的列线图风险模型的建立 Figure 1 Establishment of nomogram risk model for predicting pneumonia after endoscopic submucosal dissection(ESD) |
|
| 图 2 列线图模型预测ESD术后并发肺炎风险的验证 Figure 2 Verification of nomogram model predicting the risk of pneumonia after ESD |
|
| 图 3 列线图模型预测ESD术后并发肺炎的ROC曲线 Figure 3 ROC curve of pneumonia after ESD predicted by nomogram risk model |
胃癌的死亡人数占全部肿瘤死亡人数的23.02%,其病死比例居首位[11],主要是由于多数胃癌患者在初诊时就被诊断为晚期,此时已经失去了手术的最佳时机难以根治[12]。据文献报道,进展期胃癌5年生存率在40%以下[13],早期胃癌得到及时有效治疗5年生存率可达90%以上[14]。所以早期胃癌的发现、诊断及手术治疗是提高胃癌防治水平的重心。本研究早期胃癌患者ESD术后并发肺炎的概率高达19.01%,远远高于奉镭等[8]报道的5.21%,因此找到早期胃癌患者并发肺炎的危险因素有非常重大的意义,早期胃癌患者在行手术之后自身抵抗力较差的情况下,如果并发肺部感染极有可能最终发展成重症,其治疗率较低,病死率较高。
Logistic回归分析经常用于探讨诱发疾病的危险因素,并利用危险因素建立预测模型预测疾病发生的概率[15],本研究通过Logistic回归分析可知,高血脂、抗菌药物使用情况、是否入住ICU、是否吞咽障碍、浸润深度、口腔护理及留置胃管为早期胃癌患者ESD术后并发肺炎的独立危险因素,抗菌药物是一类能够抑制且杀灭细菌,有效防治感染性疾病的药物[16]。本研究中早期胃癌患者在ESD术后抗生素预防用药对于ESD术后肺炎的发生情况也起到了一定作用。浸润深度与早期胃癌患者的预后至关重要,其在许多循证报告中已证实与早期胃癌患者并发症的发生有高度相关性[17]。高血脂患者会加快心肾功能的衰退,进而使得患肺炎的概率增加[18],因此多篇研究中将高血脂纳入为肺炎的危险因素,与本研究结果一致。口咽障碍[19]及留置胃管[20]会使得患者发生误吸的概率大大增加,因此作为发生肺炎的独立危险因素。同时入住ICU的患者获得肺炎的概率增加也在报道中得以证实[21],通过本研究结果可知是否入住ICU也被筛选为ESD术后发生肺炎的危险因素。
基于筛选出的7项独立危险因素,建立预测ESD术后并发肺炎风险的列线图模型。通过对该模型进行验证表明:预测值和观察值基本一致,说明本研究的列线图预测模型具有较好的预测能力,ROC曲线作为目前学术界公认的诊断价值较高的方法,其操作简单,利用图形就能评价分析方法的诊断性能[22]。通过ROC曲线得出列线图模型的AUC为0.937,表明该模型具有较高准确性。同时使用Bootstrap内部验证法对ESD术后并发肺炎的列线图模型进行验证,C-index指数高达0.924,说明本研究列线图模型具有良好的精准度和区分度。
综上所述,对ESD术后的早期胃癌患者及时考虑高血脂、抗菌药物使用情况、是否入住ICU、是否吞咽障碍、浸润深度、口腔护理及留置胃管等因素综合评估ESD术后肺炎的发生率,能够提高对早期胃癌患者ESD术后并发肺炎的诊断效能,具有较高的临床应用价值,值得进一步推广使用。
作者贡献
刘晓燕:统计分析及文章撰写
汤海涛:承担病例调取基本信息收集及文章指导
王修中:协助病例基本信息的收集工作
潘宏年:录入及核对数据的准确性、参与统计分析的质量控制
| [1] | 马怀霞, 李宝生, 葛康香, 等. 三氧化二砷通过PI3K/Akt信号通路抑制胃癌细胞的增殖并促进其凋亡的实验研究[J]. 中国地方病防治杂志, 2017, 32(1): 32–33. [ Ma HX, Li BS, Ge KX, et al. Experimental study of arsenic trioxide inhibiting proliferation and promoting apoptosis of gastric cancer cells through PI3K/Akt signaling pathway[J]. Zhongguo Di Fang Bing Fang Zhi Za Zhi, 2017, 32(1): 32–33. ] |
| [2] | Eom BW, Kim YI, Kim KH, et al. Survival benefit of additional surgery after non-curative endoscopic resection in patients with early gastric cancer[J]. Gastrointest Endosc, 2017, 85(1): 155–163. DOI:10.1016/j.gie.2016.07.036 |
| [3] | Probst A, Ebigbo A, Märkl B. Endoscopic submucosal dissection for early rectal neoplasia: experience from a European center[J]. Endoscopy, 2017, 49(3): 222–232. |
| [4] | Ono H, Yao K, Fujishiro M, et al. Guidelines for endoscopic submucosal dissection and endoscopic mucosal resection for early gastric cancer[J]. Dig Endosc, 2016, 28(1): 3–15. DOI:10.1111/den.12518 |
| [5] | Suzuki H, Oda I, Abe S, et al. High rate of 5-year survival among patients with early gastric cancer undergoing curative endoscopic submucosal dissection[J]. Gastric Cancer, 2016, 19(1): 198–205. DOI:10.1007/s10120-015-0469-0 |
| [6] | Libânio D, Costa MN, Pimentel-Nunes P, et al. Risk factors for bleeding after gastric endoscopic submucosal dissection: a systematic review and meta-analysis[J]. Gastrointest Endosc, 2016, 84(4): 572–586. DOI:10.1016/j.gie.2016.06.033 |
| [7] | Imai K, Hotta K, Yamaguchi Y, et al. Preoperative indicators for failure of en bloc resection or perforation in colorectal endoscopic submucosal dissection: implications for lesion stratification by technical difficulties during stepwise training[J]. Gastrointest Endosc, 2016, 83(5): 954–962. DOI:10.1016/j.gie.2015.08.024 |
| [8] | 奉镭, 黄家遂, 李艳霞, 等. 11例内镜下粘膜剥离术后并发肺炎患者情况分析[J]. 中国消毒学杂志, 2017, 34(12): 1187–1188. [ Feng L, Huang JX, Li YX, et al. Analysis of 11 patients with pneumonia after endoscopic mucosal dissection[J]. Zhongguo Xiao Du Xue Za Zhi, 2017, 34(12): 1187–1188. ] |
| [9] | 赵恩昊, 李晓波, 曹晖. 2015年日本消化器内视镜学会《早期胃癌内镜黏膜切除术和黏膜下剥离术治疗指南》解读[J]. 中国实用外科杂志, 2016, 36(1): 79–83. [ Zhao EH, Li XB, Cao H. Interpretation of Japanese Gastroenterological Endosco-py Society Guidelines for ESD and EMR for early gastric cancer (Version 2015)[J]. Zhongguo Shi Yong Wai Ke Za Zhi, 2016, 36(1): 79–83. ] |
| [10] | 中华医学会呼吸病学分会. 中国成人社区获得性肺炎诊断和治疗指南(2016年版)[J]. 中华结核和呼吸杂志, 2016, 39(4): 253–279. [ Chinese Medical Association Respiratory Diseases Branch. Guidelines for the diagnosis and treatment of adult adult community acquired pneumonia (2016 edition)[J]. Zhonghua Jie He He Hu Xi Za Zhi, 2016, 39(4): 253–279. DOI:10.3760/cma.j.issn.1001-0939.2016.04.005 ] |
| [11] | Hajizadeh N, Pourhoseingholi MA, Baghestani AR, et al. Bayesian adjustment of gastric cancer mortality rate in the presence of misclassification[J]. World J Gastrointest Oncol, 2017, 9(4): 160–165. DOI:10.4251/wjgo.v9.i4.160 |
| [12] | 孙慧, 方岳雨, 崔婷允, 等. 奥沙利铂联合替吉奥对晚期胃癌患者的疗效及免疫功能的影响研究[J]. 山西医药杂志, 2016, 45(9): 1048–1050. [ Sun H, Fang YY, Cui TY, et al. Effect of oxaliplatin combined with tigeol on the efficacy and immune function of patients with advanced gastric cancer[J]. Shanxi Yi Yao Za Zhi, 2016, 45(9): 1048–1050. ] |
| [13] | Akhondi-Meybodi M, Ghane M, Akhondi-Meybodi S, et al. Five-year Survival Rate for Gastric Cancer in Yazd Province, Central Iran, from 2001 to 2008[J]. Middle East J Dig Dis, 2017, 9(1): 39–48. |
| [14] | 张楠楠, 邓靖宇. 从术后生活质量看保留迷走神经远端胃癌根治术在早期胃癌治疗中的应用[J]. 中华胃肠外科杂志, 2017, 20(9): 1085–1086. [ Zhang NN, Deng JY. Application of radical vagus nerve surgery for early gastric cancer in the treatment of early gastric cancer from postoperative quality of life[J]. Zhonghua Wei Chang Wai Ke Za Zhi, 2017, 20(9): 1085–1086. DOI:10.3760/cma.j.issn.1671-0274.2017.09.027 ] |
| [15] | Springer DB, Tarassenko L, Clifford GD. Logistic Regression-HSMM-Based Heart Sound Segmentation[J]. IEEE Trans Biomed Eng, 2016, 63(4): 822–832. |
| [16] | Brown ED, Wright GD. Antibacterial drug discovery in the resistance era[J]. Nature, 2016, 529(7586): 336–343. DOI:10.1038/nature17042 |
| [17] | 孙丁, 徐惠绵, 黄锦宇, 等. 淋巴结转移阴性胃癌的预后影响因素分析[J]. 中华胃肠外科杂志, 2017, 20(2): 190–194. [ Sun D, Xu HM, Huang JY, et al. Prognostic factors of lymph node -negative metastasis gastric cancer[J]. Zhonghua Wei Chang Wai Ke Za Zhi, 2017, 20(2): 190–194. ] |
| [18] | 陶涛, 袁静. 血压、血脂、血糖及肾功能不同水平对老年高血压心血管事件的影响[J]. 河北医药, 2017, 39(2): 204–207. [ Tao T, Yuan J. Effects of levels of blood pressure, blood lipid, blood glucose and renal function on cardiovascular events in patients with senile hypertension[J]. Hebei Yi Yao, 2017, 39(2): 204–207. ] |
| [19] | 戴卉, 周辰, 潘晓东, 等. 吞咽功能训练预防老年吞咽障碍病人肠内营养误吸的研究[J]. 实用老年医学, 2018, 32(3): 293–294. [ Dai H, Zhou C, Pan XD, et al. Study on prevention of enteral nutrition aspiration in elderly patients with dysphagia by swallowing function training[J]. Shi Yong Lao Nian Yi Xue, 2018, 32(3): 293–294. ] |
| [20] | 江钦玉, 缪长梅. 全身麻醉下妇科腹腔镜手术术中留置胃管的临床观察[J]. 江苏医药, 2018, 44(3): 312–314. [ Jiang QY, Miao CM. A clinical observation of gastric tube indwelling during gynecological laparoscopic surgery under general anesthesia[J]. Jiangsu Yi Yao, 2018, 44(3): 312–314. ] |
| [21] | 佘秋群, 龙虎成, 田艳. ICU患者预防呼吸机相关性肺炎循证护理的效果研究[J]. 中华医院感染学杂志, 2015, 4: 854–856. [ She QQ, Long HC, Tian Y. The effectiveness of an evidence-based nursing for preventing ventilator-associated pneumonia in ICU[J]. Zhonghua Yi Yuan Gan Ran Xue Za Zhi, 2015, 4: 854–856. ] |
| [22] | Carter JV, Pan J, Rai SN, et al. ROC-ing along: Evaluation and interpretation of receiver operating characteristic curves[J]. Surgery, 2016, 159(6): 1638–1645. DOI:10.1016/j.surg.2015.12.029 |
 2019, Vol. 46
2019, Vol. 46