文章信息
- G6PD对大肠癌细胞生长侵袭的影响及其与HKⅡ的相关性
- Effect of G6PD on Growth and Invasion of Colorectal Cancer Cells and Its Correlation with HKⅡ
- 肿瘤防治研究, 2019, 46(10): 895-900
- Cancer Research on Prevention and Treatment, 2019, 46(10): 895-900
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.19.0327
- 收稿日期: 2019-03-18
- 修回日期: 2019-04-30
近年来,随着人们生活方式及饮食结构的改变,大肠癌在我国乃至世界的发生率显著增加,是发病率与死亡率最高的癌症之一[1]。已有研究证实:肿瘤细胞为满足其快速增殖的需要,消耗大量的葡萄糖,即使在氧气充足的条件下也主要依靠糖酵解供能,这种代谢特征被称为Warburg效应或有氧糖酵解[2-4]。己糖激酶(hexokinase, HK)是糖酵解的第一个关键酶。目前已知哺乳动物体内有四种同工酶(HKⅠ、HKⅡ、HKⅢ和HKⅣ)。有研究表明[5-6],肿瘤细胞中HKⅡ的活性与正常细胞相比明显升高,导致肿瘤细胞在缺少氧气的情况下仍能有足够的能量供应。磷酸戊糖途径(pentose phosphate pathway, PPP)又称磷酸戊糖旁路。葡萄糖-6-磷酸脱氢酶(glucose-6-phosphate dehydrogenase, G6PD)是PPP的关键酶。该途径的代谢产物为NADPH和5-磷酸核糖(ribose-5-phosphate, R-5-P)。对于快速增殖的细胞尤其是肿瘤细胞,充足的NADPH及R5P的供应是维持其生长繁殖所必需的。已有文献证实[7-8]:肿瘤细胞中PPP流量较正常细胞明显提高,其主要机制是肿瘤细胞内G6PD异常激活及表达增加。
因此,G6PD和HKⅡ可能与肿瘤的发生发展有关。本研究旨在探讨G6PD对大肠癌HCT116和SW480细胞生长增殖、侵袭的影响及G6PD与HKⅡ在大肠癌组织中的表达情况及两者的相关性,为探讨大肠癌发生、发展的机制及临床诊断提供实验依据。
1 材料与方法 1.1 材料及主要试剂本实验室保存的HCT116、SW480细胞。大肠癌组织芯片包括89对癌组织和癌旁组织购自上海芯超公司。兔抗人的G6PD和HKⅡ多克隆抗体购自美国CST公司,辣根过氧化物酶偶联的IgG、免疫组织化学二抗试剂盒、DAB染色试剂盒购自北京中杉金桥生物技术有限公司,小干扰RNA购自上海吉玛公司,葡萄糖氧化酶试剂盒购自北京索莱宝科技有限公司。
1.2 细胞分组及转染将HCT116和SW480细胞于37℃、5%CO2培养箱中培养。细胞接种于6孔板或12孔板中,待细胞密度至60%~70%时开始转染,进行过表达和干扰G6PD实验。过表达实验分为Flag空载体转染组和Flag-G6PD转染组,干扰实验分为阴性对照转染组和G6PD-Homo-318、G6PD-Homo-873、G6PD-Homo-1504转染组。6 h后更换为含有10%胎牛血清和双抗的RPMI 1640完全培养液。
1.3 Western blot法检测HCT116、SW480细胞中G6PD和HKⅡ的表达水平转染过程同上。G6PD过表达组于换液后48 h时收集细胞,siRNA干扰组于换液后36 h时收集细胞。将收集的细胞加入蛋白裂解液和蛋白酶抑制剂提取总蛋白。采用BCA蛋白浓度测定试剂盒检测蛋白浓度,各组调成相同浓度后变性完成样品制备。将蛋白经过SDS-PAGE电泳分离,90 V 90 min转至PVDF膜,用含5%的脱脂奶粉的TBST室温封闭2 h,膜与G6PD、HKⅡ和actin抗体结合,4℃孵育过夜。经TBST洗涤后,用二抗室温孵育2 h,TBST洗涤后ECL发光法成像。
1.4 培养液中葡萄糖浓度的测定G6PD过表达实验转染42 h,siRNA干扰实验转染30 h后更换完全培养液,换液后6 h收集培养液,按照葡萄糖氧化酶试剂盒说明书检测培养液中葡萄糖的浓度。
1.5 细胞划痕实验转染24 h后开始划痕,PBS轻轻冲洗2次再更换培养液,分别在划痕后0、48 h时显微镜下照相,观察细胞的迁移能力。
1.6 流式细胞术检测细胞周期转染过程同上。G6PD过表达组于48 h时收集细胞,siRNA干扰实验组于36 h时收集细胞,加入预冷的75%乙醇4℃固定过夜,次日将固定好的细胞以1 000 r/min的转速离心5 min,弃上清液,加入1 ml PBS清洗两次,离心后加入碘化丙锭(PI)染液,37℃避光染色30 min,流式细胞术检测细胞周期进程。
1.7 免疫组织化学实验将大肠癌组织芯片置于65℃烘箱中烘蜡2 h至融化。取出玻片,以二甲苯两缸,每缸15 min; 无水乙醇两缸,每缸7 min; 90%酒精1缸,5 min; 80%酒精1缸,5 min; 70%酒精1缸,5 min的梯度进行脱蜡。玻片用纯水冲洗。柠檬酸盐缓冲液进行抗原修复。室温下滴加3%H2O2进行阻断。PBS冲洗后滴加G6PD、HKⅡ抗体4℃孵育过夜。孵育后的玻片室温放置30 min后,PBS冲洗加入辣根过氧化物酶标记的相应二抗,37℃孵育30 min。PBS冲洗后滴加稀释后的DAB显色液显色5 min,自来水冲洗5 min。滴加哈氏苏木精对比染色细胞核后,以75%酒精1缸,5 min; 85%酒精1缸,5 min; 95%酒精1缸,5 min; 无水乙醇两缸,每缸7 min; 二甲苯两缸,每缸15 min的梯度进行脱水。取出封片,荧光显微镜下观察免疫组织化学结果。
每张切片各选5个视野,根据染色程度和染色阳性率取均数进行评分[9]。染色越深即切片阳性染色颗粒越多,反映染色阳性的G6PD和HKⅡ蛋白表达水平越高。反之则越低。按染色强度将无色、淡黄色、棕色、棕褐色分别记为0、1、2、3分。按染色阳性率将阳性细胞 < 5%、5%~25%、> 25%~50%、> 50%~75%、> 75%分别记为0、1、2、3、4分。以其评分之积为最终计算结果进行赋分。总分0分为阴性(-),1~4分为弱阳性(+),5~8分为阳性(++),9~12分为强阳性(+++)。
1.8 统计学方法所有数据均采用SPSS17.0统计软件进行分析,细胞实验的蛋白表达水平、葡萄糖浓度、细胞周期及侵袭能力数据以(x±s)表示,两组间比较采用独立样本t检验, G6PD和HKⅡ在大肠癌与癌旁组织中的表达水平及其两者间的相关性分析均采用Mann-Whitney U-test检验方法,P < 0.05为差异有统计学意义。
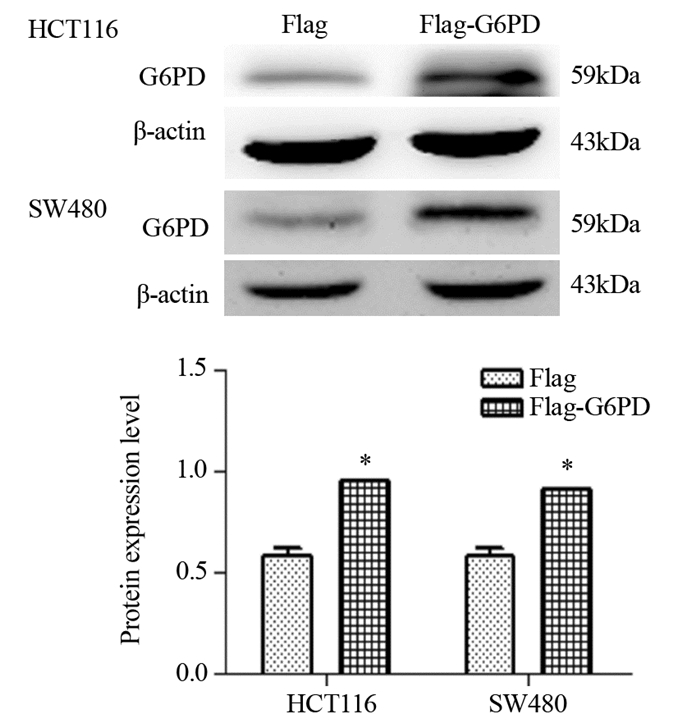
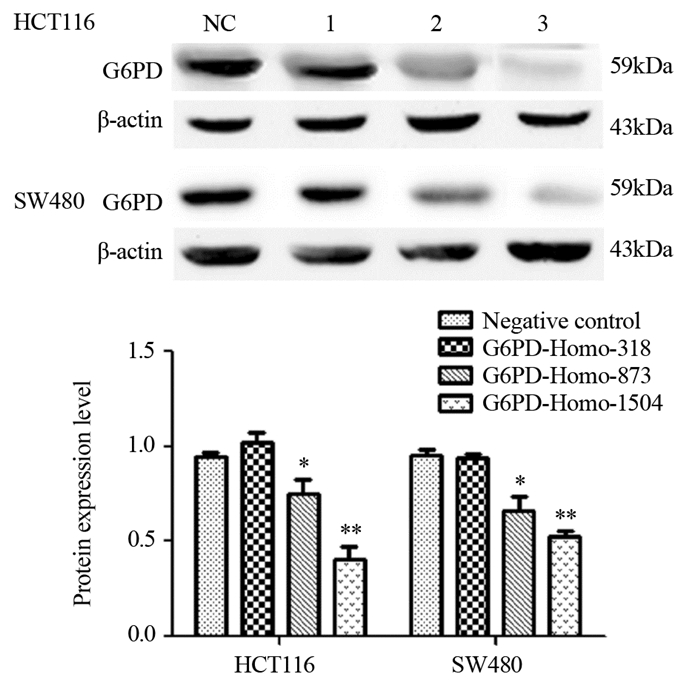
2 结果 2.1 Western blot法检测HCT116和SW480细胞中G6PD过表达和干扰效果在G6PD过表达实验中,与Flag转染组相比,HCT116和SW480两种细胞Flag-G6PD转染组G6PD蛋白表达水平显著升高,见图 1。提示过表达实验Flag和Flag-G6PD质粒转染成功。在siRNA干扰实验中,与阴性对照转染组相比,HCT116和SW480两种细胞G6PD-Homo-318转染组无明显变化,G6PD-Homo-873和G6PD-Homo-1504转染组G6PD蛋白表达显著下调,而G6PD-Homo-1504转染组下调更明显,见图 2。之后的细胞实验我们将利用筛选出的G6PD-Homo-1504对细胞进行干扰。
|
| *: P < 0.05, compared with Flag transfection group 图 1 过表达G6PD后HCT116、SW480细胞中G6PD的表达水平 Figure 1 Expression levels of G6PD in HCT116 and SW480 cells after overexpression of G6PD |
|
| NC: Negative control; 1: G6PD-Homo-318 transfection group; 2: G6PD-Homo-873 transfection group; 3: G6PD-Homo-1504 transfection group. *: P < 0.05, **: P < 0.01, compared with Negative control transfection group 图 2 干扰G6PD后HCT116、SW480细胞G6PD的表达水平 Figure 2 Expression levels of G6PD in HCT116 and SW480 cells after interference with siRNA |
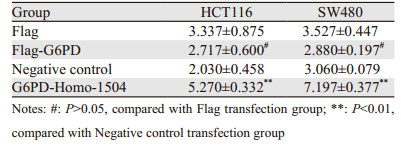
在G6PD过表达实验中,与Flag转染组相比,Flag-G6PD转染组两种细胞培养液中葡萄糖浓度有所减少,但差异无统计学意义(P > 0.05)。siRNA干扰实验中,与阴性对照转染组相比,G6PD-Homo-1504转染组两种细胞培养液中葡萄糖浓度显著升高(PHCT116=0.003, PSW480=0.002),见表 1。
|
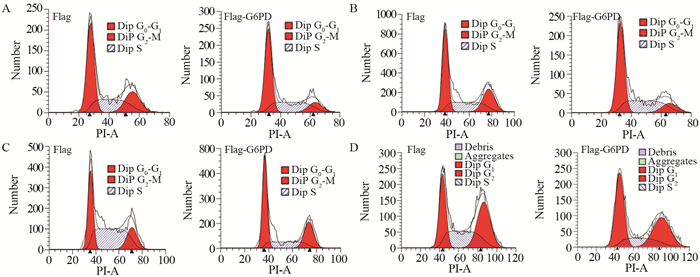
G6PD过表达实验中,与Flag转染组相比,Flag-G6PD转染组两种细胞S期所占比例有所增多,但差异无统计学意义(P > 0.05)。siRNA干扰实验中,与阴性对照转染组相比G6PD-Homo-1504转染组两种细胞S期所占比例明显减少,其差异具有统计学意义(PHCT116=0.02, PSW480=0.03),见图 3。
|
| A: HCT116 cells were transfected with Flag and Flag-G6PD; B: SW480 cells were transfected with Flag and Flag-G6PD; C: HCT116 cells were transfected with siRNA; D: SW480 cells were transfected with siRNA 图 3 流式细胞仪检测各组细胞周期的结果 Figure 3 Cell cycle of each group detected by flow cytometry |
G6PD过表达实验中,Flag转染组与Flag-G6PD转染组两种细胞间划痕部分面积的缩小速率差异无明显变化(P > 0.05)。siRNA干扰实验中,与阴性对照转染组相比G6PD-Homo-1504转染组两种细胞划痕部分面积的缩小速率明显降低,说明细胞侵袭能力显著降低,差异有统计学意义(PHCT116=0.006, PSW480=0.002),见图 4。

|
| 图 4 过表达和干扰G6PD后两种细胞侵袭能力(×40) Figure 4 Invasion abilities of HCT116 and SW480 cells after G6PD overexpression and interference (×40) |
Western blot检测结果表明,与Flag转染组相比,Flag-G6PD转染组HKⅡ蛋白水平显著升高,见图 5A~B; siRNA干扰实验与阴性对照转染组相比,G6PD-Homo-1504转染组HKⅡ蛋白水平明显下调,见图 5C~D。结果显示G6PD与HKⅡ可能存在调控作用。免疫组织化学法检测89对大肠癌组织芯片发现,与癌旁组织相比,G6PD与HKⅡ在大肠癌组织中表达水平显著升高,差异有统计学意义(PG6PD=0.036, PHKⅡ=0.046),见图 5E。通过Mann-Whitney U test检验分析,G6PD和HKⅡ在大肠癌组织中的表达水平存在正相关(P=1.57×10-4),见图 5F。
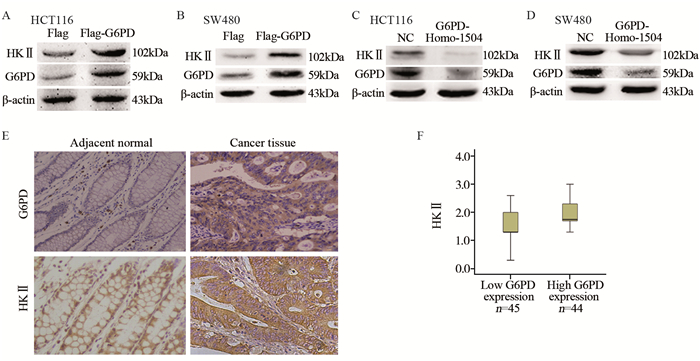
|
| *: P < 0.05 compare with Flag and Negative control transfection group 图 5 G6PD和HKⅡ的表达(A~E)及在大肠癌样本中的相关性(F) (×100) Figure 5 Expression of G6PD and HKⅡ(A~E) and their correlation in colorectal cancer samples(F) (×100) |
葡萄糖代谢的改变是肿瘤细胞为协调葡萄糖的消耗和细胞生理机能所产生的一个显著的代谢特征。迅速增殖的肿瘤细胞糖酵解流量通常是正常细胞的200倍[10]。糖酵解水平的提高使肿瘤细胞对葡萄糖的消耗增多,指导更多的葡萄糖进入与体内生物大分子合成密切相关的磷酸戊糖途径。G6PD和HK分别是磷酸戊糖途径和糖酵解途径的关键酶。HKⅠ和HKⅡ在多种肿瘤中高表达,并且HKⅡ与肿瘤发生发展的关系最为密切[11]。以HKⅡ作为治疗靶点可以减少体内肿瘤生长,包括宫颈癌和肺癌及其他肿瘤中也发现了类似的结果[12-13]。G6PD对细胞生长具有重要调节作用[14]。有研究表明,G6PD是一个癌基因,在多种恶性肿瘤中表达上调[15-16]。
本实验通过对大肠癌HCT116和SW480细胞进行过表达和干扰G6PD处理。Western blot结果证实过表达和干扰效果都很显著。过表达实验中,与Flag对照组相比,Flag-G6PD转染组培养液中葡萄糖浓度有所降低,S期细胞数量有所增多,但差异无统计学意义(P > 0.05)。而干扰实验中,与阴性对照转染组相比,G6PD-Homo-1504转染组培养液中葡萄糖浓度明显升高(P < 0.01),消耗的葡萄糖明显降低,S期细胞数量显著减少(P < 0.05)。结果提示干扰G6PD减少了葡萄糖的消耗,从而抑制了细胞的增殖。已有研究表明,G6PD与皮肤鳞癌A431细胞增殖及细胞周期密切相关[17]。本研究划痕实验结果显示,过表达G6PD组与对照组间无明显变化(P > 0.05); 而G6PD干扰组细胞与阴性对照组相比,侵袭能力显著降低(P < 0.01),结果提示我们G6PD可以促进细胞的侵袭。已有研究表明,通过敲低G6PD造成肾透明细胞癌细胞ccRCC的迁移能力显著降低[18]。这与我们的结果相一致。
过表达G6PD后葡萄糖的摄取、细胞周期及侵袭情况变化不显著。分析其可能原因是肿瘤细胞中G6PD的表达水平已经足够维持细胞需要,虽然细胞中G6PD总量以及其活性增加,但对细胞功能没有显著的影响,这与之前的研究一致[19]。而干扰G6PD后,降低了G6PD的活性,从而减少了细胞对葡萄糖的消耗,使糖酵解能力降低进而抑制了肿瘤细胞的生长增殖和侵袭能力。
同时本研究发现,过表达G6PD后HKⅡ的表达水平显著上调,siRNA干扰G6PD的表达后HKⅡ的表达显著下调。提示G6PD与HKⅡ的表达可能存在调控作用。因此本研究进一步分析了G6PD和HKⅡ在大肠癌组织中的表达情况。免疫组织化学结果显示,与癌旁组织相比,大肠癌组织样本中G6PD与HKⅡ蛋白表达水平均有明显升高(P < 0.05)。本研究也证实:89例大肠癌临床样本中有59例G6PD的表达水平显著升高,有61例HKⅡ的表达水平显著升高。重要的是,本研究证实了G6PD和HKⅡ在大肠癌组织中表达水平呈正相关。与Western blot结果一致。
综上所述,干扰G6PD减少了大肠癌细胞葡萄糖的消耗,抑制了大肠癌细胞的增殖能力和侵袭能力; 同时干扰G6PD减少了HKⅡ的表达,并且与癌旁组织相比,两者的表达水平均显著升高且呈正相关。因此抑制G6PD和HKⅡ的活性可能为临床大肠癌患者提供一个可能的治疗策略。关于两者之间的具体作用机制我们正在进一步研究之中。
作者贡献
郑可心:进行实验操作、结果的获得及数据处理,撰写论文
张秀梅:提供论文思路、实验经费及条件,指导实验,修 改论文
| [1] | Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394–424. DOI:10.3322/caac.21492 |
| [2] | Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation[J]. Cell, 2011, 144(5): 646–674. DOI:10.1016/j.cell.2011.02.013 |
| [3] | Chen XZ, Qian YR, Wu SY. The Warburg effect: Evolving interpretations of an established concept[J]. Free Radic Bio Med, 2015, 79: 253–263. DOI:10.1016/j.freeradbiomed.2014.08.027 |
| [4] | 石汉平. 重视肿瘤生酮治疗的研究[J]. 肿瘤防治研究, 2018, 45(4): 193–198. [ Shi HP. Putting more efferts on cancer ketogenic therapy research[J]. Zhong Liu Fang Zhi Yan Jiu, 2018, 45(4): 193–198. DOI:10.3971/j.issn.1000-8578.2018.18.0233 ] |
| [5] | Jiang S, Zhang LF, Zhang HW, et al. A novel miR-155/miR-143 cascade controls glycolysis by regulating hexokinase 2 in breast cancer cells[J]. EMBO J, 2012, 31(8): 1985–1998. DOI:10.1038/emboj.2012.45 |
| [6] | Patra KC, Hay N. Hexokinase 2 as oncotarget[J]. Oncotarget, 2013, 4(11): 1862–1863. |
| [7] | Zhang C, Zhang Z, Zhu Y, et al. Glucose-6-phosphate dehydrogenase: a biomarker and potential therapeutic target for cancer[J]. Anticancer Agents Med Chem, 2014, 14(2): 280–289. DOI:10.2174/18715206113136660337 |
| [8] | Vizan P, carraz-Vizan G, az-Moralli S, et al. Modulation of pentose phosphate pathway during cell cycle progression in human colon adenocarcinoma cell line HT29[J]. Int J Cancer, 2009, 124(12): 2789–2796. DOI:10.1002/ijc.24262 |
| [9] | Wolf A, Aqnihotri S, Micallef J, et al. Hexokinase 2 is a key mediator of aerobic glycolysis and promotes tumor growth in human glioblastoma multiforme[J]. J Exp Med, 2011, 208(2): 313–326. DOI:10.1084/jem.20101470 |
| [10] | 蒋素珍, 方艺川, 卢丽娜, 等. 6-磷酸葡萄糖脱氢酶在子宫内膜癌中的表达[J]. 广东医学, 2016, 37(22): 3400–3403. [ Jiang SZ, Fang YC, Lu LN, et al. Expression of 6-phosphate glucose dehydrogenase in endometrial carcinoma[J]. Guangdong Yi Xue, 2016, 37(22): 3400–3403. DOI:10.3969/j.issn.1001-9448.2016.22.027 ] |
| [11] | Mathupala SP, Ko YH, Pedersen PL. HexokinaseⅡ: cancer's double-edged sword acting as both facilitator and gatekeeper of malignancy when bound to mitochondria[J]. Oncogene, 2006, 25(34): 4777–4786. DOI:10.1038/sj.onc.1209603 |
| [12] | Vartanian A, Agnihotri S, Wilson MR, et al. Targeting hexokinase 2 enhances response to radio-chemotherapy in glioblastoma[J]. Oncotarget, 2016, 7(43): 69518–69535. |
| [13] | Liu Y, Murray-Stewart T, Casero RA Jr, et al. Targeting hexokinase 2 inhibition promotes radiosensitization in HPV16 E7-induced cervical cancer and suppresses tumor growth[J]. Int J Oncol, 2017, 50(6): 2011–2023. DOI:10.3892/ijo.2017.3979 |
| [14] | Tian WN, Braunstein LD, Pang J, et al. Importance of glucose-6-phosphate dehydrogenase activity for cell growth[J]. J Biol Chem, 1998, 273(17): 10609–10617. DOI:10.1074/jbc.273.17.10609 |
| [15] | Wang X, Li X, Zhang X, et al. Glucose-6-phosphate dehydrogenase expression is correlated with poor clinical prognosis in esophageal squamous cell carcinoma[J]. Eur J of Surg Oncol, 2015, 41(10): 1293–1299. DOI:10.1016/j.ejso.2015.08.155 |
| [16] | Massari F, Ciccarese C, Santoni M, et al. Metabolic phenotype of bladder cancer[J]. Cancer Treat Rev, 2016, 45: 46–57. DOI:10.1016/j.ctrv.2016.03.005 |
| [17] | 李敏, 夏永华, 刘冬, 等. 葡萄糖-6-磷酸脱氢酶的表达抑制对A432细胞增殖和细胞周期的影响[J]. 中华皮肤科杂志, 2016, 49(11): 766–770. [ Li M, Xia YH, Liu D, et al. Effects of inhibition of glucose-6-phosphate dehydrogenase expression on proliferation and cell cycle distribution of A431 cells[J]. Zhonghua Pi Fu Ke Za Zhi, 2016, 49(11): 766–770. DOI:10.3760/cma.j.issn.0412-4030.2016.11.02 ] |
| [18] | 白宏刚, 张巧, 况应敏, 等. 葡萄糖-6-磷酸脱氢酶稳定敲低对肾透明细胞癌细胞迁移的抑制作用[J]. 医学研究生学报, 2018, 31(7): 697–702. [ Bai HG, Zhang Q, Kuang YM, et al. Stable G6PD knockdown inhibits the migration of renal cell carcinoma cells[J]. Yi Xue Yan Jiu Sheng Xue Bao, 2018, 31(7): 697–702. ] |
| [19] | 冯笑, 刘兆宇, 胡腊, 等. 敲低及过表达G6PD对肝癌细胞增殖和迁移的影响[J]. 实用医学杂志, 2018, 34(5): 698–701, 706. [ Feng X, Liu ZY, Hu L, et al. Effect of knockdown or overexpression of G6PD on the proliferation and migration of hepatoma cells[J]. Shi Yong Yi Xue Za Zhi, 2018, 34(5): 698–701, 706. DOI:10.3969/j.issn.1006-5725.2018.05.003 ] |
 2019, Vol. 46
2019, Vol. 46


