文章信息
- 姜黄素逆转电离辐射诱导的非小细胞肺癌A549细胞上皮间质转化
- Curcumin Reverses Ionizing Radiation-induced Epithelial Mesenchymal Transformation of Non-small Cell Lung Cancer A549 Cells
- 肿瘤防治研究, 2019, 46(10): 873-878
- Cancer Research on Prevention and Treatment, 2019, 46(10): 873-878
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.19.0305
- 收稿日期: 2019-03-14
- 修回日期: 2019-05-06
2. 442000 十堰,湖北医药学院生物工程学院生物科学教研室;
3. 442000 十堰,十堰市太和医院(湖北医药学院附属医院)肿瘤防治中心
2. Department of Biological Sciences, School of Biological Engineering, Hubei University of Medicine, Shiyan 442000, China;
3. Cancer Prevention and Treatment Center, Taihe Hospital, Hubei University of Medicine, Shiyan 442000, China
放疗是非小细胞肺癌(non-small cell lung cancer, NSCLC)常见治疗方法,资料显示,约60%的患者在治疗不同阶段会接受放疗[1-2]。然而,电离辐射可引起肿瘤细胞发生上皮间质转化(epithelial-mesenchymal transitions, EMT)[3-4],进而促进肿瘤转移。
姜黄素(Curcumin)是从姜黄、菖蒲、莪术、郁金等姜科或者天南星科的部分植物根茎中提取的一种纯天然的淡黄色酚类色素[5]。大量研究发现,姜黄素可抑制胰腺癌、膀胱癌及肾癌等细胞EMT的发生[6-8]。但姜黄素是否能够逆转放疗诱导的NSCLC发生EMT,目前国内外尚无相关报道。
本研究拟通过体外细胞实验探讨姜黄素对电离辐射诱导的NSCLC细胞上皮间质转化的影响,为抑制或减轻临床上放疗诱导的NSCLC肿瘤细胞转移提供新思路。
1 材料与方法 1.1 主要试剂DMEM培养基、胎牛血清购自美国Gibco公司;姜黄素(货号08511)购自美国Sigma公司;抗pan-Keratin(货号4545)、E-cadherin(货号14472)、N-cadherin(货号13116)、Vimentin(货号5741)抗体购自美国Cell Signaling公司;GAPDH一抗(货号ANT011)及HRP标记二抗(货号ANT019)购自武汉安特捷生物技术有限公司;蛋白裂解液、PMSF、BCA蛋白定量试剂盒购自南通碧云天生物技术研究所。
1.2 细胞株人非小细胞肺癌A549细胞购自中国科学院典型培养物保藏委员会细胞库。
1.3 仪器及设备Transwell小室(Corning公司,美国);Fresco21型冷冻高速离心机(Thermo Fisher Scientific公司,美国);CKX41型倒置显微镜(Olympus公司,日本);MP-4型电泳仪及转印槽(Bio-Rad公司,美国);odyssey-SA型双色红外激光成像系统(上海仪涛生物仪器有限公司);ELX800型全自动酶标仪(Biotek公司,美国);Elekta Synergy直线加速器(Elekta公司,瑞典)。
1.4 细胞培养将细胞置于含10%胎牛血清的DMEM培养液中,在37℃、5%CO2的条件下常规培养。
1.5 电离辐射诱导EMT用2、4、6、8、10 Gy的X射线照射A549细胞,诱导其发生上皮间质转化,命名为A549R。每照射一次,待细胞恢复活力,能正常传代后进行下一次照射,铺板密度为50%。
1.6 CCK8法检测姜黄素对A549R细胞增殖的影响选取处于对数生长期的A549R细胞,分别以5×103个/孔接种于96孔板,培养24 h,第二天将陈旧培养基吸除,分别加入含姜黄素终浓度为0、1、5、10、20、40、60、100、200 μmol/L的DMEM完全培养基,处理48 h后,吸弃旧培养基,向每孔中加入含10 μl CCK-8试剂的新鲜培养基,孵育2 h,用Thermo Varioskan Flash多功能读数仪检测波长为450 nm处细胞的OD值。实际OD值=测量OD值-背景OD值。SPSS18.0软件计算姜黄素的IC50。
1.7 Western blot检测蛋白的表达收集细胞(约5×106个),按照试剂盒说明书提取蛋白,采用BCA法进行蛋白定量。取20 μg总蛋白用10% SDS-PAGE胶电泳,转膜后置于5%脱脂奶粉中室温封闭2 h。一抗4℃孵育过夜,二抗室温孵育2 h,采用ECL化学发光试剂盒显影。以ImagePro Plus 7.0图像分析软件计算灰度值,将目的蛋白与内参蛋白两者灰度值的比值作为目的蛋白的表达量。
1.8 划痕实验检测细胞迁移能力将A549R细胞接种于6孔板中,每孔接种7×105个细胞,待细胞贴壁生长至融合时(约24 h),用10 μl的枪头在细胞层上划出一道划痕,PBS清洗3次,加入含0.1%胎牛血清的DMEM培养液,于显微镜下捕捉0 h划痕图片,每组捕捉10张,待培养48 h后,使用显微镜在上次捕捉位置再进行拍照。National Instrument Vision Assistant 8.6软件计算划痕伤口愈合面积,愈合面积= 0 h划痕面积-48 h划痕面积。
1.9 Transwell实验检测细胞迁移能力将细胞浓度调整至3×105/ml,每个Transwell小室的上室加入细胞悬液100 μl,下室加入含10%胎牛血清的DMEM培养液,培养细胞12 h后,用棉签擦去膜上层细胞,使用PBS淋洗后在室温下用甲醇固定膜下层细胞15 min。PBS清洗3次后结晶紫染色,显微镜照相,捕捉图片,计数细胞。
1.10 统计学方法数据分析采用完全随机方差分析或t检验,经SPSS16.0软件计算相应P值。所有实验至少重复三次,P < 0.05为差异有统计学意义。
2 结果 2.1 A549细胞经电离辐射后细胞形态转变为间质形态A549细胞经梯度分割电离辐射后,细胞形态由椭圆形上皮细胞转变为纺锤形间质细胞形态,见图 1。上述结果表明,已经成功构建了非小细胞肺癌细胞A549的上皮间质转化模型A549R。
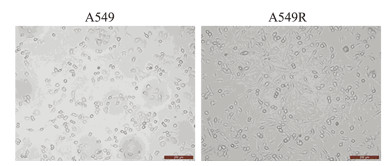
|
| A549R: A549 cells after irradiation 图 1 A549细胞经分割电离辐射后的形态变化(×200, 比例尺: 100 µm) Figure 1 Morphological changes of A549 cells after fractionated ionizing radiation (×200, Bar: 100 µm) |
为进一步明确经过分割电离辐射处理的A549细胞是否发生了EMT,用Western blot法检测了A549和A549R上皮及间质标志物的表达差异,结果显示:上皮标志物角蛋白(pan-Keratin)表达显著下调(F=0.743, P=0.034);E钙黏蛋白(E-cadherin)(F=0.987, P=0.002)、间质标志物N钙黏蛋白(N-cadherin)(F=0.400, P=0.010)、波形蛋白(Vimentin)表达显著上调(F=0.710, P=0.024);Twist表达轻微上调,见图 2。
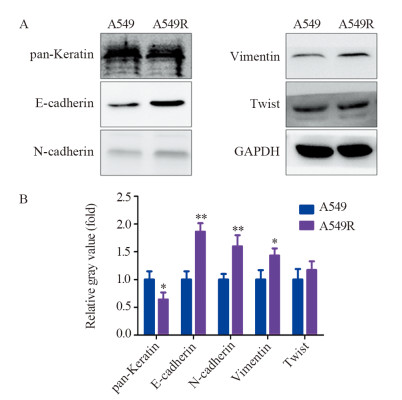
|
| *: P < 0.05, **: P < 0.01, compared with A549 cells 图 2 Western blot检测A549和A549R上皮/间质标志物表达水平的变化 Figure 2 Expression levels of epithelial and mesenchymal markers in A549 and A549R cells detected by Western blot |
用0、1、5、10、20、40、60、100、200 μmol/L的姜黄素处理A549R细胞48 h,CCK8检测细胞增殖的情况,结果显示,40 μmol/L的姜黄素可显著抑制A549R细胞的增殖,见图 3,计算其IC50为34.54 μmol/L。
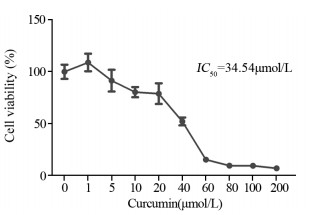
|
| 图 3 姜黄素对A549R细胞抑制的IC50测定 Figure 3 IC50 of curcumin on A549R cells |
为了检测姜黄素对A549R细胞形态的影响,用0、1、2、5、10、20 μmol/L姜黄素处理A549R细胞48 h,A549R细胞形态由纺锤形间质形态转变为椭圆形上皮形态,见图 4。其中,姜黄素浓度为20 µmol/L时最为显著。
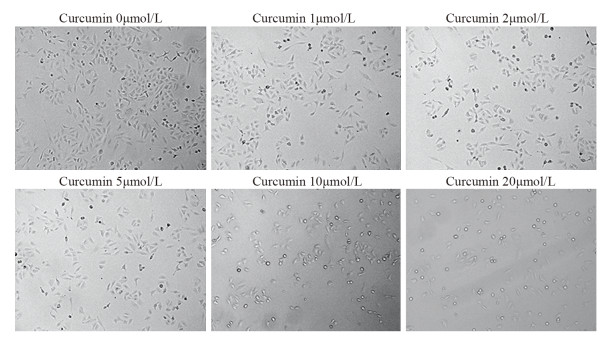
|
| 图 4 光学显微镜观测姜黄素对A549R细胞形态的影响(×200) Figure 4 Effect of curcumin on morphology of A549R cells observed by optical microscope (×200) |
经过20 μmol/L姜黄素处理,上皮标志物E-cadherin(F=0.658, P=0.028)、间质标志物Vimentin(F=0.550, P=0.016)、Twist表达显著下调(F=0.751, P=0.010),差异均有统计学意义;pan-Keratin表达上调(F=0.225, P=0.048),差异有统计学意义;N-cadherin表达水平无明显变化(F=0.558, P=0.865),差异无统计学意义。上述结果表明姜黄素可能逆转了A549R细胞EMT,见图 5。
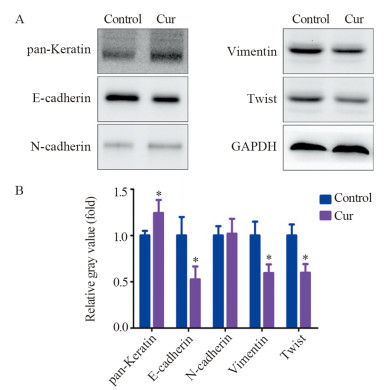
|
| Cur: curcumin; *: P < 0.05, compared with Control group 图 5 Western blot检测姜黄素对A549R细胞上皮/间质标志物表达的逆转作用 Figure 5 Reversal effects of curcumin on expression of epithelial and mesenchymal markers in A549R cells detected by Western blot |
细胞发生EMT的一个重要结果就是促进细胞迁移和转移。为了验证姜黄素是否能够影响A549R细胞的迁移能力,进行了划痕愈合实验。结果显示:1 µmol/L姜黄素并未显著影响划痕愈合,差异无统计学意义(F=0.944, P=0.909);2 µmol/L(F=0.972, P=0.018)、5 µmol/L(F=0.678, P=0.003)、10 µmol/L(F=0.995, P=0.000)、20 µmol/L(F=0.401, P=0.000)的姜黄素处理后,愈合面积随姜黄素浓度的升高而显著降低,见图 6。这表明姜黄素可显著抑制A549R细胞的迁移能力。
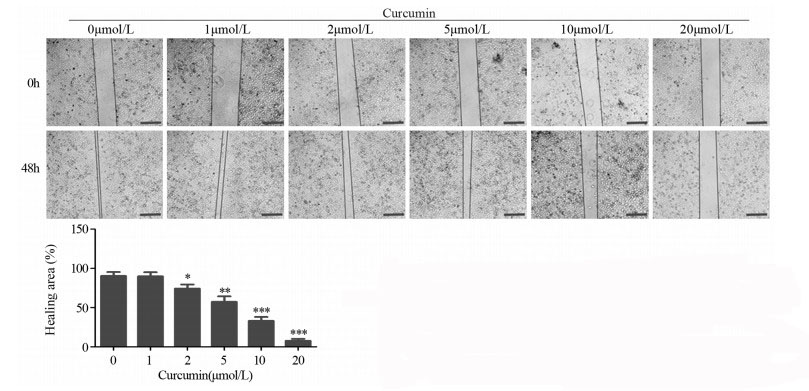
|
| *: P < 0.05, **: P < 0.01, ***: P < 0.001, compared with 0 µmol/L curcumin 图 6 划痕愈合实验检测姜黄素对A549R细胞迁移能力的影响(×200,比例尺: 100 µm) Figure 6 Effects of curcumin on migration ability of A549R cells detected by scratch healing assay (×200, Bar: 100 µm) |
Transwell实验结果显示: 1 µmol/L姜黄素并未显著影响细胞迁移能力,差异无统计学意义(F=0.751, P=0.766);2 µmol/L(F=0.503, P=0.002)、5 µmol/L(F=0.861, P=0.001)、10 µmol/L(F=0.861, P=0.000)、20 µmol/L(F=0.503, P=0.000)的姜黄素处理后,细胞迁移能力显著下降,且迁移能力随姜黄素浓度的升高而显著下降,见图 7。进一步表明姜黄素可显著地抑制A549R细胞的迁移能力。
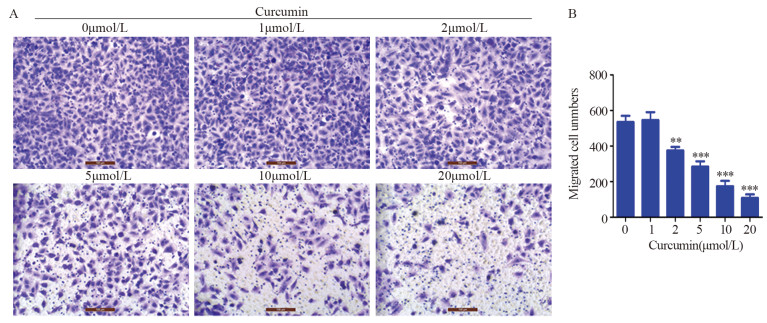
|
| **: P < 0.01, ***: P < 0.001, compared with 0 µmol/L curcumin 图 7 Transwell实验检测姜黄素对A549R细胞迁移能力的影响(×200,比例尺: 100 µm) Figure 7 Effects of curcumin on migration of A549R cells detected by Transwell assay (×200, Bar: 100 µm) |
肺癌是世界上发病率及死亡率较高的恶性肿瘤之一,其中NSCLC发病率占肺癌总数的80%~85%[9]。放疗是NSCLC的常见治疗方法。然而,近年来的研究发现,电离辐射可引起肿瘤细胞发生EMT,进而获得高迁移和侵袭能力,形成远处转移灶[3]。本研究发现经分割辐射处理的NSCLC A549细胞形态由不利于肿瘤细胞转移的椭圆形转变为有利于肿瘤细胞转移的纺锤形间质细胞形态,其上皮/间质标志物pan-Keratin、E-cadherin、N-cadherin、Vimentin、Twist表达水平也显著下调或上调,提示NSCLC放疗有增加肿瘤转移的风险。对于NSCLC患者来说,肿瘤转移是影响其长期生存的最大危险因素之一,因此,探寻放疗诱导的肿瘤转移的分子机制及逆转策略是当前要重点关注的问题。
姜黄素在逆转肿瘤细胞EMT的发生过程中发挥着重要作用[5-6, 10]。本研究证实,姜黄素能够显著逆转放疗诱导的NSCLC A549细胞发生EMT,经姜黄素处理后,A549R细胞形态由纺锤形间质形态转变为椭圆形上皮形态,间质标志物N-cadherin无变化、Vimentin、Twist表达显著下调,上皮标志物E-cadherin的表达也发生下调。E-cadherin作为一个上皮标志物在发生EMT过程表达会下调, 然而在本研究中细胞形态发生显著EMT的A549R细胞E-cadherin却显著上调,经过多次重复实验,我们确认结果无误。通过查阅大量文献发现E-cadherin是钙黏素家族中的一员,分子量约为120 kD,属于钙依赖性跨膜糖蛋白,在上皮细胞多有表达[11]。E-cadherin作为一种细胞膜蛋白,在α-分泌酶ADAMs、基质金属蛋白酶MMPs、激肽释放酶7等共同催化作用下,将成熟的E-cadherin剪切成N端80 kD胞外片段(可溶性E-cadherin,sE-cadherin)和C端38 kD胞内片段[12]。sE-cadherin在NSCLC患者血清中含量明显髙于正常组,且与肿瘤远处转移正相关[13]。因此,E-cadherin对细胞迁移和(或)转移的作用可能是复杂的,本研究中E-cadherin在A549细胞发生EMT过程中表达上调可能并不是一种矛盾现象。在经典的EMT现象中E-cadherin表达下调,而本研究发现的可能是一种新的、非经典的EMT现象,将为重新审视EMT标志物,以及E-cadherin在EMT中的作用提供重要学术参考价值。由于本研究未对其进行深入的功能和机制研究,此种EMT现象与经典的EMT现象的功能和分子机制差异还不清楚。
综上所述,本研究发现了一种非经典的EMT现象,结果显示姜黄素通过下调E-cadherin、Vimentin、Twist的表达,并上调pan-Keratin的表达,从而逆转电离辐射诱导的NSCLC细胞发生EMT,有望为克服临床上电离辐射诱导的NSCLC细胞发生EMT提供了一种新思路。
作者贡献
陈晓琳、张梦琳:主要实验的实施及论文的撰写
昌牧雨、方茂成:参与论文写作
黄楚晴:细胞培养
邱小燕、段奇文:蛋白提取和数据处理
邓鑫州、柯青:提供实验技术、写作指导及资金支持
骆志国:实验理论指导,并提供了实验平台及资金支持
| [1] | Ma L, Men Y, Feng L, et al. A current review of dose-escalated radiotherapy in locally advanced non-small cell lung cancer[J]. Radiol Oncol, 2019, 53(1): 6–14. |
| [2] | Verma V, Hasan S, Wegner RE, et al. Stereotactic ablative radiation therapy versus conventionally fractionated radiation therapy for stage Ⅰ small cell lung cancer[J]. Radiother Oncol, 2019, 131: 145–149. DOI:10.1016/j.radonc.2018.12.006 |
| [3] | Assani G, Zhou Y. Effect of modulation of epithelial-mesenchymal transition regulators Snail1 and Snail2 on cancer cell radiosensitivity by targeting of the cell cycle, cell apoptosis and cell migration/invasion[J]. Oncol Lett, 2019, 17(1): 23–30. |
| [4] | Guo X, Xiao H, Guo S, et al. Long noncoding RNA HOTAIR knockdown inhibits autophagy and epithelial-mesenchymal transition through the Wnt signaling pathway in radioresistant human cervical cancer HeLa cells[J]. J Cell Physiol, 2019, 234(4): 3478–3489. DOI:10.1002/jcp.26828 |
| [5] | Liang Z, Wu R, Xie W, et al. Curcumin Suppresses MAPK Pathways to Reverse Tobacco Smoke-induced Gastric Epithelial-Mesenchymal Transition in Mice[J]. Phytother Res, 2015, 29(10): 1665–1671. DOI:10.1002/ptr.5398 |
| [6] | Liu Z, Liu J, Zhao L, et al. Curcumin reverses benzidine-induced epithelial-mesenchymal transition via suppression of ERK5/AP-1 in SV-40 immortalized human urothelial cells[J]. Int J Oncol, 2017, 50(4): 1321–1329. DOI:10.3892/ijo.2017.3887 |
| [7] | Wang Q, Qu C, Xie F, et al. Curcumin suppresses epithelial-to-mesenchymal transition and metastasis of pancreatic cancer cells by inhibiting cancer-associated fibroblasts[J]. Am J Cancer Res, 2017, 7(1): 125–133. |
| [8] | Zhu FQ, Chen MJ, Zhu M, et al. Curcumin Suppresses Epithelial-Mesenchymal Transition of Renal Tubular Epithelial Cells through the Inhibition of Akt/mTOR Pathway[J]. Biol Pharm Bull, 2017, 40(1): 17–24. |
| [9] | Torre LA, Siegel RL, Jemal A. Lung Cancer Statistics[J]. Adv Exp Med Biol, 2016, 893: 1–19. |
| [10] | Gallardo M, Calaf GM. Curcumin inhibits invasive capabilities through epithelial mesenchymal transition in breast cancer cell lines[J]. Int J Oncol, 2016, 49(3): 1019–1027. DOI:10.3892/ijo.2016.3598 |
| [11] | van Roy F. Beyond E-cadherin: roles of other cadherin superfamily members in cancer[J]. Nat Rev Cancer, 2014, 14(2): 121–134. DOI:10.1038/nrc3647 |
| [12] | Shirahata T, Nakamura H, Nakajima T, et al. Plasma sE-cadherin and the plasma sE-cadherin/sVE-cadherin ratio are potential biomarkers for chronic obstructive pulmonary disease[J]. Biomarkers, 2018, 23(5): 414–421. DOI:10.1080/1354750X.2018.1434682 |
| [13] | Charalabopoulos K, Gogali A, Dalavaga Y, et al. The clinical significance of soluble E-cadherin in nonsmall cell lung cancer[J]. Exp Oncol, 2006, 28(1): 83–85. |
 2019, Vol. 46
2019, Vol. 46


