文章信息
- 超微血流成像技术在前列腺癌精准靶向穿刺活检中的应用
- Application of Superb Micro-vascular Imaging Technology in Guiding Accurately Targeted Biopsy of Prostate Cancer
- 肿瘤防治研究, 2019, 46(9): 815-818
- Cancer Research on Prevention and Treatment, 2019, 46(9): 815-818
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.19.0286
- 收稿日期: 2019-03-12
- 修回日期: 2019-06-13
前列腺癌是全世界中老年男性患病率较高的恶性肿瘤之一,且发病率逐年上升[1]。前列腺癌的危害较大,早期诊断对治疗甚是重要。临床拟诊断前列腺癌的依据为血清前列腺特异性抗原(prostate specific antigen, PSA)水平升高、影像学检查或直肠指检异常等[2]。目前,经直肠超声引导下前列腺穿刺活检是手术前诊断前列腺肿瘤的金标准,能够检查出长径5 mm左右的病灶,但仍会遗漏部分不典型回声灶[3]。提高超声技术指导前列腺癌的精准靶向穿刺一直是研究的重点。超微血流成像(superb micro-vascular imaging, SMI)是一种能够实时动态探测低速、低流量的微血管分布技术,可以较敏感显示前列腺恶性肿瘤的新生微血管血流信号,进而精准识别病灶区,靶向定位穿刺,提高前列腺癌的早期诊断率。本研究意在通过与系统12点穿刺法比较,探讨SMI技术靶向定位替代局部系统穿刺在前列腺癌穿刺活检中的应用价值。
1 资料与方法 1.1 临床资料选取2016年12月—2018年12月安徽医科大学第二附属医院拟诊断为前列腺癌患者87例,血清PSA≥4 ng/L,年龄50~86岁,体重指数相近。所选病例均经过第一次系统12点穿刺术,1月后选择进行第二次穿刺活检,第二次随机分为对照组和SMI组。排除穿刺禁忌证,患者及家属阅读知情同意书并签字后,对照组行超声引导下经直肠前列腺系统12点穿刺法,SMI组先行超声SMI技术检查,后靶向认知定位异常血流信号区替代局部系统穿刺活检。病例基本信息见表 1。
选择东芝B型超声机(Toshiba Aplio500),启用经直肠探头。配BARD全自动活检枪、18 G*20 cm规格针、一次性穿刺架等。
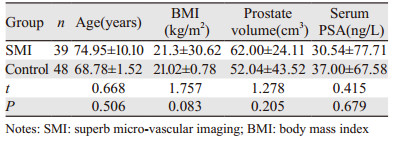
1.2.2 方法患者取左侧胸膝位,充分暴露肛周,穿刺前均先常规经直肠超声多切面扫查诊断留图,同时测量前列腺大小及计算体积。其中SMI组的39例患者再启动SMI技术检测,在机械指数约为0.08、深度范围约5.5 cm以内、血流取样框适宜覆盖检测区域的统一条件下调节至合适血流显像。具体有三种情况:(1)常规灰阶提示有结节,重点观测结节部位微血流分布,若结节微血流较丰富标记为可疑区域(图 1)。(2)常规灰阶未发现明显结节灶,SMI整体观测前列腺微血流信号,外腺血流不对称分布的增多区标记为可疑区域,再重新常规灰阶对比观察,虽未发现明显结节灶,但大部分似可见回声欠均匀(图 2)。(3)常规灰阶未发现结节,SMI示也未见异常血流信号,则行12点系统穿刺法。上述操作由两名具有丰富的经直肠超声检查经验的主治医师对标准采集图像进行分析,若建议结果不同,则请上级医生会诊,并给出最终统一结果。

|
| A: Color doppler flow imaging (CDFI) showed only punctate blood flow signals around the nodule; B: Superb micro-vascular imaging showed abundant blood flow signals in and around the nodule; C: Monochrome SMI (mSMI) showed that the micro-blood flow signals were more intuitive and more significant. 图 1 常规灰阶和超微血流成像超声提示前列腺低回声结节的前列腺癌 Figure 1 Conventional grayscale and superb micro-vascular imaging ultrasound suggested prostate carcinoma with lowechoic nodular in prostate |
|
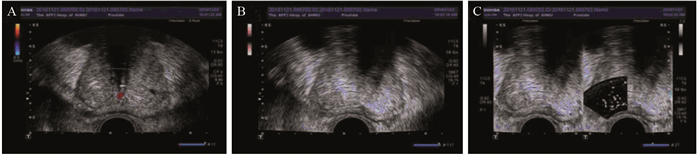
| A: Conventional gray scale and CDFI showed no obvious abnormal echo or blood flow signals; B: SMI showed an asymmetric blood flow increase zone in the peripheral area of the left lobe; C: Local mSMI showed that significantly enriched micro-blood flow zone in the left lateral zone. And then re-contrasted the gray scale, suspicious local echo was uneven. 图 2 常规及SMI超声提示前列腺增生伴钙化的前列腺癌 Figure 2 Conventional and SMI ultrasound suggested prostate cancer with prostate hyperplasia and calcification |
所选病例均经过第一次系统12点穿刺术,1月后选择进行第二次穿刺活检,第二次对照组同样选择常规超声引导下经直肠前列腺穿刺活检,采用底部、中部、尖部三个切面12点系统穿刺方法,如常规经直肠超声提示可疑结节,直接先对结节穿刺活检;SMI组则先对检测的异常血流区中央及周边穿刺两针,后对异常血流区未覆盖部分行12点减针的穿刺。获取的每条组织分袋标记保存,超声报告详细记录每条组织获取区域。由经验丰富的病理医师给出病理结果,并评估恶性组织条的Gleason评分,记录每位前列腺癌患者所有恶性组织条的Gleason评分中最高分及获取位置。
1.3 统计学方法选择统计学软件SPSS22.0,入选病例基本信息服从正态分布,用成组t检验;根据病理结果的标准,统计分析前列腺体积、血清PSA水平在恶性与良性病变中的差异,以及比较SMI组与对照组穿刺平均针点数、Gleason最高评分差异用成组及配对t检验;比较SMI组与对照组前列腺癌检出率、单针阳性率用卡方检验。P < 0.05为差异有统计学意义。
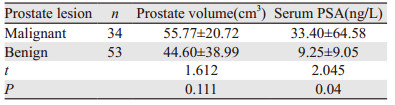
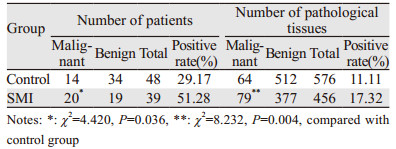
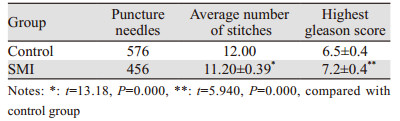
2 结果以第一次穿刺病理结果为标准:34例恶性病变、53例良性病变。在恶性与良性病变中,前列腺体积差异无统计学意义,血清PSA水平差异有统计学意义,见表 2;SMI组穿刺恶性20例,穿刺阳性率为51.28%,总穿刺456针;对照组穿刺恶性14例,穿刺阳性率为29.17%,总穿刺576针。两组穿刺阳性率、平均穿刺点数差异有统计学意义(P < 0.05)。SMI组中恶性病理组织为79条,Gleason最高评分(7.2±0.4)分;对照组中恶性病理组织为64条,Gleason最高评分(6.5±0.4)分。两组单次取材阳性率、Gleason最高评分差异有统计学意义(P < 0.05),见表 3、4。
|
|
|
临床确诊前列腺癌的最重要途径是超声引导下前列腺穿刺,文献表明因前列腺体积大、取材少,早期6点穿刺方法阳性率低,现阶段采取12或13+X点穿刺方式,扩大活检取材,但阳性率提高不显著,穿刺并发症明显增加[4]。此外,前列腺癌患者大多数年龄较大伴有前列腺增生,常规经直肠超声检查较难鉴别恶性与良性病灶。提高前列腺癌精准穿刺率,同时减少穿刺并发症及患者痛苦是前列腺穿刺研究的热点。目前有MRI或CT与超声融合显像技术,但代价昂贵、复杂,大部分医院不能普及。超声SMI技术可快速、简单、敏感地检测前列腺可疑肿瘤区的异常微血流分布状况,相应准确地靶向穿刺,可提高前列腺癌的早期检测率。
研究表明前列腺恶性病灶与良性病灶微血流分布有差异,恶性病灶会生成较多新生微血管,与肿瘤的生长发展密切相关[5],且前列腺癌有着多点性分布,部分在普通超声声像图上未见明显结节的特征。常规灰阶及彩色多普勒对异常区定位差,尤其是图像上示前列腺等回声小病灶,与前列腺增生结节及前列腺炎较难鉴别,血流信号敏感度差。对于前列腺体积较大者,早期6针穿刺会遗漏病灶区;13+X针穿刺法会明显增加出血及感染的概率。正常前列腺血供为内腺区血供较多,呈放射状分布,外腺区血流较少,分布对称。SMI技术示前列腺炎声像图为左、右侧外腺区血流信号明显增多,但分布对称;示前列腺癌为外腺区异常血流丰富区,且分布不对称,或病灶不典型、质地硬,部分缺乏新生微血管,显像为局部血流丰富,分布杂乱。SMI技术能够敏感检测肿瘤新生微血管血流信号区,对于常规灰阶提示结节区重点观测微血流分布,血流信号丰富处标记定位;对于常规灰阶未发现结节区,整体观测前列腺微血流信号,外腺区域血流不对称分布的增多区,再重新对比常规灰阶,观察虽未发现明显结节灶,但大部分似可见回声异常的标记为可疑区域。良性结节灶新生微血管少,SMI示未见明显血流显像或者少许点状显像。微小恶性病灶新生血管少,SMI示血流信号差。因此,临床高度怀疑前列腺癌者,SMI未见异常血流区时应多针点系统穿刺,以防漏诊。
本研究发现,在前列腺恶性与良性病变中,前列腺体积的比较无显著差异,这与朱连华等研究一致[6]。前列腺增生、炎性病变均可致体积增大,增生时以移行区增大显著,外周区受压变薄。增生的良性结节等主要发生在内腺区域,恶性肿瘤结节主要发生在外腺区域。另外,在本研究中,患者的血清PSA水平在前列腺恶性病变时明显上升,大部分在10 ng/L以上,也有高于100 ng/L的。而在良性病变时,血清PSA水平多略有上升,大部分范围4~10 ng/L。这证实血清PSA水平超过10 ng/L,临床考虑恶性病变概率较大。但本文中有12例前列腺良性病变患者的血清PSA水平超过10 ng/L,也证实血清PSA上升可能为前列腺炎等良性病灶[7]。本文为前瞻性研究,因探讨SMI技术靶向定位替代局部系统穿刺在前列腺癌穿刺活检中的应用价值,间隔进行了两次穿刺。第一次所有病例均行12点系统穿刺,以第一次穿刺病理结果为基准,第二次随机选择不同的穿刺活检方式分为两组,其中对照组12点系统穿刺结果与第一次穿刺病理结果相一致,SMI组穿刺病理结果的病例良恶性个数与第一次结果一致,但SMI组较对照组单次穿刺取材阳性率提高,平均穿刺针数略减少,可减少患者的痛苦及穿刺并发症。且SMI组穿刺病理为恶性的Gleason最高评分显著高于对照组,因其精准定位的异常血流丰富区更能代表恶性病灶分化级别,可指导临床治疗方案。
东芝SMI技术具有帧频高、分辨率高、噪声低的优点,可实时清晰探查流量小、速度低的微血流信号,与超声造影灌注极其相似[8]。目前,SMI技术已被广泛使用于超声检查的多方面领域,如乳腺、甲状腺病变的检测[9-11]。本研究中SMI技术穿刺阳性率为51.28%,但临床大样本研究结果可能较低,这可能与本研究样本量较小造成的组间误差、临床操作等密切相关;SMI组较常规灰阶检测前列腺癌的特异性低,可能与其对炎性病灶的敏感有关。该试验着重于前列腺外腺区恶性病灶的研究,具有局限性,且未与超声造影进行比较,有待后续进一步探讨。
综上所述,本研究证实超微血流成像技术可敏感显示前列腺癌微血流信号,对指导前列腺癌精准靶向穿刺有积极临床意义。
作者贡献
吴军:采集数据结果并分析、论文撰写及修改
蓝晓锋:临床实验操作的设计、收集数据及结果分析
姜凡:实验项目管理、指导论文撰写及修改
| [1] | Weng CC, Ding PY, Liu YH, et al. Mutant Kras-induced upregulation of CD24 enhances prostate cancer stemness and bone metastasis[J]. Oncogene, 2019, 38(12): 2005–2019. DOI:10.1038/s41388-018-0575-7 |
| [2] | Halperna JA, Oromendia C, Shoag JE, et al. Use of Digital Rectal Examination as an Adjunct to Prostate Specific Antigen in the Detection of Clinically Significant Prostate Cancer[J]. J Urol, 2018, 199(4): 947–953. DOI:10.1016/j.juro.2017.10.021 |
| [3] | 孔凡雷, 方建华, 包凌云, 等. 超声造影引导减针在前列腺癌穿刺活检的应用[J]. 中国超声医学杂志, 2015, 31(12): 1114–1116. [ Kong FL, Fang JH, Bao LY, et al. Clinincal value of contrast-enhanced ultrasonography in the improving prostate biopsy with guiding reduce-cores puncture[J]. Zhongguo Chao Sheng Yi Xue Za Zhi, 2015, 31(12): 1114–1116. ] |
| [4] | Cantiello F, Cicione A, Autorino R, et al. Transrectal contrast-enhanced ultrasonography, transrectal ultrasonography and retrograde cystography for the detection of vesicourethral anastomosis leakage after radical retropubic prostatectomy: a prospective comparative evaluation[J]. Urol Int, 2013, 90(3): 316–320. DOI:10.1159/000346561 |
| [5] | Kervancioglu E, Kosan M, Erinanc H, et al. Predictive values of vascular endothelial growth factor and microvessel-density levels in initial biopsy for prostate cancer[J]. Kaohsiung J Med Sci, 2016, 32(2): 74–79. DOI:10.1016/j.kjms.2015.12.001 |
| [6] | 朱连华, 郭燕丽, 陈萍, 等. 经直肠超声造影在鉴别诊断前列腺良恶性病灶中的应用价值[J]. 中华医学超声杂志, 2018, 15(3): 233–238. [ Zhu LH, Guo YL, Chen P, et al. Application value of contrast-enhanced transrectal ultrasound in differential diagnosis of benign and malignant prostate nodules[J]. Zhonghua Yi Xue Chao Sheng Za Zhi(Dian Zi Ban), 2018, 15(3): 233–238. DOI:10.3877/cma.j.issn.1672-6448.2018.03.014 ] |
| [7] | Loeb S, Catalona WJ. Prostate-specific antigen in clinical practice[J]. Cancer Lett, 2007, 249(1): 30–39. DOI:10.1016/j.canlet.2006.12.022 |
| [8] | Kuroda H, Abe T, Kakisakak. Visualizing the hepatic vascular architecture using superb microvascular imaging in patients with hepatitis C virus: A novel technique[J]. World J Gastroenterol, 2016, 22(26): 6057–6064. DOI:10.3748/wjg.v22.i26.6057 |
| [9] | Bakdik S, Arslan S, Oncu F, et al. Effectiveness of Superb Microvascular Imaging for the differentiation of intraductal breast lesions[J]. Med Ultrson, 2018, 20(3): 306–312. DOI:10.11152/mu-1433 |
| [10] | Bayramoglu Z, Kandemirli SG, Caliskan E, et al. Assessment of paediatric Hashimoto's thyroiditis using superb microvascular imaging[J]. Clin Radiol, 2018, 73(12): 1059. |
| [11] | Zhu YC, Zhang Y, Deng SH, et al. Diagnostic Performance of Superb Microvascular Imaging (SMI) Combined with Shear-Wave Elastography in Evaluating Breast Lesions[J]. Med Sci Monit, 2018, 24: 5935–5942. DOI:10.12659/MSM.910399 |
 2019, Vol. 46
2019, Vol. 46