文章信息
- 起源于神经纤维瘤1型的恶性外周神经鞘膜瘤1例报道并文献复习
- Malignant Peripheral Nerve Sheath Tumor Arising from Neurofibromatosis Type 1: A Case Report and Literature Review
- 肿瘤防治研究, 2019, 46(9): 861-864
- Cancer Research on Prevention and Treatment, 2019, 46(9): 861-864
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.19.0239
- 收稿日期: 2019-02-27
- 修回日期: 2019-06-19
2. 333000 景德镇,景德镇第二人民医院肿瘤科
2. Department of Oncology, Jingdezhen Second People's Hospital, Jingdezhen 333000, China
神经纤维瘤病(neurofibromatosis, NF)是一种较为常见的多系统受累的常染色体显性遗传性疾病,其发病原因尚不十分清楚,可能与胚胎发育早期神经嵴细胞分化异常和某些变异有关[1]。1987年美国国立卫生研究院(NIH)将其分为周围型(NF1)和中枢型(NF2)[2],其中NF1型较常见。恶性外周神经鞘膜瘤(malignant peripheral nerve sheath tumors, MPNST)起源于周围神经或显示神经鞘不同成分分化的梭形细胞肉瘤,比较少见,曾称恶性雪旺氏瘤、神经源性肉瘤、神经纤维肉瘤。2002年WHO将其统称为MPNST,约占软组织肉瘤的3%~10%,其中近半数病例有NF1病史,低于10%的患者发病与放疗有关[3-4]。本文报道1例双侧大腿NF1进展为MPNST病例的病理组织学特征及免疫组织化学结果,复习相关文献来探讨MPNST的诊断及鉴别诊断。
1 资料与方法 1.1 临床资料患者女,39岁,因双侧大腿包块进行性增大1年,于2018年7月3日入院。患者自1985年起,先从后背开始出现色素点,并逐年增多、范围变大,逐渐累及前胸、颜面部及四肢。1997年出现多发串珠样结节,大小不一,可推动。2007年怀孕期间色素斑颜色加深明显,孕期结束后未见色素减退,但均未进行任何处理。2016年患乳腺癌(非特殊型浸润性导管癌Ⅲ级),术后规范放化疗,口服他莫昔芬治疗至今。家族未发现他人罹患此病。查体:心、肺、腹功能未见异常,全身皮肤多发咖啡斑及大小不等的结节,部分突出皮面约0.5 cm~3 cm,无压痛,见图 1A,双侧大腿包块位于皮下,位置较深,表面皮肤无红肿、溃疡,肿块大小约9 cm×7 cm×3 cm和8 cm×6 cm×4 cm,移动度可,压痛。辅助检查:颈部CT示:颈部皮下软组织内见多发软组织结节;肿瘤标志物CA125: 41.3 u/ml,临床诊断:神经纤维瘤病(双侧大腿神经纤维瘤)。
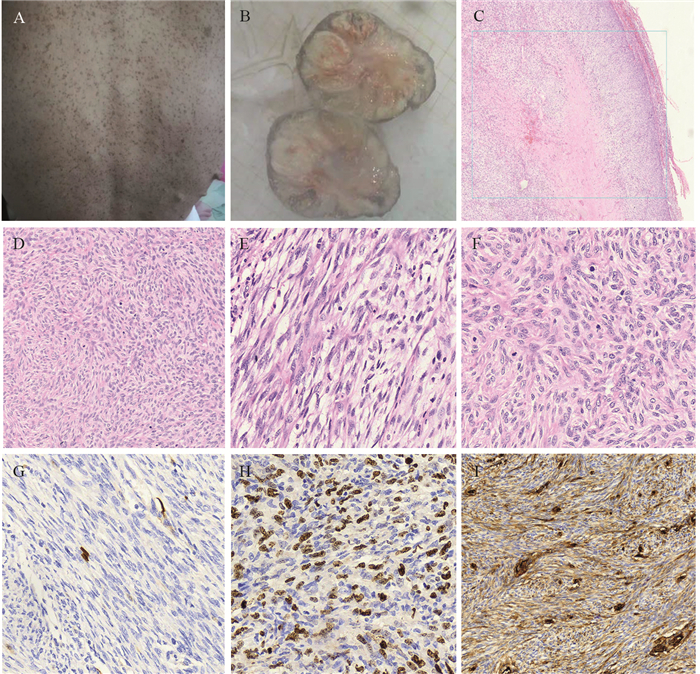
|
| A: the whole body of the patient had multiple café-au-lait macules and neurofibromas; B: the gross of the tumor had a partial capsule, quality medium-sized ashen round tubercle, slight hemorrhage and necrosis were observed; C, D: the tumor had a diffuse growth pattern and distributed in alternating densities, geographic necrosis, and appeared as pseudocapsule (HE ×4; ×10); E: the tumor cells were spindle-shaped and comma-like, with light pink cytoplasm, hyperchromatic nuclei and irregular karyotype (HE ×20); F: several mitoses were observed, just in the one high power field (HE ×40); G: the expression of S100 in MPNST were negative in many tumor cells, and a little number of tumor cells were positive (IHC ×40); H: over-expression of Ki-67 in MPNST, while in NF at a relatively low level (IHC ×40); I: the expression of CD34 were positive in many tumor cells (IHC ×20) 图 1 周围型神经纤维瘤病相关的恶性外周神经鞘膜瘤患者的临床皮肤表现及病理组织HE及IHC图片 Figure 1 Typical cutaneous lesions, HE staining and immunohistochemical pictures of malignant peripheral nerve sheath tumors (MPNST) arising from neurofibromatosis type 1 |
患者于2018年7月9日手术切除双侧大腿包块送病理检查。术中见肿块呈灰白灰黄色,有部分包膜,质韧,与神经粘连紧密。
1.2 病理学特征 1.2.1 巨检灰白灰红色类圆形包块2个分别约8.5 cm×5.5 cm×4 cm和6.5 cm×6 cm×4.5 cm,肿块切面灰白灰黄色,呈结节状,质韧,结节中央质软细腻,可见点灶出血和坏死,见图 1B。
1.2.2 镜检4×10、10×10倍镜下观:肿块表面有一层纤维性假包膜,肿瘤细胞呈弥漫分布,细胞密集区与稀疏区交替分布,可见地图样坏死,见图 1C~D;20×10、40×10倍镜下观:肿瘤细胞核呈短梭形、纤细、逗点样,核深染、不规则,胞质弱嗜伊红,核分裂相易见,呈条束状、旋涡状、触觉小体样排列,在稀疏区细胞呈波浪状排列,见图 1E~F。
1.2.3 免疫组织化学及基因检测结果肿瘤细胞S100(点灶+),见图 1G,Ki-67(40%+),见图 1H,CD34(+),见图 1I,Actin(+),CD56(+/-),CD57(+/-),PGP9.5(+),P53(+/-),SMA、Desmin、Bcl-2、GFAP、MiTF、STAT6、CD99、EMA、SOX10、AE1/AE3、MyoD1和LMP1均阴性。基因检测结果:NF1p.Arg1968X突变,PDGFRA基因扩增(扩增倍数18.2倍),P53未见突变。病理诊断:(双侧大腿)梭形细胞肿瘤,结合临床病史及免疫组织化学及基因检测,符合恶性外周神经鞘膜瘤,神经纤维瘤(NF1)恶变。
2 讨论NF1发病率为1/2 500~1/3 000,约50%有家族史,是最常见的常染色体显性遗传性疾病,与NF1基因的功能丢失突变和缺失密切相关。NF1基因位于17q11.2,含有60个外显子,经过剪切翻译合成2 818个氨基酸的神经纤维蛋白。该蛋白可负向调节RAS/MAPK信号转导及正向调节细胞内环磷酸腺苷(cAMP)水平,从而参与调控细胞的生长、分化调节及肿瘤发生。目前已报道有1 382个NF1相关基因突变,包括错义突变、无义突变、剪切突变、插入突变、缺失突变及重复片段等多种类型。其中插入、缺失导致的移码突变占所有突变类型的54%,剪切突变占21%。NF1基因具有较高的突变频率,据统计,接近50%的患者发生的突变为自身新发突变,无家族遗传史[5]。NF1诊断必须符合至少2个以下条件:≥6个牛奶咖啡斑(青春期前d≥0.5 cm,青春期后d≥1.5 cm);≥2个(丛状)神经纤维瘤;≥2个色素性虹膜错构瘤;腋窝/腹股沟雀斑;视神经胶质瘤;骨病变(蝶骨、长管状骨结构不良,骨皮质变薄);有NFI患者家族史[3]。本例患者没有NF1罹患家族史,但临床表现有牛奶咖啡斑 > 6个,直径超过1.5 cm;多发神经纤维瘤;腋窝和腹股沟均有色素斑出现,基因检测结果提示NF1p.Arg1968X位点突变,该位点的突变在Ⅰ型NF的多个家族系中被检测到,提示携带该突变的人群有较高的患癌风险,结合临床病史及基因检测结果NF1诊断明确。
MPNST是一种相对罕见的软组织肉瘤,总发病率约1/10万。该肿瘤恶性程度高,年龄覆盖范围广,与周围神经干的关系密切,以四肢、躯干、头颈部等部位多见,腹膜后[6]、纵隔[7]、肝脏[8]、肾上腺[9]也有发现。MPNST组织学形态较复杂、多样,可有血管外皮瘤样结构,或伴异源性成分。仅凭HE染色不太容易诊断及鉴别,需满足以下任意1个条件方可诊断:肿瘤起源于NF1或周围神经;良性神经肿瘤进展而来;没有NF1,但细胞形态与MPNST相同,免疫组织化学/电子显微镜提示施万细胞分化。
本例患者HE镜下示假包膜、梭形细胞为主,可见逗点样,胞质少淡粉染,核深染、核形态不规则、病理性核分裂相易见,细胞密集区与稀疏区交替分布,地图样坏死,小血管增生;免疫组织化学结果示S100点灶肿瘤细胞核、质阳性,大部分肿瘤细胞是阴性,有研究认为[10]随着MPNST的恶性程度增加,S100表达水平下降。此外,CD56、CD57均显示部分肿瘤细胞阳性,提示神经来源的肿瘤,Ki-67高表达提示肿瘤增殖活性高,预后不好。但需与以下肿瘤鉴别:(1)纤维肉瘤:肿瘤细胞形态较单一,呈鱼骨样排列,间质胶原丰富,免疫组织化学示瘤细胞只表达Vimentin,偶表达Actin,而神经标志物S100、CD56、CD57、SOX10等多为阴性;(2)恶性黑色素瘤:肿瘤细胞形态多样,尤其是无色素性、梭形细胞表现者仅凭细胞形态很难鉴别,需借助免疫组织化学鉴别。后者免疫组织化学HMB45、MiTF、S100阳性,而神经标志CD56和SOX10阴性可鉴别;(3)梭形细胞滑膜肉瘤:该肿瘤大关节附近多见,肿瘤细胞呈纤维母细胞样细胞(胖梭形)、鱼骨样、人字形分布,可见上皮样区域,镜下不易鉴别,但后者免疫组织化学CKP、Bcl-2、CD99阳性,S100一般阴性,部分S100阳性者,可加做神经相关抗体标记如SOX10、PGP9.5、H3K27me3[11-12]等及其他辅助检查或相关基因检测来鉴别;(4)孤立性纤维性肿瘤:肿瘤发生于胸膜多见,细胞短梭形、纤细,排列方式多样,显示树突状纤维母细胞分化,具有血管外皮瘤样结构,免疫组织化学CD34、Bcl-2、STAT6阳性,S100阴性可鉴别,STAT6阳性时更支持诊断孤立性纤维性肿瘤。本例患者STAT6及Bcl-2均阴性可排除。此外还要与多形性未分化肉瘤、平滑肌瘤(Desmin及SMA阳性,S100阴性时有鉴别意义)、间质瘤(CD117、DOG1、CD34阳性,尤其是前两者阳性或DOG1阳性时诊断更明确)等鉴别。本例患者有NF1及乳腺癌放化疗病史,肿块位于双侧大腿,进行性增大1年多,术中见肿块与周围神经紧密粘连、关系密切,HE镜下组织形态学及免疫组织化学结果均支持MPNST诊断。
MPNST属高度恶性的软组织肿瘤,发病率低,治疗效果不佳,目前治疗手段主要采用肿块切除,局部辅以放化疗的综合治疗手段,以降低复发率和远处转移率,但对长期生存影响不大。目前有效的化疗药物很少,有研究[13]认为血小板源性生长因子受体a(platelet-derived growth factor receptor alpha, PDGFRA)的过表达与MPNST的发病相关,且提示这类患者可能对伊马替尼、舒尼替尼敏感。PDGFRA基因属于受体酪氨酸激酶家族,编码血小板源性生长因子受体a,该基因突变会导致细胞内多种信号通路的激活,促进细胞生长增殖,与多种肿瘤的发生密切相关。MPNST的预后差,复发率及远处转移率均较高,5年生存率 < 50%[14-15],张笑盈等[16]对13例高级别MPNST分析发现2年生存率约60%,5年生存率约30%,放疗相关型及复发、远处转移者预后较差。袁振南等[3, 17-18]认为影响MPNST患者预后的因素很多,如肿块体积大、位置深、手术未完整切除,Ki-67高表达,及S100阴性等因素暗示预后不良,尤其是S100的表达水平会随着肿瘤细胞分化越差,表达越低。本例患者PDGFRA基因的扩增倍数为18.2倍,但未进行任何特殊治疗。术后2月肿瘤复发,总随访6月,目前尚未出现转移,一般情况尚可。
作者贡献
贾志红:病理报告初审及文章撰写
胡招兵:临床资料的收集、文章撰写及随访
王仁杰:病理切片及免疫组织化学资料的复审
吴颖虹:图片文字说明及翻译
祝淇滢:病理资料的制备及收集
| [1] | Ramani P, Nash R, Sowa-Avugrah E, et al. High levels of polo-like kinase 1 and phosphorylated translationally controlled tumor protein indicate poor prognosis in neuroblastomas[J]. J Neurooncol, 2015, 125(1): 103–111. DOI:10.1007/s11060-015-1900-4 |
| [2] | Tut TG, Lim SH, Dissanayake IU, et al. Upregulated polo-like kinase 1 expression correlates with inferior survival outcomes in rectal cancer[J]. PLoS One, 2015, 10(6): e0129313. DOI:10.1371/journal.pone.0129313 |
| [3] | 王坚, 朱雄增. 软组织肿瘤病理学[M]. 北京: 人民卫生出版社, 2017: 1056-1101. [ Wang J, Zhu XZ. Pathology of Soft Tissue Tumors[M]. Beijing: People's Medical Publishing House, 2017: 1056-1101. ] |
| [4] | Fletcher CD. The evolving classification of soft tissue tumours-an update based on the new 2013 WHO classification[J]. Histopathology, 2014, 64(1): 2–11. DOI:10.1111/his.12267 |
| [5] | Beert E, Brems H, Renard M, et al. Biallelic inactivation of NF1 in a sporadic plexiform neurofibroma[J]. Genes Chromosomes Cancer, 2012, 51(9): 852–857. DOI:10.1002/gcc.21969 |
| [6] | Meng ZH, Yang YS, Cheng KL, et al. A huge malignant peripheral nerve sheath tumor with hepatic metastasis arising from retroperitoneal ganglioneuroma[J]. Oncol Lett, 2013, 5(1): 123–126. DOI:10.3892/ol.2012.961 |
| [7] | 谭丽珊, 陈智慧, 陈玉英, 等. 起源于节细胞神经瘤的恶性外周神经鞘膜瘤临床病理观察[J]. 诊断病理学杂志, 2017, 24(9): 661–664. [ Tan LS, Chen ZH, Chen YY, et al. Malignant peripheral merve sheath tumor arising from ganglioneuroma: a clinicopathological analysis and review of the literature[J]. Zhen Duan Bing Li Xue Za Zhi, 2017, 24(9): 661–664. DOI:10.3969/j.issn.1007-8096.2017.09.006 ] |
| [8] | Kóbori L, Nagy P, Máthé Z, et al. Malignant peripheral nerve sheath tumor of the liver: a case report[J]. Pathol Oncol Res, 2008, 14(3): 329–332. DOI:10.1007/s12253-008-9078-0 |
| [9] | Mow TC, Navadgi S, Jackett L, et al. Malignant peripheral nerve sheath tumor arising de novo from ganglioneuroma[J]. Pathology, 2015, 47(6): 595–598. DOI:10.1097/PAT.0000000000000317 |
| [10] | Ralli M, Singh S, Hasija S, et al. Intrathoracic malignant peripheral nerve sheath tumor: histopathological and immunohistochemical features[J]. Iran J Pathol, 2015, 10(1): 74–78. |
| [11] | Mito JK, Qian X, Doyle LA, et al. Role of Histone H3K27loss as a maker for malignant peripheral nerve sheath tumor in fine-needle aspiration and small biopsy specimens[J]. Am J Clin Pathol, 2017, 148(2): 179–189. DOI:10.1093/ajcp/aqx060 |
| [12] | 宋紫暄, 李光明, 张静, 等. H3K27三甲基化蛋白可作为MPNST的重要诊断标记物[J]. 天津医科大学学报, 2018, 24(4): 353–356. [ Song ZX, Li GM, Zhang J, et al. H3K27me3 is a highly sensitive diagnostic marker for MPNST[J]. Tianjin Yi Ke Da Xue Xue Bao, 2018, 24(4): 353–356. ] |
| [13] | Ki DH, He S, Look AT, et al. Overexpression of PDGFRA cooperates with loss of NF1 and p53 to accelerate the molecular pathogenesis of malignant peripheral nerve sheath tumors[J]. Oncogene, 2017, 36(8): 1058–1068. DOI:10.1038/onc.2016.269 |
| [14] | Patel TD, Shaigany K, Fang CH, et al. Comparative analysis of head and neck and non-head and neck malignant peripheral nerve sheath tumors[J]. Otolaryngol Head Neck Surg, 2016, 154(1): 113–120. DOI:10.1177/0194599815606700 |
| [15] | Yuan Z, Xu L, Zhao Z, et al. Clinicopathological features and prognosis of malignant peripheral nerve sheath tumor: a retrospective study of 159 cases from 1999 to 2016[J]. Oncotarget, 2017, 8(62): 104785–104795. |
| [16] | 张笑盈, 任玉波, 杨绍敏, 等. 腹膜后恶性外周神经鞘膜瘤13例临床病理分析[J]. 临床与实验病理学杂志, 2018, 34(6): 627–631. [ Zhang XY, Ren YB, Yang SM, et al. Retroperitoeal malignant peripheral nerver sheath tumors: a clinicopathologic study of 13 cases[J]. Lin Chuang Yu Shi Yan Bing Li Xue Za Zhi, 2018, 34(6): 627–631. ] |
| [17] | 袁振南, 于胜吉. 恶性外周神经鞘瘤预后影响因素的研究进展[J]. 癌症进展, 2017, 15(2): 105–107. [ Yuan ZN, Yu SJ. Research progress on prognostic factors of malignant malignant peripheral nerve sheath tumors[J]. Ai Zheng Jin Zhan, 2017, 15(2): 105–107. ] |
| [18] | Pekmezci M, Reuss DE, Hirbe AC, et al. Morphologic and immunohistochemical features of malignant peripheral nerve sheath tumors and cellular schwannomas[J]. Mod Pathol, 2015, 28(2): 187–200. DOI:10.1038/modpathol.2014.109 |
 2019, Vol. 46
2019, Vol. 46


