文章信息
- 187例血吸虫病结直肠癌患者的构成分析与实验室检查特点
- Composition and Laboratory Examination Characteristics of 187 Colorectal Cancer Patients with Schistosomiasis
- 肿瘤防治研究, 2019, 46(9): 811-814
- Cancer Research on Prevention and Treatment, 2019, 46(9): 811-814
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.19.0190
- 收稿日期: 2019-02-19
- 修回日期: 2019-07-08
我国是日本血吸虫病流行较严重的国家,目前全国共有12个血吸虫病流行省(包括直辖市、自治区),450个血吸虫病流行县(包括市、区),28 544个血吸虫病流行村[1]。近年来,尽管急性日本血吸虫病感染患者数量明显下降,但仍有大量慢性血吸虫病感染者,同时对于慢性血吸虫病感染者肠道肿瘤发生情况尚未明确。
结直肠肿瘤曾是西方经济发展水平较高国家中最常见的恶性肿瘤之一。经济发达国家中结直肠癌发病率明显高于发展中国家,这与发达国家不健康的饮食习惯[2]、较高的肥胖程度[3]以及某些病原体感染[4]等因素有关。
因此,本研究初步探讨该地区控制血吸虫疫情后连续5年日本血吸虫病结直肠癌的发生情况与实验室检查结果,分析血吸虫病是否与结直肠癌的发生有相关性及血吸虫病结直肠癌的特征。
1 资料与方法 1.1 资料收集收集2013年1月—2017年12月皖南医学院弋矶山医院收治的血吸虫病结直肠癌患者187例。所有病例均来自日本血吸虫疫区。诊断结果均经两名以上经验丰富的病理专家确认。同时收集患者临床资料与实验室检查结果。此外,收集同期经临床病理证实的单纯结直肠癌患者2 597例作为对照。
1.2 病理检查对于手术标本,沿肠壁长轴剪开肠管、垂直于肠壁切取肿瘤标本,肿瘤组织充分取材,根据肿瘤大小、浸润深度、肿瘤形状,于不同质地、颜色的区域分别取材,肿瘤浸润最深处至少取一块全层厚度肿瘤及肠壁组织。标本采用10%中性甲醛液固定,常规脱水,石蜡包埋,制成4 μm连续切片。消化内镜取材,无蒂息肉以切缘基底部为中心向左、右两侧全部取材。有蒂息肉当蒂切缘最大径 > 2 mm时,略偏离蒂切缘中心处垂直于蒂切缘平面切开标本,再平行此切面,间隔2~3 mm将标本全部取材;蒂切缘最大径≤2 mm时,垂直于蒂切缘平面间隔2~3 mm将全部标本取材,使蒂部作为一个单独的蜡块直接包埋。按同一包埋方向全部取材。分别作HE染色、光学显微镜检查,必要时行免疫组织化学染色。
1.3 血清肿瘤标志物检测患者空腹抽取静脉血5 ml左右,采用化学发光免疫分析法检测各组患者血清癌胚抗原(CEA)、糖链抗原125(CA125)和糖链抗原199(CA199)水平。正常值标准分别为:CEA < 0.5 U/ml,CA125 < 35 U/ml,CA199 < 37 U/ml。所有样本均通过SIEMENS ADVIA Centaur XP全自动化学免疫分析仪检测,操作过程均按照仪器说明书进行。
1.4 统计学方法采用SPSS19.0统计软件,计量资料以均数±标准差(x±s)表示,两样本间比较采用t检验,方差齐性的多样本均数之间比较选用LSD-t检验进行组间比较,数据偏态较大的采用Kruskal-Wallis H统计。P < 0.05为差异有统计学意义。
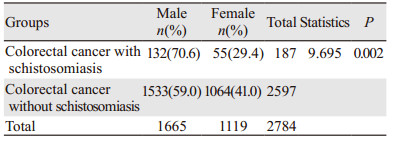
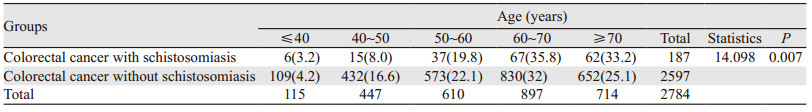
2 结果 2.1 一般临床资料187例血吸虫病结直肠癌患者有日本血吸虫病感染病史,病程均在10年以上,年龄31~87岁,平均年龄(64.79±10.91)岁。病理标本中,手术标本2 150例,肠镜标本634例。单纯结直肠癌2 597例,年龄21~109岁,平均年龄(61.63±11.86)岁。血吸虫病结直肠癌患者中,男性显著多于女性(P=0.002),见表 1。血吸虫病结直肠癌平均年龄显著大于单纯结直肠癌(P=0.001),尤其在60岁以后(P=0.007),见表 2。
|
|
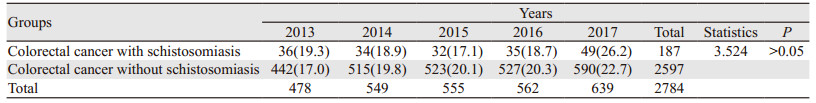
5年间两组患者数量均逐年增加,尤其是2017年血吸虫病结直肠癌患者数量,两组差异无统计学意义(P > 0.05),见表 3。
|
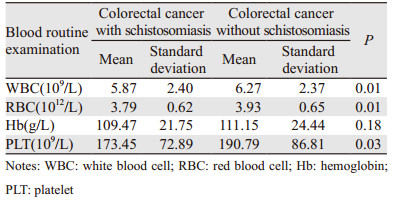
单纯结直肠癌组白细胞数量高于血吸虫病结直肠癌组,但均在正常范围内(正常参考值:(4~10)×109/L)。两组红细胞数量均稍低于正常值(正常参考值:男,(4.0~5.5)×1012/L;女,(3.5~5.0)×1012/L),差异有统计学意义(P=0.01)。两组血红蛋白数量均低于正常值(正常参考值:男,(120~160)g/L;女,(110~150)g/L)),差异无统计学意义(P=0.18)。两组血小板数量均在正常范围内,见表 4。187例日本血吸虫病结直肠癌患者中粪便隐血阳性数为119例(63.64%),阳性比例显著高于2 597例单纯结直肠癌组中粪便隐血阳性数1 344例(51.75%)(P=0.002)。
|
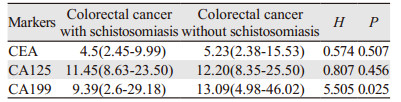
两组CEA与CA199的水平均明显高于正常值,而CA125无明显升高。单纯结直肠癌组CA199水平高于血吸虫病结直肠癌组(P=0.025),见表 5。
|
我国为日本血吸虫病流行区,全国血吸虫病预防控制工作进展顺利,血吸虫病疫情整体下降。2017年全国血吸虫病流行病学调查显示,全国推算血吸虫病人数为37 601例,晚期血吸虫病29 407例[1]。血吸虫虫卵抗原引起的肝肠组织肉芽肿及随之发生的纤维化甚至硬化,是慢性和晚期患者的主要病理表现。由此导致的门脉高压、肠梗阻及结直肠癌等是晚期血吸虫患者死亡的主要原因。
近十余年中国男女性结肠、直肠癌发病率随年龄增长呈上升趋势,高发于50岁以上年龄组[5],本研究数据显示,从2013年1月至2017年12月皖南医学院弋矶山医院共收治结直肠癌患者2 784例,其中日本血吸虫病结直肠癌187例(6.72%),单纯结直肠癌2 597例(93.28%);男1 665例(59.81%),女1 119例(40.19%),男女性别比为1.49:1。50岁以上患者为79.81%,60岁以上为57.89%。与全国报道的数据[5]基本一致。近年来,多项研究提示结直肠癌的发生与某些病原体感染,如细菌[4, 6]、寄生虫[7-8]等因素有关。
日本血吸虫感染与肠道恶性肿瘤之间的关系在上世纪80年代开始出现争论,一些流行病学研究发现日本血吸虫感染患者结直肠癌风险增加。尽管迄今尚未从血吸虫成虫或虫卵中分离出任何致癌物,但有研究发现它们具有相关性[2]。血吸虫虫卵肉芽肿的形成是一个慢性炎性反应过程, 其中炎性反应灶处的巨噬细胞可释放活性氧、活性氮等,破坏蛋白质、DNA、细胞膜,改变酶的活性以及基因的表达[9],因此认为慢性血吸虫病可促进肿瘤的发生。Kaw等收集了1 277例肠癌病例,男女比例约为1:1,其中大部分处于50~70岁,平均年龄为55.3岁,40岁以下患者占17%。结果发现与老年人相比,40岁以下患者常伴有炎性疾病,并且血吸虫病常与直肠癌伴发[10]。本组研究数据显示,187例日本血吸虫病结直肠癌患者中,男132例、女55例,血吸虫病结直肠癌患者中,男性显著多于女性(P=0.002)。血吸虫病结直肠癌平均年龄(64.79±10.91)岁,显著大于单纯结直肠癌(61.63±11.86)岁(P=0.001),尤其在60岁以后(P=0.007)。由此提示,血吸虫病结直肠癌与单纯结直肠癌有不同的性别与年龄构成比,可能与血吸虫病独特的流行病学特征,如男性易于接触疫水以及不同的发病机制等相关。
有研究发现血吸虫病结直肠癌发生在直肠的相对较少, 而发生在乙状结肠、降结肠、脾曲及横结肠者则比单纯结直肠癌多数倍, 这符合血吸虫病灶在大肠的分布[11]。在日本的Yamanashi地区,1978年就消灭了血吸虫,但日本血吸虫感染的慢性效应对该地区肝癌的高死亡率影响时间较长[12]。本研究数据显示,尽管我国血吸虫病预防控制工作进展顺利,全国血吸虫病疫情整体下降,新发患者明显减少,但我国仍然有大量血吸虫感染者,随着患者年龄增长与血吸虫虫卵在机体内存留的时间增加,肠癌的发生率明显增加,这可能是我国血吸虫病疫区肠癌发生率增加的原因之一。
有资料显示,胃血吸虫病患者中有高达50%以上的胃癌发病率,临床表现酷似慢性胃炎、消化性溃疡及进展期胃癌,只有通过胃镜活检或手术病理切片检查才能确诊。这些肠道病变与胃部病变均可以导致慢性出血、失血。本研究数据显示187例日本血吸虫病结直肠癌患者中粪便隐血阳性数为119例(63.64%),显著高于单纯结直肠癌组(51.75%)(P=0.002)。这可能是血吸虫病结直肠癌更易发生贫血的原因之一。因此,我们认为对于在血吸虫病疫区、临床上有消化道症状而经药物治疗效果不佳的患者,尤其不明原因贫血的患者,应尽早行肠镜或胃镜等检查,发现是否有合并消化道肿瘤[13]。
本研究比较两组患者血清CEA、CA125、CA199水平,其中血吸虫病结直肠癌者与单纯结直肠癌患者CEA与CA199的水平均明显高于正常值。CA199水平在单纯结直肠癌组高于血吸虫病结直肠癌组(P=0.02)。结果提示CEA与CA199在肠癌中均有一定诊断价值,而CA199水平变化在单纯结直肠癌更敏感。
血吸虫病结直肠癌具有一定临床特征性,对于血吸虫疫区居民,建议定期行血常规、大便常规加隐血及血清肿瘤标志物等检查。对于年龄大于50岁,尤其是60岁以后、男性、不明原因贫血,应尽早行消化道内镜等检查,排除消化道肿瘤的可能。这对提早发现患者胃肠道肿瘤,提高生存率具有重要意义。
作者贡献
杨江华:文章设计与质量控制、论文撰写
杜志祥、玄坤:数据统计与分析
王文节、盛皓宇:临床资料与实验室数据收集
| [1] | 张利娟, 徐志敏, 戴思敏, 等. 2017年全国血吸虫病疫情通报[J]. 中国血吸虫病防治杂志, 2018, 30(5): 481–488. [ Zhang LJ, Xu ZM, Dai SM, et al. Endemic status of schistosomiasis in People's Republic of China in 2017[J]. Zhongguo Xue Xi Chong Bing Fang Zhi Za Zhi, 2018, 30(5): 481–488. ] |
| [2] | Aleksandrova K, Pischon T, Jenab M, et al. Combined impact of healthy lifestyle factors on colorectal cancer: a large European cohort study[J]. BMC Med, 2014, 12: 168. DOI:10.1186/s12916-014-0168-4 |
| [3] | Ma Y, Yang Y, Wang F, et al. Obesity and risk of colorectal cancer: a systematic review of prospective studies[J]. PLoS One, 2013, 8(1): e53916. DOI:10.1371/journal.pone.0053916 |
| [4] | Andres-Franch M, Galiana A, Sanchez-Hellin V, et al. Streptococcus gallolyticus infection in colorectal cancer and association with biological and clinical factors[J]. PLoS One, 2017, 12(3): e0174305. DOI:10.1371/journal.pone.0174305 |
| [5] | 王锡山. 中美结直肠癌流行病学特征及防诊治策略的对比分析[J]. 中华结直肠疾病电子杂志, 2017, 6(6): 447–453. [ Wang XS. Comparison analysis of epidemiological characteristics and prevention-treatment strategy of colorectal cancer in China and the United States[J]. Zhonghua Jie Zhi Chang Ji Bing Dian Zi Za Zhi, 2017, 6(6): 447–453. DOI:10.3877/cma.j.issn.2095-3224.2017.06.002 ] |
| [6] | ChangxiChen, Mao Y, Du J, et al. Helicobacter pylori infection associated with an increased risk of colorectal adenomatous polyps in the Chinese population[J]. BMC Gastroenterol, 2019, 19(1): 14. DOI:10.1186/s12876-018-0918-4 |
| [7] | Esteghamati A, Khanaliha K, Bokharaei-Salim F, et al. Prevalence of Intestinal Parasitic Infection in Cancer, Organ Transplant and Primary Immunodeficiency Patients in Tehran, Iran[J]. Asian Pac J Cancer Prev, 2019, 20(2): 495–501. DOI:10.31557/APJCP.2019.20.2.495 |
| [8] | Kopacz Ż, Kváč M, Karpiński P, et al. The First Evidence of Cryptosporidium meleagridis Infection in a Colon Adenocarcinoma From an Immunocompetent Patient[J]. Front Cell Infect Microbiol, 2019, 9: 35. DOI:10.3389/fcimb.2019.00035 |
| [9] | Honeycutt J, Hammam O, Fu CL, et al. Controversies and challenges in research on urogenital schistosomiasis-associated bladder cancer[J]. Trends Parasitol, 2014, 30(7): 324–332. DOI:10.1016/j.pt.2014.05.004 |
| [10] | Kaw LL Jr, Punzalan CK, Crisostomo AC, et al. Surgical pathology of colorectal cancer in Filipinos: implications for clinical practice[J]. J Am Coll Surg, 2002, 195(2): 188–195. DOI:10.1016/S1072-7515(02)01186-9 |
| [11] | 徐秀亮, 杨江华, 潮燕. 日本血吸虫病相关胃肠道肿瘤的临床与病理特征[J]. 热带病与寄生虫学, 2014, 12(1): 7–9, 64. [ Xu XL, Yang JH, Chao Y. Clinical and pathological characteristics of gastrointestinal tumors related to schistosomiasis japonica[J]. Re Dai Bing Yu Ji Sheng Chong Xue, 2014, 12(1): 7–9, 64. DOI:10.3969/j.issn.1672-2302.2014.01.003 ] |
| [12] | Matsuda M, Fujii H. Chronic schistosomiasis japonica is an independent adverse prognostic factor for survival in hepatocellular carcinoma patients who have undergone hepatic resection: clinicopathological and prognostic analysis of 198 consecutive patients[J]. World J Surg, 2009, 33(12): 2644–2650. DOI:10.1007/s00268-009-0228-7 |
| [13] | 王振军, 付李缘. 大肠癌筛查共识与争议[J]. 临床外科杂志, 2018, 26(10): 721–723. [ Wang ZJ, Fu LY. Colorectal cancer screening consensus and controversy[J]. Lin Chuang Wai Ke Za Zhi, 2018, 26(10): 721–723. DOI:10.3969/j.issn.1005-6483.2018.10.001 ] |
 2019, Vol. 46
2019, Vol. 46
