文章信息
- D-双功能蛋白通过STAT3促进大鼠肝细胞肝癌的形成机制
- Mechanism of D-bifunctional Protein Promoting Formation of Hepatocellular Carcinoma in Rat via STAT3
- 肿瘤防治研究, 2019, 46(8): 690-695
- Cancer Research on Prevention and Treatment, 2019, 46(8): 690-695
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.19.0170
- 收稿日期: 2019-02-15
- 修回日期: 2019-04-15
2. 050017 石家庄,河北医科大学中西医结合学院
2. College of Integrative Chinese and Western Medicine, Hebei Medical University, Shijiazhuang 050017, China
肝细胞肝癌(hepatocellular carcinoma, HCC)具有发病率高、预后较差等特点[1]。研究发现,信号转录因子3(STAT3)是介导HCC发生的核内转录子,在HCC的发生发展过程中起到重要作用[2]。D-双功能蛋白(D-bifunctional protein, DBP)是大多数哺乳动物体内的一种重要氧化还原酶,又称17β-雌二醇脱氢酶Ⅳ[3]。DBP酶大量存在于哺乳动物各种组织细胞的过氧化物酶体内,而其在肝脏比其他组织表达高[4]。最新报道显示DBP在前列腺癌、乳腺癌等其他组织和细胞中的表达水平也明显增加[5]。本课题组前期细胞实验结果也证实了DBP在肝癌细胞系HepG2中的表达水平明显升高,而且DBP的表达增高对肝癌细胞的增殖起到了促进作用[6]。本研究进一步探讨DBP在肝癌大鼠体内的表达及其作用机制,以期为肝细胞癌功能监测和阻止肝癌的形成和发展提供新的基因靶点。
1 材料与方法 1.1 研究对象本研究雄性SD大鼠来源于河北省实验动物中心(许可证编号:SCXK(冀)2013-1-003),实验大鼠体重质量均在200~220 g左右;研究用的大鼠均达到实验动物相关标准,饲养条件为(27±1)℃、湿度(70±4)%。每天自然光照,正常饮食喂养。人肝癌细胞株HepG2来源于中国医学科学院肿瘤医院肿瘤研究所。
1.2 实验材料实验用DEN(美国Sigma公司);全自动生化分析仪(AU5821系列,美国贝克曼公司);实验室Odyssey双色的红外荧光扫描系统(美国GENE公司);兔抗大鼠DBP(sc-365167)、β-actin(sc-47778)、STAT3(sc-482)、p-STAT3(sc-135649)、Akt(sc-8312)、p-Akt(sc-7985)、MEK(sc-9259)、p-MEK(sc-101733)、ERK(sc-292838)和p-ERK(sc-23759);兔抗人cyclin D1(2922S)、PCNA(13110),单克隆抗体购于美国Santa公司;山羊抗兔的二抗SP免疫组织化学试剂盒(SP-9000)以及DAB显色液(北京中杉金桥生物技术有限公司);大鼠总RNA的提取、cDNA的合成以及反转录-聚合酶链式反应(qRT-PCR)扩增试剂盒(美国Invitrogen公司);DBP质粒(本实验室保存);小干扰RNA(siRNA),siDBP引物:上游:5′-GUACCUUUGUAUUUGAGGAdTdT-3′,下游:5′-UCCUCAAAUACAAAGGUACdTdT-3′,siNC引物:上游:5′-UUCUCCGAACGUGUCACGUTT-3′,下游:5′-ACGUGACACGUUCGGAGAATT-3′(上海生物工程技术公司);Lipofectamine 2000TM转染试剂(美国Invitrogen公司);BrdU试剂盒(德国Merck公司)。
1.3 实验方法 1.3.1 大鼠的造模构建雄性SD大鼠先适应性喂养1周,随机分为2组,正常对照组(NC组)8只、肝癌模型组(HCC组)14只,肝癌模型组给予腹腔注射造模,剂量为DEN 70毫克/千克,同时正常对照组用同等剂量的0.9%氯化钠溶液进行腹腔注射。1次/周,接连10周注射,继续喂养10周,第20周时将大鼠麻醉后心脏穿刺放血处死,立即手术,取出肝脏,0.9%氯化钠溶液冲洗,取一部分肝组织浸泡于10%福尔马林溶液,用于形态学实验;余下的组织迅速放入液氮中,-80℃冰箱保存。模型成功率为100%。
1.3.2 组织病理学观察提取模型组及正常对照组肝组织,4%的多聚甲醛进行组织固定,石蜡包埋,切片,采用苏木精-伊红(HE)染色和免疫组织化学法进行染色,显微镜下观察和分析肝脏组织的病理和形态。
1.3.3 大鼠的肝功能等生化指标检测大鼠处死前采集血清样本约200 μl,离心后置生化检测仪上进行各项指标的检测。
1.3.4 Western blot分析实验大鼠肝脏组织经过蛋白提取、蛋白定量后匀浆稀释成5 μg/μl浓度的悬液,加5×上样缓冲液95℃煮沸5 min。制作SDS-PAGE,蛋白上样,凝胶电泳,转膜,5%脱脂奶粉封闭PVDF膜,分别加兔抗大鼠DBP、STAT3、p-STAT3、Akt、p-Akt、MEK、p-MEK、ERK和p-ERK抗体(1:500)及兔抗大鼠β-actin抗体(1:1 000),4℃冰箱过夜温育,TPBS洗膜,荧光二抗进行室温静置孵育1 h(1:5 000),TBST洗膜2次,每次约10 min,最后Odyssey发光仪进行扫描。上述每组实验至少重复3次,将孵育后的膜用发光成像仪扫描后形成照片,然后IAMGE J软件进行灰度值分析。
1.3.5 免疫组织化学分析石蜡切片后经过常规脱蜡复水及抗原修复,山羊血清封闭,DBP一抗处理后放于保湿盒4℃孵育过夜。室温滴加山羊抗兔二抗孵育20 min,PBS冲洗玻片,然后加入链霉亲和素孵育20 min,PBS再次冲洗玻片,DAB显色,苏木精对比染色,结果中的阳性细胞显色应为棕色或棕黄色,阳性颗粒应定位在细胞的胞核及胞质区域。在奥林巴斯正置显微镜下进行观察和图像采集。利用Image-Pro Plus 6.0(IPP 6.0)软件对图片的积分光密度值(IOD)进行检测和分析。
1.3.6 qRT-PCR检测提取总RNA进行反转录,目的片段扩增。扩增引物设计如下:18SrRNA引物:上游:5’-ATCCCTGAAAAGTTCCAGCA-3;下游:5’-CCCTCTTGGTGAGGTCAATG-3’,DBP引物:上游:5’-TTGGGCCGAGCCTATGC-3’;下游:5’-CCCCTCCCAAATCATTCACA-3’,cyclin D1引物:上游:5’-GGAGCAGAAGTGCGAAGA -3’;下游:5’-GGGTGGGTTGGAAATGAA-3’,PCNA引物:上游:5’- ACAGAGCATGGATTCGTCTCAC-3’;下游:5’-AGAAAACTTCACCCCGTCCTTT-3’。
1.3.7 细胞转染HepG2细胞以5×106个每毫升的密度接种在96孔板中,放置于37℃、5%CO2条件下培养24 h,待到细胞生长到融合度70%左右时进行细胞转染。首先按照转染试剂的说明将空载体质粒(Empty)、过表达质粒(DBP)、对照小干扰RNA(siNC)、目的小干扰RNA(siDBP)分别溶于双无(无血清无抗生素)RPMI1640培养液中,混匀。将Lipofectamine 2000TM溶于双无RPMI1640培养液中,混匀,室温中静置5 min。将转染试剂分别与脂质体混匀,室温静置20 min。弃培养基,用新鲜双无RPMI1640培养基洗涤细胞两次,将各组脂质体和质粒混合液滴入各孔细胞中,37℃培养箱培养。6 h之后弃培养基,更换含10%胎牛血清的RPMI1640培养基,继续培养48 h用于后续实验操作。
1.3.8 BrdU掺入实验按照BrdU试剂盒说明书进行操作。将孔板中的培养基去除,加入BrdU试剂孵育20 h。每孔加入固定液200 μl,固定30 min;每孔加入1:50稀释的缓冲液200 μl,洗三次;BrdU抗体100 μl每孔,室温孵育1 h;1:50稀释的缓冲液200 μl每孔,洗三次;每孔加入1:2 000稀释的过氧化物酶偶联羊抗小鼠二抗100 μl,室温孵育30 min;1:50稀释的缓冲液200 μl,洗三次, 蒸馏水200 μl,洗一次;100 μl TMB标记的过氧化物酶底物室温避光孵育30 min;每孔加入100 μl终止液终止反应。酶标仪在450 nm处读取吸光度值。
1.4 统计学方法采用SPSS17.0统计软件进行汇总分析。其中计量的数据采用均数±标准差(x±s)表示, 统计方法应用t检验。检测指标的统计相关性采用Pearson分析方法。P < 0.05为差异有统计学意义。
2 结果 2.1 HCC大鼠肝脏组织病理形态及生化指标变化大鼠肝脏组织照片可见,HCC组肝脏有严重的多发结节和肝硬化,见图 1A。通过HE方法染色,显微镜下观察可发现,NC组肝细胞无异常,胞核核仁明显,核膜清楚,细胞没有炎性浸润,然而肝癌组的出现了细胞变性、坏死,并且可见肝细胞恶性改变,癌细胞呈现显著异型性,形态表现多角型,胞核增大且染色较深,见图 1B,分化程度3级。
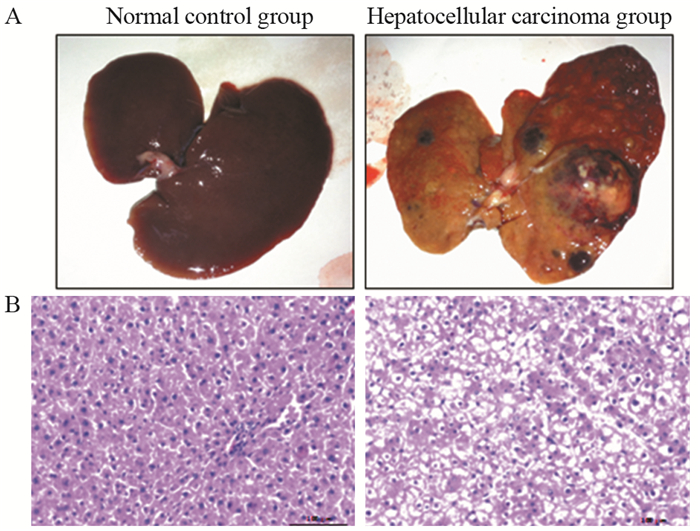
|
| 图 1 大鼠肝脏组织形体(A)及病理学图片(B ×200) Figure 1 Pictures of rat liver tissues(A) and HE staining results(B ×200) |
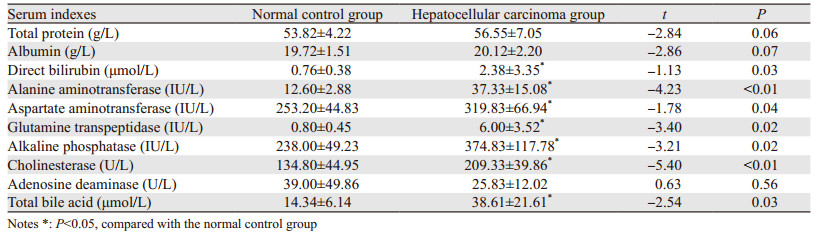
HCC组与NC组比较,血清的总胆红素、丙氨酸氨基转移酶、谷氨酰胺转肽酶、碱性磷酸酶、胆碱酯酶还有总胆汁酸都显著升高,证明HCC组大鼠肝脏功能呈恶化趋势,见表 1。
|
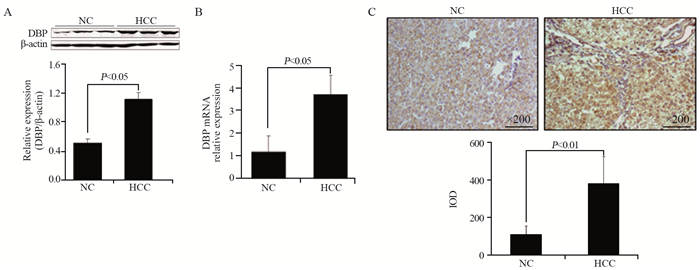
HCC组大鼠肝组织中DBP的蛋白和mRNA表达量都显著高于NC组,见图 2A~B。免疫组织化学检测显示,NC组内偶见DBP强阳性的细胞,HCC组阳性细胞数及单细胞染色强度均较NC组增高,见图 2C。以上结果表明,DBP在大鼠肝癌组织中表达增加。
|
| NC: normal control; HCC: hepatocellular carcinoma 图 2 Western blot(A)、qRT-PCR(B)和IHC(C)法检测肝细胞癌大鼠肝脏DBP的表达 Figure 2 DBP expression was increased in rats with HCC detected by Western blot(A), RT-PCR(B) and IHC(C) |
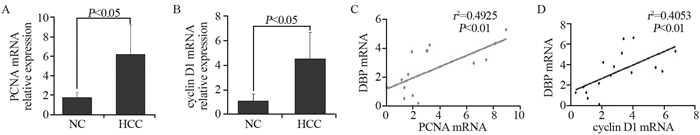
qRT-PCR结果显示,肝癌组PCNA、Cyclin D1 mRNA的表达水平显著高于正常对照组,见图 3A~B。Pearson相关性分析检验结果显示,DBP与PCNA mRNA(r2=0.4925, P < 0.01)、cyclin D1 mRNA(r2=0.4053, P < 0.01)的表达量呈正相关,见图 3C~D。说明HCC组大鼠肝脏组织中的DBP表达水平升高很可能与肿瘤细胞增殖相关。
|
| 图 3 HCC大鼠肝脏组织中增殖相关基因表达与DBP表达呈正相关 Figure 3 DBP expression was positively correlated with expression of cyclin D1 and PCNA mRNA in HCC rats liver tissues |
实验结果显示DBP过表达能增加细胞的数量,cyclin D1和PCNA的蛋白表达增强,见图 4A、4C。相反,通过siRNA敲低了DBP的表达,细胞数量则显著降低,cyclin D1和PCNA的蛋白表达减弱,见图 4B、4D。结果表明,DBP过表达能够直接促进HepG2细胞的增殖。
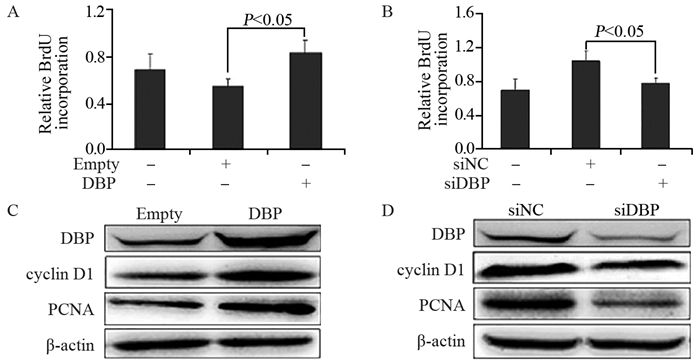
|
| 图 4 DBP促进肝癌细胞增殖和增殖基因的表达 Figure 4 DBP promoted proliferation of hepatoma cells and expression of proliferation genes detected by BrdU incorporation and Western blot |
Western blot结果显示,HCC组大鼠肝脏组织STAT3磷酸化显著增加,见图 5A,表明DBP对STAT3激活有促进作用。免疫组织化学结果显示,HCC组大鼠肝脏组织中的p-STAT3和DBP的蛋白表达水平明显增加,见图 5B。Pearson相关性分析表明,在HCC组大鼠肝组织中,p-STAT3与DBP的表达水平呈正相关(r2=0.6359, P < 0.01)。说明大鼠肝癌组织中DBP过表达促进STAT3的活化,进一步引起肝癌细胞增殖基因的上调,从而加剧了肝癌的发展进程。
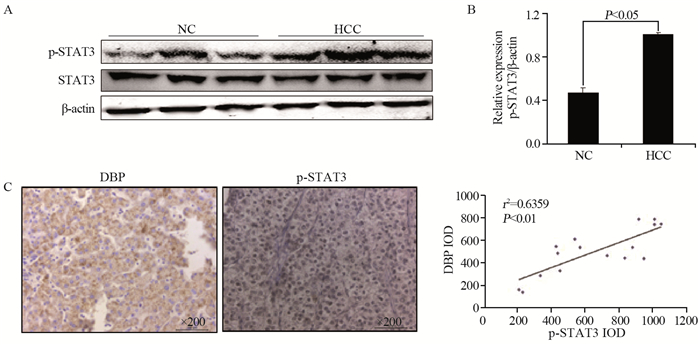
|
| 图 5 Western blot(A)和IHC(B)法检测DBP表达增加STAT3活性 Figure 5 DBP expression increased STAT3 activity detected by Western blot(A) and IHC(B) |
Western blot结果显示,肝癌组大鼠肝脏标本Akt、MEK以及ERK的磷酸化水平较NC组显著增强,见图 6,证明DBP通过Akt和ERK信号通路促进STAT3的激活,进一步增强肝癌细胞的增殖,从而加剧肝癌的进程。
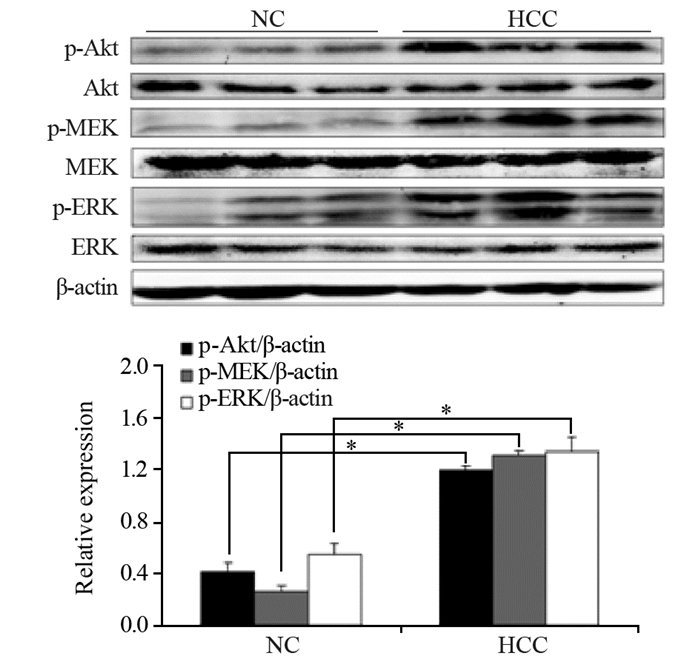
|
| *: P < 0.05; Western blot was used to detect the expression of p-Akt, p-MEK and p-ERK (n=3) 图 6 HCC大鼠通过激活Akt和ERK信号通路促进STAT3的活化 Figure 6 STAT3 activation was promoted by activating Akt and ERK signaling pathways in HCC rats |
目前,生物治疗HCC的新模式受到了更多的关注,其中基因治疗和靶向治疗已经得到了一定的临床肯定[7],因此对于肝癌的基础性研究显得尤为重要。DEN作为一种肝毒性很强的化学剂,对于肝脏的损害导致肿瘤的过程分为炎性反应形成期、细胞增殖期、细胞硬化期和肿瘤形成期,这和人体肝癌的形成、发展以及恶化的过程几乎是一样的,因此DEN诱导和干预动物模型经常用来做肝细胞癌的有关实验研究[8]。在本研究中,肝脏标本组织的病理形态学观察结果证明,DEN成功地诱导出了大鼠肝癌的组织模型,而且癌症恶化程度十分明显。
DBP是组织细胞的过氧化物酶体细胞器极其重要的一种氧化还原酶。正常生理条件下,DBP在哺乳动物的肝脏、心脏、脑、前列腺等组织表达较高[4-5]。有报道显示DBP是过氧化物酶体脂肪酸β氧化途径中的一种重要的酶蛋白,参与脂肪酸的氧化分解及DHA的生物合成等过程,并与雌激素的代谢有关[9]。近年来,在除肝癌以外的其他肿瘤细胞和肿瘤组织中也发现DBP异常升高[10],说明在肿瘤的发生和发展过程中DBP的表达水平可能发挥着重要作用。我们前期的研究结果已经证实,在肝癌细胞系HepG2中,DBP作为受核转录因子NF-κB调控的靶基因,与促进肿瘤细胞增殖相关基因的表达有密切关系和作用[6]。本实验首次以大鼠HCC模型探讨了DBP在正常和肝癌组织的表达差异,以及DBP表达与促肿瘤增殖的正相关性,在整体水平上证明了DBP在HCC的发生发展过程中起到了至关重要的作用。
本实验检测了STAT3这种促肝脏肿瘤形成的核转录因子,通过介导细胞功能而促进HCC的发展。STAT3作为一种重要的核转录因子,被磷酸化激活后发生核转位,以二聚体的形式结合在特异性增强子核苷酸序列上,作为一种转录因子以发挥促进靶基因表达的作用。这些下游靶基因中有许多与肿瘤的发生发展密切相关。STAT3通过上调肿瘤相关基因的表达促进肿瘤细胞的增殖。最近关于STAT3促进肝癌发展的研究也进一步证明了STAT3信号通路激活在肿瘤发病机制中的重要作用[11-12]。
然而,DBP又是如何上调了PCNA和cyclinD1等促肿瘤细胞增殖基因的表达呢?STAT3在肝癌细胞中被激活的程度较高,而且许多信号通路都参与了STAT3的活化。信号通路MEK/ERK和Akt的激活涉及肝癌细胞的增殖,它们的活化都可以促进STAT3的激活,从而引起促增殖基因的表达增加[9-11]。研究证实MEK/ERK/STAT3和AKT/STAT3在促进肝癌细胞增殖过程中发挥了重要作用。PCNA和cyclinD1是此信号通路下游促进肝癌细胞增殖的重要基因。我们的前期研究结果在细胞中表明DBP的上调介导了AKT和MEK/ERK信号通路的活化,进而促进了STAT3的激活,二者存在相关性[6]。近期有研究发现,在肝癌细胞中过表达DBP同样能够促进STAT3的活化,同时也表明STAT3高表达促进肝癌细胞增殖[13-14]。因此,我们推测在HCC形成及恶化的过程中,DBP通过介导STAT3的活化促进其下游众多涉及肿瘤细胞增殖的靶基因表达增加,从而发挥促进HCC的功能。
本实验通过构建大鼠HCC模型,在整体水平上研究了DBP通过介导AKT和MEK/ERK信号通路促进了STAT3的激活,进一步增强了促增殖基因的表达,进而促进HCC的发生发展,为DBP作为HCC诊断和治疗的新靶点提供了理论基础。
作者贡献
路欣、孔令玉:样本收集与筛选,数据处理和统计学分析,文章执笔
贾蕾:研究结果评估
姜玲玲:研究设计,文章修改与审校
| [1] | Long J, Lin J, Wang A, et al. PD-1/PD-L blockade in gastrointestinalcancers:lessons learned and the road toward precision immunotherapy[J]. J Hematol Oncol, 2017, 10(1): 146–167. |
| [2] | Attia YM, Tawfiq RA, Ali AA, et al. The FXR agonist, obeticholic acid, suppresses HCC proliferation & metastasis: role of IL-6/STAT3 signalling pathway[J]. Sci Rep, 2017, 7(1): 12502–12514. DOI:10.1038/s41598-017-12629-4 |
| [3] | Moeller G, Adamski J. Multifunctionality of human 17beta-hydroxysteroid dehydrogenases[J]. Mol Cell Endocrinol, 2006, 248(1/2): 47–55. |
| [4] | Amor DJ, Marsh AP, Storey E, et al. Heterozygous mutations in HSD17B4 cause juvenile peroxisomal D-bifunctional protein deficiency[J]. Neurol Genet, 2016, 2(6): e114–e122. DOI:10.1212/NXG.0000000000000114 |
| [5] | Maleki J, Nourbakhsh M, Shabani M, et al. 17beta-Estradiol Stimulates Generation of Reactive Species Oxygen and Nitric Oxide in Ovarian Adenocarcinoma Cells (OVCAR 3)[J]. Iran J Cancer Prev, 2015, 8(3): e2332–e2338. |
| [6] | Lu X, Ma PP, Shi Y, et al. NF-κB increased expression of 17β-hydroxysteroid dehydrogenase 4 promotes HepG2 proliferation via inactivating estradiol[J]. Mol Cell Endocrinol, 2015, 401(11): 1–11. |
| [7] | 中华人民共和国国家卫生和计划生育委员会. 原发性肝癌诊疗规范(2017年版)[J]. 临床肝胆病杂志, 2017, 33(8): 1419–1431. [ National Health and Family Planning Commission of the People's Republic of China. Diagnosis, management, and treament of hepatocellular carcinoma (V2017)[J]. Lin Chuang Gan Dan Bing Za Zhi, 2017, 33(8): 1419–1431. DOI:10.3969/j.issn.1001-5256.2017.08.003 ] |
| [8] | De Minicis S, Kissleva T, Francis H, et al. Liver carcinogenesis: Rodent models of hepatocarcinoma and cholangiocarcinoma[J]. Dig Lver Dis, 2013, 45(6): 450–459. DOI:10.1016/j.dld.2012.10.008 |
| [9] | Van Veldhoven PP, Casteels M, Mannaerts GP, et al. Further insights into peroxisomal lipid breakdown via alpha- and beta-oxidation[J]. Biochem Soc Trans, 2001, 29(Pt 2): 292–298. |
| [10] | Zhang YE, Xu YY, Yao CB, et al. Acetylation targets HSD17B4 for degradation via the CMA pathway in response to estrone[J]. Autophagy, 2017, 13(3): 538–553. DOI:10.1080/15548627.2016.1268302 |
| [11] | Zhao J, O'Neil M, Vittal A, et al. PRMT1-dependent macrophage IL-6 production is required for alcohol-induced HCC progression[J]. Gene Expr, 2018, 19(2): 137–150. |
| [12] | Yin ZI, Ma T, Ye L, et al. IL-6/STAT3 pathway intermediates M1/M2 macrophage polarization during the development of hepatocellular carcinoma[J]. J Cell Biochem, 2018, 119(11): 9419–9432. DOI:10.1002/jcb.27259 |
| [13] | 陈建新, 吴依芬, 李树基, 等. 10-姜酚通过Src/STAT3信号通路抑制肝癌HepG2细胞增殖[J]. 南方医科大学学报, 2018, 38(8): 1002–1007. [ Chen JX, Wu YF, Li SJ, et al. 10-gingerol inhibits proliferation of hepatocellular carcinoma HepG2 cells via Src/STAT3 signaling pathway[J]. Nan Fang Yi Ke Da Xue Xue Bao, 2018, 38(8): 1002–1007. ] |
| [14] | Zhang X, Zhang SL, Sun QT, et al. Compound K induces endoplasmic reticulum stress and apoptosis in human liver cancer cells by regulating STAT3[J]. Molecules, 2018, 23(6): pii:E1482. DOI:10.3390/molecules23061482 |
 2019, Vol. 46
2019, Vol. 46


