文章信息
- 拉帕替尼联合顺铂抗食管鳞癌的作用及机制
- Antitumor Efficacy and Mechanisms of Lapatinib in Combination with Cisplatin on Esophageal Squamous Cancer Cells
- 肿瘤防治研究, 2019, 46(9): 766-772
- Cancer Research on Prevention and Treatment, 2019, 46(9): 766-772
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.19.0150
- 收稿日期: 2019-02-13
- 修回日期: 2019-05-20
2. 453003 新乡,新乡医学院医学检验学院免疫学检验教研室;
3. 453003 新乡,河南省分子诊断与医学检验技术协同创新中心
2. Department of Laboratory Immunology, School of Laboratory Medicine, Xinxiang Medical University, Xinxiang 453003, China;
3. He'nan Innovation Center of Molecular Diagnosis and Laboratory Medicine, Xinxiang 453003, China
食管癌是常见的恶性肿瘤,我国食管癌的发病率居全球之首,近一半的食管癌患者都在我国,尤其是食管鳞癌[1-2]。近几年食管癌的综合治疗虽已取得较大进展,但患者的5年生存率并没有大幅提高,仍徘徊在15%~25%[3]。随着肿瘤分子生物学机制的深入研究,靶向治疗已成为不少恶性肿瘤的一种主要治疗手段。多种靶向药物在食管癌亦开展了大型临床研究,但获得临床疗效的药物非常少,目前仅有曲妥珠单抗和雷莫芦单抗显示出一定的疗效,被批准用于胃-食管交界癌和胃癌的治疗[4-6]。研究显示,表皮生长因子受体(epidermal growth factor receptor, EGFR)和HER2在食管癌中过表达,EGFR的过表达率在50%~71%,其过表达与肿瘤侵袭性增加、较低的分化类型以及更差的预后密切相关[7]。HER2在食管癌中的过表达率为22.1%,在胃癌中约为21.4%,在食管-胃连接部肿瘤中这一比例为32.2%[8]。多项研究也证实了HER2过表达与侵袭深度的增加、淋巴结和远处器官转移增加以及总生存率降低之间密切相关[9]。此外,食管癌患者中还发现了EGFR和HER2存在共同过表达的现象[10],因此,同时抑制EGFR和HER2对于食管癌的治疗可能是一种更为有效的方法。
拉帕替尼(lapatinib)是一种以EGFR和HER2为靶点的小分子酪氨酸激酶抑制剂。2007年美国FDA批准拉帕替尼联合卡培他滨用于HER2阳性乳腺癌的治疗[11]。目前,拉帕替尼还未被批准用于食管癌的临床治疗,因此本研究探讨拉帕替尼单独及与顺铂联合使用是否在抗食管癌活性方面发挥协同效应,并探讨二者联合作用的机制,从而为下一步拉帕替尼和化疗药物联合用于食管癌患者的临床试验提供必要的数据。
1 材料与方法 1.1 材料 1.1.1 细胞系及培养方法人食管鳞癌细胞系KYSE150和EC9706由中国医学科学院医药生物技术研究所甄永苏院士惠赠,本实验室保存传代。采用添加有10%胎牛血清(Gibco, 美国)的RPMI 1640培养基(Gibco, 美国),置于37℃、5%CO2培养箱中进行培养。
1.1.2 试剂和抗体Lapatinib(GW572016)购自MedChem Express公司(MCE, 美国),用二甲基亚砜(Dimethyl sulfoxide, DMSO)溶解配制成10 mmol/L的母液。顺铂(5 mg/ml)购自山东齐鲁制药有限公司,在使用之前用细胞培养液稀释。MTT溶液购自美国Sigma公司,细胞周期检测试剂盒和Annexin V-FITC/PI双染细胞凋亡试剂盒为碧云天生物技术公司产品(中国江苏)。所有抗体,包括一抗(磷酸化和非磷酸化的EGFR、HER2、p42/44MAPK(ERK)、AKT、p38MAPK、JNK、β-actin兔抗人单克隆抗体)以及HRP标记的羊抗兔IgG二抗均为Cell Signaling Technology公司(美国)产品。
1.2 方法 1.2.1 MTT实验MTT实验用于检测拉帕替尼、顺铂单独及二者联合对食管鳞癌细胞系的增殖抑制作用。EC9706和KYSE150细胞以每孔2 000个的密度接种至96孔板中,培养24 h后加入不同浓度的拉帕替尼、顺铂及二者联合处理48 h。每孔中加入MTT溶液(5 mg/ml)20 μl,并在37℃继续孵育4 h。吸弃各孔培养液,每孔加入150 μl DMSO,振荡10 min以充分溶解甲瓒沉淀,酶标仪测定570 nm处的吸光值。细胞的存活率按照下述公式进行计算:细胞存活率=(药物处理孔吸光值-空白孔吸光值)/(未加药对照孔吸光值-空白孔吸光值)×100%。药物的IC50值采用Gradphad Prism 5软件进行计算,两药的联合作用指数(combination index, CI)根据Chou和Talalay的中效原理进行计算[12]。CI值< 1、=1和 > 1分别表示两药之间存在协同、相加和拮抗效应。
1.2.2 细胞周期检测EC9706和KYSE150细胞以每皿5×105个的密度接种至60 mm小皿中,培养24 h后更换新鲜培养液,并分别加入拉帕替尼(10 μmol/L)、顺铂(0.4 μg/ml)或拉帕替尼(10 μmol/L)+顺铂(0.4 μg/ml)处理48 h,对照组细胞加入0.5%DMSO进行处理。常规胰酶消化收集细胞(包括漂浮在培养液中的细胞),137 g离心5 min,弃上清液,细胞沉淀用PBS洗涤2次,之后每管加入1 ml预冷的70%乙醇于-20℃固定24 h。137 g离心5 min收集细胞沉淀,并用PBS洗涤2次。之后按照细胞周期染色每管加入500 μl染色缓冲液(碧云天生物技术公司)重悬细胞,并加入10 μl RNAase A和25 μl碘化丙啶(Propidium iodide, PI)的染色液于37℃避光染色30 min,流式细胞仪测定细胞的荧光强度,并用ModFit软件分析处于各周期的细胞比例。
1.2.3 细胞凋亡实验KYSE150和EC9706细胞以每孔1×105个的密度接种至6孔板中,37℃培养24 h后换新鲜培养液,分别加入拉帕替尼(10 μmol/L)、顺铂(0.4 μg/ml)或拉帕替尼(10 μmol/L)+顺铂(0.4 μg/ml)处理48 h,并设置只加0.5% DMSO的对照孔。按照试剂盒的操作说明(Annexin V-FITC细胞凋亡检测试剂盒,碧云天生物技术公司),常规胰酶消化收集细胞,PBS洗涤2次,重悬于500 μl结合缓冲液中,加入10 μl Annexin V-FITC和5 μl PI,室温避光染色15 min,流式细胞仪检测细胞荧光强度,计算凋亡细胞比例。
1.2.4 Western blot实验KYSE150和EC9706细胞以每皿1×106个的密度接种至100 mm培养皿中,37℃培养24 h后换新鲜培养液,分别加入拉帕替尼(10 μmol/L)、顺铂(0.4 μg/ml)或二者联合处理48 h,对照细胞加入0.5%DMSO进行处理。弃去培养液,细胞用冷PBS洗涤3次,细胞刮刀,转移至离心管中,137 g离心5 min。收集沉淀,加入含有1 mmol/L PMSF蛋白酶抑制剂的Western及IP细胞裂解液中(碧云天生物公司),置于冰上裂解30 min。4℃,10 000 g离心15 min,将上清液转移至新离心管中,采用BCA试剂盒进行总蛋白的定量(北京鼎国生物技术公司)。将30 μg的总蛋白进行煮沸变性后上样,进行10%SDS-PAGE电泳,电泳结束后采用电转法将蛋白转移至PVDF膜上(美国Millipore公司)。将膜置于5% BSA中室温封闭2 h,之后和1:1000稀释的一抗于4℃孵育过夜。将膜用TBST溶液洗涤3次,每次10 min。之后将膜与1:4000稀释的HRP标记羊抗兔二抗于室温孵育1 h,同样用TBST溶液洗膜3次,每次10 min。在膜上滴加适量的1:1混合的HRP底物溶液(Western Chemiluminescent HRP Substrate, 美国Millipore公司),之后放入凝胶成像仪中进行曝光,并拍照保存(Amersham Imager 600系统,VT, USA GE Healthcare公司)。
1.3 统计学方法所有的数据均来自于三次独立实验的结果,以平均数±标准差(x±s)表示。实验数据的统计采用Graphpad Prism 5软件进行,单因素方差分析(one-way ANOVA)和非配对的双尾t检验用于检验不同处理组之间是否有差异,P < 0.05为差异有统计学意义。
2 结果 2.1 拉帕替尼、顺铂单独及二者联合对食管鳞癌细胞增殖的影响我们前期研究结果显示,拉帕替尼以浓度依赖性的方式抑制食管癌细胞的增殖,其对KYSE150和EC9706细胞的IC50值分别为3.84 μmol/L和6.44 μmol/L[13],而且其IC50值的大小和细胞表面EGFR、HER2的表达水平之间并无相关性。顺铂对KYSE150和EC9706细胞也展现出了较强的杀伤活性,其对KYSE150和EC9706细胞的IC50值分别为4.03 μg/ml和1.05 μg/ml,见图 1A。当拉帕替尼和顺铂联合使用时,在0.05 μg/ml、0.1 μg/ml、0.2 μg/ml和0.4 μg/ml顺铂浓度下,对EC9706细胞的抑制率分别为(0.77±1.13)%、(10.09±0.44)%、(24.24±1.88)%和(35.55±5.87)%,对KYSE150细胞的抑制率分别为(0.35±0.22)%、(2.79±4.51)%、(11.05±7.44)%和(21.41±7.25)%。经统计检验,二者联合用药的抑制率与顺铂单用组相比差异有统计学意义,但与拉帕替尼单用组相比,在低浓度下(5 μmol/L)差异不显著,在其余浓度下差异显著,见图 1B。EC9706细胞也表现出了相同的实验结果。根据Chou-Talalay方法(中位药效法)[12]计算出拉帕替尼联合顺铂的联合作用指数(combination index, CI)在上述浓度下均 < 1,这表明二者之间存在着显著的协同作用效应,见图 1C。
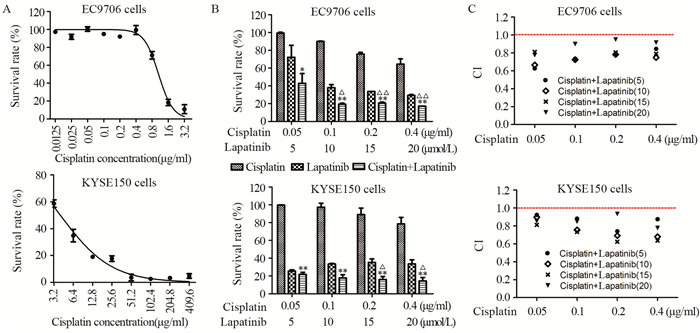
|
| A: the in vitro cytotoxicity of cisplatin against ESCC cell lines EC9706 and KYSE150 measured by MTT assay; B: the in vitro cytotoxicity of lapatinib, cisplatin and lapatinib plus cisplatin at indicated concentrations was measured by MTT assay; *: P < 0.05, compared with cisplatin group; **: P < 0.01, compared with cisplatin group; △: P < 0.05, compared with lapatinib group; △△: P < 0.01, compared with lapatinib group; C: the combination index (CI) values of lapatinib and cisplatin against ESCC cells EC9706 and KYSE150 were calculated using Chou-Talalay method. CI values < 1 indicated the synergistic effect between lapatinib and cisplatin 图 1 MTT法检测拉帕替尼、顺铂单独及联合应用对食管鳞癌细胞增殖的影响 Figure 1 Inhibitory effects of lapatinib, cisplatin and lapatinib plus cisplatin on proliferation of ESCC cells detected by MTT assay |
在KYSE150细胞中,与对照组相比,拉帕替尼单独处理可诱导细胞阻滞于G1期,差异有统计学意义(P < 0.0001),但顺铂单独处理后,KYSE150细胞却表现出了显著的G2/M期阻滞,G2期的比例增加了约58%,差异有统计学意义(P < 0.0001)。拉帕替尼和顺铂联合处理后,细胞也发生了显著的G2/M期阻滞(P=0.0008),但阻滞的程度显然不如顺铂单独处理组,见图 2A~B。在EC9706细胞中,拉帕替尼单独处理可显著降低G1期细胞的比例(与对照组相比P=0.028),顺铂单独处理可诱导显著的G2/M期阻滞(与对照组相比差异显著,P < 0.0001),而拉帕替尼和顺铂联合处理后,细胞的G2/M期阻滞现象更为显著(与对照组相比P < 0.0001,与顺铂组相比P=0.0024;与拉帕替尼组相比P=0.0001),见图 2A~B。
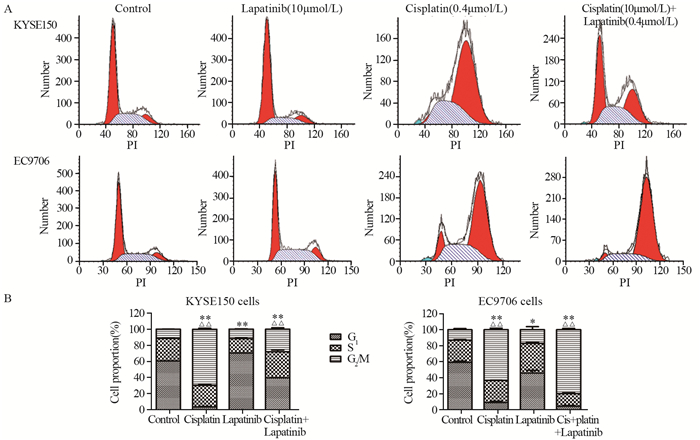
|
| A: KYSE150 cells or EC9706 cells were exposed to lapatinib, cisplatin or lapatinib plus cisplatin for 48h at the indicated concentrations and cell cycle distribution was determined by flow cytometry after PI staining; B: the rate of KYSE150 and EC9706 cells at G1, S and G2/M phases. *: P < 0.05, P < 0.01, cell rate at G1 phase vs. control group; △△: P < 0.01, cell rate at G2/M phase vs. control group 图 2 PI染色法结合流式细胞术检测拉帕替尼、顺铂单独及联合对食管鳞癌细胞周期的阻滞作用 Figure 2 Cell cycle distribution of KYSE150 and EC9706 cells after treatment with lapatinib, cisplatin and lapatinib plus cisplatin detected by PI staining and flow cytometry |
拉帕替尼和顺铂单独处理均可诱导KYSE150(拉帕替尼组与对照组相比P=0.0005;顺铂组与对照组相比P=0.0004)和EC9706细胞(拉帕替尼组与对照组相比P=0.0023;顺铂组与对照组相比P=0.0024)发生显著的凋亡,当二者联合时,细胞凋亡更为显著。拉帕替尼和顺铂单独处理组的KYSE150凋亡细胞比例分别为11.15%和13.53%,而二者联合处理组的凋亡比例上升到了36.05%,与任一单独处理组相比差异均有统计学意义(与拉帕替尼组相比P=0.0004;与顺铂组相比P=0.0005)。两种药物单独处理组的EC9706凋亡细胞比例分别为23.14%和20.38%,而联合用药组EC9706凋亡细胞的比例为26.88%(与拉帕替尼组相比P=0.0182;与顺铂组相比P=0.003),见图 3。这些数据表明拉帕替尼和顺铂联合使用增强了促凋亡效应。
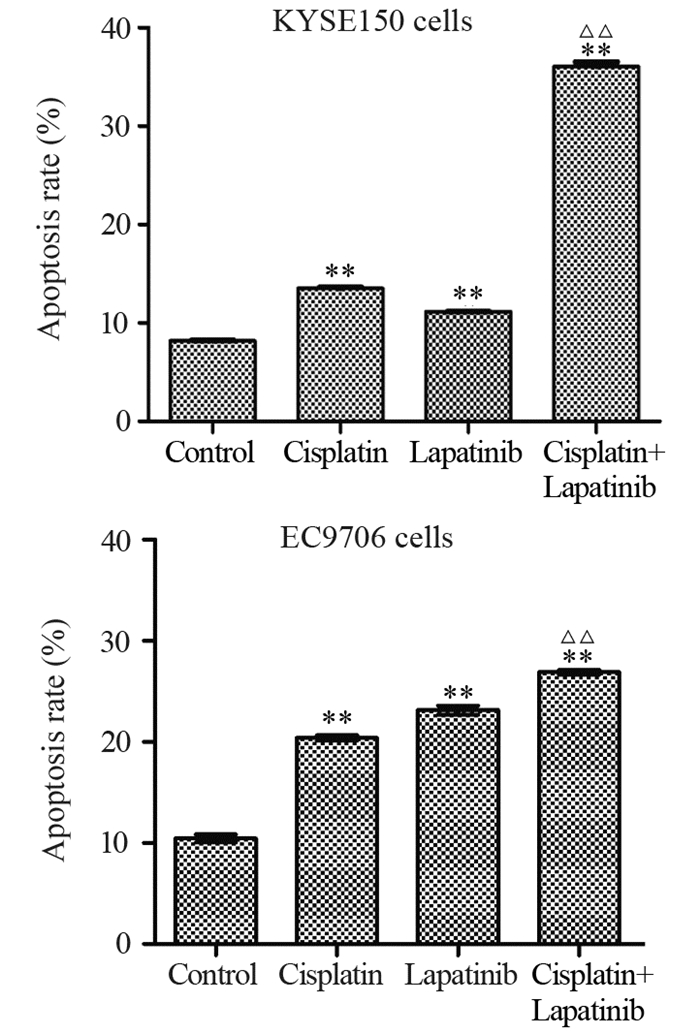
|
| **: P < 0.01, compared with Control group; △△: P < 0.01, compared with Lapatinib or Cisplatin group 图 3 Annexin V-FITC/PI双染法检测拉帕替尼、顺铂单独及联合应用对食管鳞癌细胞的凋亡诱导作用 Figure 3 Effects of lapatinib, cisplatin and lapatinib plus cisplatin on ESCC cell apoptosis analyzed by Annexin V-FITC/PI staining |
在KYSE150细胞中,拉帕替尼单独处理显著地降低了EGFR和HER2的磷酸化水平,和顺铂联合处理后,EGFR和HER2的磷酸化水平被进一步降低。拉帕替尼和顺铂单独处理同样可阻断EGFR和HER2介导的下游Ras/MAPK和PI3K/AKT的信号分子。细胞中AKT和ERK的磷酸化水平在拉帕替尼处理后显著下降,但是更为显著的抑制作用发生在拉帕替尼和顺铂联合处理组。但EGFR和HER2下游的另外两个信号分子p38MAPK和JNK的磷酸化水平并没有发生显著降低,见图 4。
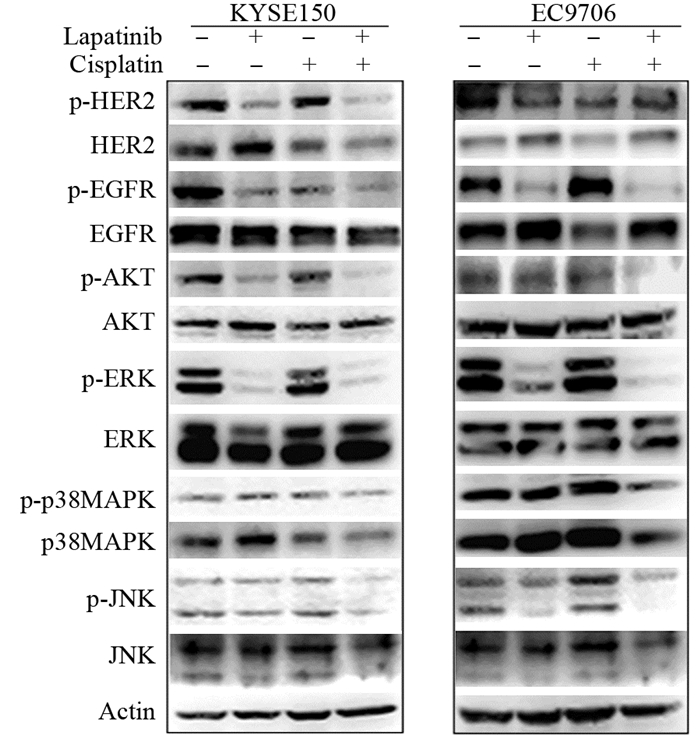
|
| The phosphorylation of HER2, EGFR, AKT, ERK, p38MAPK and JNK as well as their total expression levels after treatment with lapatinib, cisplatin and lapatinib plus cisplatin in KYSE150 cells or EC9706 cells were analyzed by Western blot 图 4 Western blot法检测拉帕替尼、顺铂单独及联合对食管鳞癌细胞EGFR和HER2信号转导通路的影响 Figure 4 Effects of lapatinib, cisplatin and lapatinib plus cisplatin on EGFR/HER2 signaling pathway in KYSE150 and EC9706 cells detected by Western blot |
在EC9706细胞中,拉帕替尼单独或与顺铂联合处理可导致磷酸化EGFR的下降,但磷酸化HER2水平并未发生改变。拉帕替尼单独处理对AKT的活化无影响,但是和顺铂联合后却可显著阻断AKT的活性。磷酸化ERK水平在拉帕替尼单独或联合顺铂处理后同样大幅降低。与KYSE150细胞不同,拉帕替尼和顺铂联合处理后,MAPK信号通路中的另两个分子p38MAPK和JNK的活化也受到了明显抑制,见图 4。这些结果表明,当拉帕替尼和顺铂联合使用时,其发挥抑制EGFR/ HER2信号通路的能力比单独使用进一步增强,这可能是二者联合发挥更强的抑制生长和促进凋亡作用的机制之一。
3 讨论尽管EGFR和HER2在食管癌中过量表达,且二者的过表达与患者生存期缩短、复发转移概率增加以及对放化疗的抵抗性密切相关[14],但多数EGFR和HER2靶向性药物,如西妥昔单抗(cetuximab)、吉非替尼(gefitinib)、埃罗替尼(erlotinib)等在针对食管癌、食管-胃连接部癌和胃癌的临床试验结果显示,靶向药物单独使用临床疗效有限,耐药性现象突出[15-17]。作为EGFR和HER2双重小分子抑制剂的拉帕替尼也表现出相同的结果[18-20]。但是当拉帕替尼和化疗药物联合使用时却表现出了增强的临床疗效[21-22]。在多项临床前研究中,拉帕替尼和顺铂、5-氟尿嘧啶、紫杉醇、卡培他滨等细胞毒药物联合使用对卵巢癌、头颈部肿瘤、膀胱癌等也显示出了协同抗肿瘤活性[23-25]。本研究结果显示拉帕替尼单用时可显著抑制KYSE150和EC9706细胞的增殖,这一结果和其他研究报道一致[26-27]。但是,拉帕替尼活性与EGFR或HER2的表达水平之间并没有相关性,这一现象在其他研究中也有报道[28],这表明细胞对拉帕替尼的敏感度并不完全取决于EGFR和HER2的表达水平,因此有必要对拉帕替尼敏感的预测标志物展开研究。当和顺铂联用时,在本实验所用的四个浓度下均表现出了协同效应。但是,当低浓度的拉帕替尼(如0.5 μmol/L)和高浓度的顺铂(如5 μg/ml)联用却表现出拮抗效应(数据扫描OSID码见附件)。这一结果表明酪氨酸激酶抑制剂和细胞毒性药物联用时,二者的浓度必须首先进行优化[29]。
在细胞周期试验中,拉帕替尼和顺铂单独处理对细胞周期分布有完全不同的影响,拉帕替尼将KYSE150细胞(EGFR和HER2均高表达)阻滞于G1期,而对EGFR和HER2低表达的EC9706细胞周期分布没有影响。而顺铂单独处理后,KYSE150细胞却被阻滞在了G2/M期。更有趣的是,当拉帕替尼和顺铂联合处理后,处于G2/M期的细胞比率显著增加,但是这一比率要远小于顺铂单独处理组G2/M期的细胞比率。出现这个结果的原因可能是由于拉帕替尼和顺铂对细胞周期分布存在不同效果,顺铂诱导的G2/M期阻滞部分被拉帕替尼所抵消,类似的结果也出现在gefitinib与化疗药物的联用中[30]。接下来我们研究了拉帕替尼和顺铂单独及联合对细胞凋亡及对EGFR/HER2信号通路活化的影响,结果显示二者联合可发挥更显著的促凋亡及抑制EGFR/HER2信号通路激活的作用。
综上所述,拉帕替尼与顺铂在抗食管癌体外作用上发挥协同效应,二者联用可发挥更显著的抑制细胞增殖和促进细胞凋亡的活性,这种协同作用的机制与二者阻断了EGFR和HER2的激活及下游的信号转导有关。这些结果提示,将EGFR/HER2靶向性药物与常规化疗药物联合使用可能是一个非常有前景的食管癌临床治疗策略,但二者联用应用于临床还需补充更多的数据,如检测二者联用在动物模型中的作用,以证实这种策略的有效性和在不良反应方面的优越性;另外,寻找可预测肿瘤细胞对拉帕替尼敏感度的表面标志物,有助于筛选从拉帕替尼与顺铂联合用药中获益的患者。
作者贡献
豆巧华:实验的实施和论文撰写
郭晓芳:实验设计和论文修改
朱小飞:实验的实施和数据分析
张月月、杨帆:实验的实施
| [1] | Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394–424. DOI:10.3322/caac.21492 |
| [2] | Chen W, Sun K, Zheng R, et al. Cancer incidence and mortality in China, 2014[J]. Chin J Cancer Res, 2018, 30(1): 1–12. DOI:10.21147/j.issn.1000-9604.2018.01.01 |
| [3] | Wang VE, Grandis JR, Ko AH. New strategies in esophageal carcinoma: translational insights from signaling pathway and immune checkpoints[J]. Clin Cancer Res, 2016, 22(17): 4283–4290. DOI:10.1158/1078-0432.CCR-16-0292 |
| [4] | Bang YJ, Van Cutsem E, Feyereislova A, et al. Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastroesophageal junction cancer (ToGA): a phase 3, open-label, randomized controlled trial[J]. Lancet, 2010, 376(9742): 687–697. DOI:10.1016/S0140-6736(10)61121-X |
| [5] | Fuchs CS, Tomasek J, Yong CJ, et al. Ramucirumab monotherapy for previously treated advanced gastric or gastro-oesophageal junction adenocarcinoma (REGARD): an international, randomised, multicentre, placebo-controlled, phase 3 trial[J]. Lancet, 2014, 383(9911): 31–39. DOI:10.1016/S0140-6736(13)61719-5 |
| [6] | Wilke H, Muro K, Van Cutsem E, et al. Ramucirumab plus paclitaxel versus placebo plus paclitaxel in patients with previously treated advanced gastric or gastro-oesophageal junction adenocarcinoma (RAINBOW): a double-blind, randomised phase 3 trial[J]. Lancet Oncol, 2014, 15(11): 1224–1235. DOI:10.1016/S1470-2045(14)70420-6 |
| [7] | Jia J, Cui Y, Lu M, et al. The relation of EGFR expression by immunohistochemical staining and clinical response of combination treatment of nimotuzumab and chemotherapy in esophageal squamous cell carcinoma[J]. Clin Transl Oncol, 2016, 18(6): 592–598. DOI:10.1007/s12094-015-1406-8 |
| [8] | Van Cutsem E, Bang YJ, Feng-Yi F, et al. HER2 screening data from ToGA: targeting HER2 in gastric and gastroesophageal junction cancer[J]. Gastric Cancer, 2015, 18(3): 476–484. DOI:10.1007/s10120-014-0402-y |
| [9] | Gerson JN, Skariah S, Denlinger CS, et al. Perspectives of HER2-targeting in gastric and esophageal cancer[J]. Expert Opin Investig Drugs, 2017, 26(5): 531–540. DOI:10.1080/13543784.2017.1315406 |
| [10] | Kawaguchi Y, Kona K, Mimura K, et al. Targeting EGFR and HER-2 with Cetuximab- and trastuzumab-mediated immunotherapy in esophageal squamous cell carcinoma[J]. Br J Cancer, 2007, 97(4): 494–501. DOI:10.1038/sj.bjc.6603885 |
| [11] | Geyer CE, Forster J, Lindquist D, et al. Lapatinib plus capecitabine for HER2-posivite advanced breast cancer[J]. N Engl J Med, 2006, 355(26): 2733–2743. DOI:10.1056/NEJMoa064320 |
| [12] | 王士群, 朱宇珍, 郑学宝. Chou-Talalay在抗肿瘤联合用药中的研究应用概况[J]. 中国现代应用药学, 2013, 30(4): 449–453. [ Wang SQ, Zhu YZ, Zheng XB. Study and application of Chou-Talalay method for anti-tumor drug combination[J]. Zhongguo Xian Dai Ying Yong Yao Xue, 2013, 30(4): 449–453. ] |
| [13] | Guo XF, Zhu XF, Zhong GS, et al. Lapatinib, a dual inhibitor of EGFR and HER2, has synergistic effects with 5-fluorouracil on esophageal carcinoma[J]. Oncol Rep, 2012, 27(5): 1639–1645. |
| [14] | Fichter CD, Timme S, Braun JA, et al. EGFR, HER2 and HER3 dimerization patterns guide targeted inhibition in two histotypes of esophageal cancer[J]. Int J Cancer, 2014, 135(7): 1517–1530. DOI:10.1002/ijc.28771 |
| [15] | Suntharalingam M, Winter K, Ilson D, et al. Effect of the addition of cetuximab to paclitaxel, cisplatin, and radiation therapy for patients with esophageal cancer: the NRG oncology RTOG 0436 phase 3 randomized clinical trial[J]. JAMA Oncol, 2017, 3(11): 1520–1528. DOI:10.1001/jamaoncol.2017.1598 |
| [16] | Dutton SJ, Ferry DR, Blazeby JM, et al. Gefitinib for oesophageal cancer progressing after chemotherapy (COG): a phase 3, multicentre, double-blind, placebo-controlled randomised trial[J]. Lancet Oncol, 2014, 15(8): 894–904. DOI:10.1016/S1470-2045(14)70024-5 |
| [17] | Ilson DH, Kelsen D, Shah M, et al. A phase 2 trial of erlotinib in patients with previously treated squamous cell and adenocarcinoma of the esophagus[J]. Cancer, 2011, 117(7): 1409–1414. DOI:10.1002/cncr.25602 |
| [18] | Gomez HL, Doval DC, Chavez MA, et al. Efficacy and safety of lapatinib as first-line therapy for ErbB-2 amplified locally advanced or metastatic breast cancer[J]. J Clin Oncol, 2008, 26(18): 2999–3005. DOI:10.1200/JCO.2007.14.0590 |
| [19] | Powles T, Huddart RA, Elliott T, et al. Phase Ⅲ, double-blind, randomized trial that compared maintenance lapatinib versus placebo after first-line chemotherapy in patients with human epidermal growth factor receptor1/2-positive metastatic bladder cancer[J]. J Clin Oncol, 2017, 35(1): 48–55. DOI:10.1200/JCO.2015.66.3468 |
| [20] | Lorenzen S, Riera Knorrenschild J, Haag GM, et al. Lapatinib versus lapatinib plus capecitabine as second-line treatment in human epidermal growth factor receptor 2-amplified metastatic gastro-oesophageal cancer: a randomized phase Ⅱ trial of the Arbeitsgemeinschaft Internistische Oncologie[J]. Eur J Cancer, 2015, 51(5): 569–576. DOI:10.1016/j.ejca.2015.01.059 |
| [21] | Robidoux A, Tang G, Rastogi P, et al. Lapatinib as a component of neoadjuvant therapy for HER2-positive operable breast cancer (NSABP protocol B-41): an open-label, randomised phase 3 trial[J]. Lancet Oncol, 2013, 14(12): 1183–1192. DOI:10.1016/S1470-2045(13)70411-X |
| [22] | Thallinger C, Lang I, Kuhar CG, et al. Phase Ⅱ study on the efficacy and safety of Lapatinib administered beyond disease progression and combined with vinorelbine in HER-2/neu- positive advanced breast cancer: results of the CECOG LaVie trial[J]. BMC Cancer, 2016, 16: 121. DOI:10.1186/s12885-016-2171-y |
| [23] | Coley HM, Shotton CF, Ajose-Adeogun A, et al. Receptor tyrosine kinase (RTK) inhibition is effective in chemosensitising EGFR-expressing drug resistant human ovarian cancer cell lines when used in combination with cytotoxic agents[J]. Biochem Pharmacol, 2006, 72(8): 941–948. DOI:10.1016/j.bcp.2006.07.022 |
| [24] | Kondo N, Tsukuda M, Ishiguro Y, et al. Antitumor effects of lapatinib (GW572016), a dual inhibitor of EGFR and HER-2, in combination with cisplatin or paclitaxel on head and neck squamous cell carcinoma[J]. Oncol Rep, 2010, 23(4): 957–963. |
| [25] | MuHugh LA, Sayan AE, Mejlvang J, et al. Lapatinib, a dual inhibitor of ErbB-1/-2 receptors, enhances effects of combination chemotherapy in bladder cancer cells[J]. Int J Oncol, 2009, 34(4): 1155–1163. |
| [26] | Saito S, Morishima K, Ui T, et al. The role of HGF/MET and FGF/FGFR in fibroblast-derived growth stimulation and lapatinib-resistance of esophageal squamous cell carcinoma[J]. BMC Cancer, 2015, 15: 82. DOI:10.1186/s12885-015-1065-8 |
| [27] | Hou W, Qin X, Zhu X, et al. Lapatinib inhibits the growth of esophageal squamous cell carcinoma and synergistically interacts with 5-fluorouracil in patient-derived xenograft models[J]. Oncol Rep, 2013, 30(2): 707–714. |
| [28] | Rusnak DW, Alligood KJ, Mullin RJ, et al. Assessment of epidermal growth factor receptor (EGFR, ErbB1) and HER2 (ErbB2) protein expression levels and response to lapatinib (Tykerb, GW572016) in an expanded panel of human normal and tumor cell lines[J]. Cell Prolif, 2007, 40(4): 580–594. DOI:10.1111/j.1365-2184.2007.00455.x |
| [29] | Li XQ, Ouyang ZG, Zhang SH, et al. Synergistic inhibition of angiogenesis and glioma cell-induced angiogenesis by the combination of temozolomide and enediyne antibiotic lidamycin[J]. Cancer Biol Ther, 2014, 15(4): 398–408. DOI:10.4161/cbt.27626 |
| [30] | Van Schaeybroeck S, Kyula J, Kelly DM, et al. Chemotherapy-induced epidermal growth factor receptor activation determines response to combined gefitinib/chemotherapy treatment in non-small cell lung cancer cells[J]. Mol Cancer Ther, 2006, 5(5): 1154–1165. DOI:10.1158/1535-7163.MCT-05-0446 |
 2019, Vol. 46
2019, Vol. 46


