文章信息
- 食管癌高、低发区食管鳞癌患者生存及其影响因素分析
- Comparison of Survival Status and Related Risk Factors of Esophageal Squamous Cell Carcinoma Patients Between High- and Low-incidence Areas of ESCC
- 肿瘤防治研究, 2019, 46(9): 829-834
- Cancer Research on Prevention and Treatment, 2019, 46(9): 829-834
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.19.0139
- 收稿日期: 2019-02-11
- 修回日期: 2019-05-12
2. 457001 濮阳,濮阳市油田总医院肿瘤科;
3. 453003 新乡,新乡医学院第三附属医院胃肠科;
4. 456592 林州,林州市食管癌医院病理科;
5. 450051 郑州,郑州大学基础医学院病理学与病理生理学教研室;
6. 455000 安阳,安阳市肿瘤医院肿瘤防治办公室
2. Department of Oncology, Puyang Oilfield General Hospital, Puyang 457001, China;
3. Department of Gastroenterology, The Third Affiliated Hospital of Xinxiang Medical University, Xinxiang 453003, China;
4. Department of Pathology, Linzhou Esophageal Cancer Hospital, Linzhou 456592, China;
5. Department of Pathology and Pathophysiology, School of Basic Medicine Science, Zhengzhou University, Zhengzhou 450051, China;
6. Cancer Prevention and Treatment Office, Anyang Tumor Hospital, Anyang 455000, China
中国97%以上食管癌为食管鳞状细胞癌(简称食管鳞癌),显著的地域性分布差异(形成明显的高、低发区)[1-2]和家族聚集现象[3]是中国食管癌突出的流行病学特征,食管癌的发生、发展是环境和遗传因素交互作用的结果[3]。相关研究表明,相对于低发区,高发区患者暴露于环境危险因素程度和家族史阳性率均较高[3],同时环境中危险因素和家族史阳性可增高食管癌发病风险[4],高、低发区患者在环境和遗传因素方面显著不同。由于低发区食管癌发病率较低,患者相对较少,有关高、低发区患者的生存对比及其影响因素的研究比较少见。因此,我们通过分析来自高、低发区38 741例行食管鳞癌根治术患者的生存差异及其影响因素,进一步了解高、低发区患者的临床病理特征及其与生存的关系,对不同地区食管癌防控和治疗提供依据。
1 资料与方法 1.1 研究对象本研究采用回顾性队列研究方法,收集患者一般信息和临床诊疗信息,共纳入来自郑州大学第一附属医院河南省食管癌重点开放实验室50万例食管及贲门癌临床信息数据库(1973—2018年)中的38 741例食管鳞癌患者,共成功随访34 858例,随访成功率90.0%。病例纳入标准:(1)有详细籍贯和现住址;(2)行食管癌根治术治疗,术后病理证实为食管鳞癌;(3)病理信息齐全,家族史资料齐全。排除标准:(1)无详细地址;(2)术前或术后接受放疗、化疗或其他治疗;(3)术后病理证实合并其他恶性肿瘤;(4)病理信息不全;(5)无家族史资料。本研究收集的患者信息包括:性别、确诊年龄、地址、病理信息和家族史。
1.2 生存随访患者确诊时间是指经组织病理确诊为食管鳞癌的时间;生存期为确诊至死亡(终点事件)或末次随访(2018年8月)所经历的时间。随访起始时间为患者的病理确诊时间。通过电话、村医问询和入户调查等方式对患者进行生存随访;患者出院后第一年内每3月随访一次,第二年起每年随访一次。
1.3 临床病理信息核对补充根据患者住院病历记录,对患者临床病理信息进行核对补充,并依据2002年美国癌症联合会与国际抗癌联盟(AJCC-UICC)制定的第6版食管癌TNM分期标准,规范整理术后病理。
1.4 高、低发区划分标准高、低发区的划分依据《食管癌》一书,根据中国食管癌流行病学调查结果,调整年龄与死亡率,死亡率50/10万以上地区为高发区,其余为低发区[5]。
1.5 统计学方法采用SPSS21.0进行统计分析,采用卡方检验分析高、低发区食管鳞癌患者的临床病理特征分布差异;生存时间按年计算,采用Kaplan-Meier法绘制不同临床病理特征患者生存曲线并用Log rank进行检验。采用多因素Cox比例风险回归模型方法分析生存主要影响因素,检验水准α=0.05。
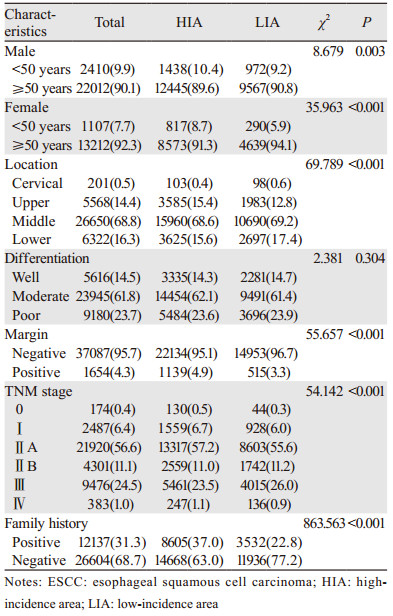
2 结果 2.1 高、低发区食管鳞癌患者临床病理特征分布38 741例食管鳞癌患者中,高发区患者23 273例(60.1%),低发区患者15 468例(39.9%),高发区所占比例远高于低发区(P < 0.001),高、低发区比例为1.5:1。高发区中男性13 883例,女性9 390例,平均诊断年龄分别为(59.9±8.2)岁和(60.6±8.1)岁;低发区中男性10 539例,女性4 929例,平均诊断年龄分别为(60.8±8.4)岁和(62.0±8.1)岁。
高、低发区患者中男、女比例分别为1.5:1和2.1:1,差异有统计学意义(P < 0.001),低发区男性患者所占比例高于高发区;高、低发区患者中诊断年龄≥50岁和 < 50岁比例分别为9.3:1和11.3:1,差异有统计学意义(P < 0.001),低发区诊断年龄≥50岁患者所占比例高于高发区;高、低发区患者的肿瘤部位分布有差异,但均以中段食管癌为主,下段和上段次之,颈段最少(P < 0.001)。高、低发区患者的肿瘤分化程度分布无差异(P=0.304);高发区患者的切缘阳性率高于低发区(4.9% vs. 3.3%,P < 0.001);高发区早期癌(0+Ⅰ期)患者所占比例高于低发区(7.2% vs. 6.3%, P < 0.001),而中晚期(Ⅱ+Ⅲ+Ⅳ期)患者所占比例低于低发区(92.8% vs. 93.7%, P < 0.001);高发区患者肿瘤家族史阳性率高于低发区(37.0% vs. 22.8%, P < 0.001),见表 1。高发区患者男、女性平均诊断年龄均明显早于低发区(均P < 0.001)。
|
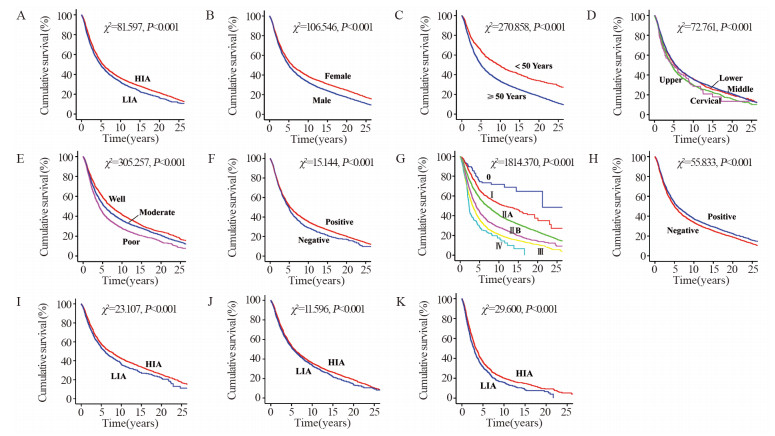
高发区患者生存优于低发区(P < 0.001),见图 1A;女性患者生存优于男性(P < 0.001),见图 1B;诊断年龄 < 50岁组患者生存优于≥50岁组(P < 0.001),见图 1C;中、下段患者的生存优于上、颈段(P < 0.001),见图 1D;分化程度越低,患者生存越差(P < 0.001),见图 1E;切缘阴性患者生存优于阳性(P < 0.001),见图 1F;TNM分期越高,患者生存越差(P < 0.001),见图 1G;肿瘤家族史阳性患者生存优于阴性(P < 0.001),见图 1H。说明高低发区、性别、年龄、肿瘤部位、分化程度、切缘状况、TNM分期和肿瘤家族史均影响食管鳞癌患者的生存。
|
| A: Area; B: Gender; C: age at diagnosis; D: tumor locations; E: differentiation; F: margin; G: TNM stage; H: family history; I: female stage Ⅱ ESCC patients ≥50 years old in HIA and LIA; J: male stage Ⅱ ESCC patients ≥50 years old in HIA and LIA; K: male stage Ⅲ ESCC patients ≥50 years old in HIA and LIA 图 1 不同临床特征食管鳞癌患者的生存曲线 Figure 1 Overall survival curves of ESCC patients with different clinical characteristics |
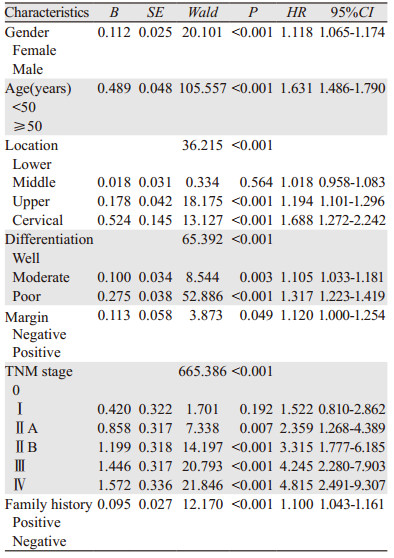
将34 858例患者的各项资料进行Cox分析,结果表明:高低发区、性别、确诊年龄、肿瘤部位、分化程度、TNM分期和肿瘤家族史均是影响患者生存的独立因素,见表 2。

|
同一性别、肿瘤部位、分化程度、切缘状况和家族史状况时,高发区患者生存均优于低发区(均P < 0.05);在≥50岁年龄组中,高发区患者生存优于低发区(P < 0.001),而 < 50岁年龄组中,高、低发区患者生存差异无统计学意义;同一TNM分期中,高发区ⅡA、ⅡB和Ⅲ期患者生存优于低发区(均P < 0.05),高发区Ⅰ期患者生存也优于低发期,但差异无统计学意义(P > 0.05),而在0和Ⅳ期生存均无差异,见表 3。

|
将高、低发区患者进一步进行性别、年龄和TNM分期的分层分析发现,当高、低发区患者在性别、年龄组和TNM分期均相同时,仅以下三组中,高发区患者生存优于低发区:女性、≥50岁的Ⅱ期患者(P < 0.001),见图 1I;男性、≥50岁的Ⅱ期患者(P=0.001),见图 1J;男性、≥50岁的Ⅲ期患者(P < 0.001),见图 1K。而其他同一性别、年龄组和TNM分期均相同时,高、低发区患者生存差异无统计学意义。
分别对高、低发区患者进行Cox分析,结果表明:在高发区,男性、诊断年龄≥50岁、肿瘤部位靠近上段、分化程度低、TNM分期高和肿瘤家族史阴性均是影响患者生存的独立危险因素,见表 4;在低发区,男性、诊断年龄≥50岁、肿瘤部位靠近颈段、分化程度低、切缘阳性、TNM分期高和肿瘤家族史阴性均是影响患者生存的独立危险因素,见表 5。

|
|
本研究发现,高发区食管鳞癌患者术后的总体生存明显优于低发区,考虑到不同临床病理特征对患者生存的影响,运用Cox分析后发现高发区患者生存仍然优于低发区,提示高、低发区可能是影响食管鳞癌患者生存的重要影响因素之一,其机制尚不明确。
性别是影响食管癌患者生存的重要影响因素之一,并且男性是患者预后差的独立危险因素[6-7]。本研究中低发区男性患者所占比例高于高发区,这可能是导致低发区患者整体生存较差的原因之一。
年龄是影响食管癌患者生存的又一重要影响因素,青年患者的生存优于老年患者[8],这可能与青年人自身体质较好、机体免疫功能较强和未合并其他老年性疾病有关。本研究中高发区诊断年龄 < 50岁的患者所占比例高于低发区,这可能是高发区患者整体生存较好的又一影响因素。
TNM分期是影响食管癌患者生存的重要影响因素之一,早期患者5年生存率可达90%,而中晚期患者5年生存率仅20%左右[1]。本研究中高发区早期患者所占比例高于低发区,而中晚期患者所占比例低于低发区。这可能与高发区人群对食管癌的认识逐渐提高、不良生活习惯的戒除、饮用水及饮食状况的改善、及早进行内镜检查和就诊以及我国政府在食管癌高发区的大力宣传和支持有关。肿瘤高发地区的防治工作实践已经证明,通过健康教育、危险因素干预以及有效的早诊早治等综合措施,可以有效地降低恶性肿瘤的发病率和死亡率、提高生存率[9]。高发区的现场研究也表明,长期膳食补充核黄素、维生素A和叶酸后,对食管癌有明显干预作用[10]。因此,这些也可能是高发区患者整体生存优于低发区的原因,同时提醒我们,应将高发区食管癌防控经验借鉴和推广到低发区。
本研究对高、低发区患者进行了性别、年龄组和TNM分期均相同的分层分析,高发区患者的生存仍优于低发区。食管癌的发生、发展是一个复杂的动态过程,受外界环境和遗传因素共同影响,有多种致癌和抑癌基因共同参与,受多种基因和蛋白的调控[11]。相关研究表明,疾病早期分子水平的改变要早于细胞和组织形态学的改变[12]。因此,进一步对高、低发区患者进行与肿瘤侵袭相关的基因变化和蛋白表达差异的研究可能有助于从分子水平揭示高发区患者生存优于低发区的现象。
Renz等[13]研究证实,长期的慢性心理压力可促进胰腺癌的发生、发展。对癌症患者进行心理治疗和负面情绪的干预调节,可改善患者对疾病的认识和生活的态度,对提高患者免疫功能和延长患者生存时间起到一定的作用[14]。高发区食管癌患者相对较多,并且有明显家族性聚集现象(家族史阳性率30%~40%)[3],相对于低发区患者,高发区患者有更多时间和机会了解食管癌,同时政府等相关部门在高发区进行的食管癌防控宣传也起到了一定作用,因而高发区患者的心理接受能力可能会更强一些,心理负担相对较小,从而进一步影响其生存。
本研究还发现,高发区男、女性患者的平均确诊年龄均早于低发区,这可能与高发区患者暴露于环境危险因素更多、作用时间更长有关。
国外研究表明,治疗医院的规模和治疗水平也显著影响食管癌患者的预后和生存[15]。由于本研究的患者来自于多中心的不同规模和级别的多家治疗医院,因而我们的研究在治疗医院规模和治疗水平方面的分析具有一定的局限性,这也正是我们研究组下一步要改进和完善的地方。
综上所述,高发区食管鳞癌患者整体生存优于低发区,低发区是影响食管鳞癌患者生存的独立危险因素之一,高、低发区中早期癌检出率均比较低。这些结果进一步提示加强人们对食管癌的防控意识、寻找简单快速和有效的高危人群早期筛查手段以及探索食管癌精准治疗的分子靶标是我们下一步研究要努力的方向。
作者贡献
胡守佳:文章撰写
范宗民:临床随访和数据采集
岳文彬:资料收集
陈培楠、李秀敏:英文修改
李吉林:病理资料核实和质量控制
韩少华、王伟、尹艳春:临床随访和数据采集
宋昕、赵学科:数据管理和分析
王建坡:资料收集
王立东:课题策划和设计
| [1] | Lagergren J, Smyth E, Cunningham D, et al. Oesophageal cancer[J]. Lancet, 2017, 390(10110): 2383–2396. DOI:10.1016/S0140-6736(17)31462-9 |
| [2] | Lin Y, Totsuka Y, Shan B, et al. Esophageal cancer in high-risk areas of China: research progress and challenges[J]. Ann Epidemiol, 2017, 27(3): 215–221. DOI:10.1016/j.annepidem.2016.11.004 |
| [3] | 王立东, 宋昕. 环境和遗传因素交互作用对食管癌发生的影响[J]. 郑州大学学报(医学版), 2011, 46(1): 1–4. [ Wang LD, Song X. Interaction of environmental and hereditary factors on human esophageal carcinogenesis[J]. Zhengzhou Da Xue Xue Bao (Yi Xue Ban), 2011, 46(1): 1–4. DOI:10.3969/j.issn.1671-6825.2011.01.001 ] |
| [4] | Song X, Li WQ, Hu N, et al. GWAS follow-up study of esophageal squamous cell carcinoma identifies potential genetic loci associated with family history of upper gastrointestinal cancer[J]. Sci Rep, 2017, 7(1): 4642. |
| [5] | 河南医学院. 食管癌[M]. 北京: 人民卫生出版社, 1983: 36. [ Henan Medical College. Esophageal cancer[M]. Beijing: People's Health Publishing House, 1983: 36. ] |
| [6] | 汤萨, 黄佳, 董金城, 等. 性别对高、低发区食管癌患者生存期的影响[J]. 肿瘤防治研究, 2014, 41(3): 203–208. [ Tang S, Huang J, Dong JC, et al. Effects of gender on survival of patients with esophageal cancer from high- and low-incidence areas[J]. Zhong Liu Fang Zhi Yan Jiu, 2014, 41(3): 203–208. DOI:10.3971/j.issn.1000-8578.2014.03.003 ] |
| [7] | Rowse PG, Jaroszewski DE, Thomas M, et al. Sex disparities after induction chemoradiotherapy and esophagogastrectomy for esophageal cancer[J]. Ann Thorac Surg, 2017, 104(4): 1147–1152. DOI:10.1016/j.athoracsur.2017.05.030 |
| [8] | Zeng Y, Ruan W, Liu J, et al. Esophageal cancer in patients under 50: a SEER analysis[J]. J Thorac Dis, 2018, 10(5): 2542–2550. DOI:10.21037/jtd.2018.05.72 |
| [9] | 陈万青. 从肿瘤登记数据看中国恶性肿瘤的发病特点和趋势[J]. 中华健康管理学杂志, 2016, 10(4): 249–252. [ Chen WQ. Discussion on the clinical characteristics and trends of cancers in China according to cancer registry data[J]. Zhonghua Jian Kang Guan Li Xue Za Zhi, 2016, 10(4): 249–252. DOI:10.3760/cma.j.issn.1674-0815.2016.04.001 ] |
| [10] | 王立东, 杜丹凤, 宋昕, 等. 食管癌"环境-遗传-基因互作"组学研究:核黄素、核黄素转运基因2和NOTCH1-P53-Rb互作关系[J]. 郑州大学学报(医学版), 2018, 53(1): 1–5. [ Wang LD, Du DF, Song X, et al. Study of environmental-genetics-gene interaction in esophageal cancer: interaction between riboflavin, riboflavin transporter 2 and NOTCH1-P53-Rb[J]. Zhengzhou Da Xue Xue Bao (Yi Xue Ban), 2018, 53(1): 1–5. ] |
| [11] | 蔡宁, 刘振球, 索晨, 等. 食管癌遗传易感基因多态性的研究进展[J]. 癌症进展, 2018, 16(11): 1331–1334. [ Cai N, Liu ZQ, Suo C, et al. The research progress of genetic susceptibility gene polymorphism in esophageal cancer[J]. Ai Zheng Jin Zhan, 2018, 16(11): 1331–1334. ] |
| [12] | 郭真真, 刘德祥, 梁锦发, 等. MRI扩散加权成像在非小细胞肺癌靶向治疗早期疗效评价中的应用价值[J]. 中华介入放射学电子杂志, 2016, 4(2): 100–104. [ Guo ZZ, Liu DX, Liang JF, et al. Value of diffusion weighted MRI imaging in early response to target therapy of non-small-cell lung cancer[J]. Zhonghua Jie Ru Fagn She Xue Dian Zi Za Zhi, 2016, 4(2): 100–104. DOI:10.3877/cma.j.issn.2095-5782.2016.02.010 ] |
| [13] | Renz BW, Takahashi R, Tanaka T, et al. β2 adrenergic-neurotrophin feedforward loop promotes pancreatic cancer[J]. Cancer Cell, 2018, 33(1): 75–90. DOI:10.1016/j.ccell.2017.11.007 |
| [14] | 叶圣昌, 刘敏. 癌症患者自我感受负担相关影响因素调查及支持性心理治疗效果[J]. 中国医药导报, 2018, 15(31): 176–180. [ Ye SC, Liu M. Related factors survey of self perceived burden of cancer patients and effect of supportive psychotherapy[J]. Zhongguo Yi Yao Dao Bao, 2018, 15(31): 176–180. ] |
| [15] | Speicher PJ, Englum BR, Ganapathi AM, et al. Traveling to a high-volume center is associated with improved survival for patients with esophageal cancer[J]. Ann Surg, 2017, 265(4): 743–749. DOI:10.1097/SLA.0000000000001702 |
 2019, Vol. 46
2019, Vol. 46


