文章信息
- S-1与卡培他滨或氟尿嘧啶治疗晚期结直肠癌的疗效对比Meta分析
- Comparison of Efficacy Between S-1 and Capecitabine/Fluorouracil on Advanced Colorectal Cancer: A Meta-analysis
- 肿瘤防治研究, 2019, 46(12): 1123-1130
- Cancer Research on Prevention and Treatment, 2019, 46(12): 1123-1130
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.19.0138
- 收稿日期: 2019-02-11
- 修回日期: 2019-07-23
2. 455000 安阳,河南科技大学第四附属医院肿瘤科
2. Department of Oncology, The Fourth Affiliated Hospital of He'nan University of Science and Technology, Anyang 455000, China
结直肠癌是消化系统常见的恶性肿瘤,其发病率逐年增加。晚期结直肠癌患者由于癌细胞转移浸润而失去手术机会,需行全身化疗。目前,氟尿嘧啶(5-Fu)仍是结直肠癌(colorectal cancer, CRC)治疗中最常用的药物,但其带来的不良反应难以控制[1-2]。随着医学的发展,口服氟尿嘧啶药物被研发,主要代表药物为卡培他滨和替吉奥(S-1);因其有着口服的便利性,可大大降低静脉输液的风险,而且在进行剂量的调整有着更好调控性,在胃肠道肿瘤的治疗中应用广泛[3-6]。S-1在前一代药物的基础上进行了改良,其主要成分为替加氟、吉美嘧啶和奥替拉西钾;其中替加氟可以转化为5-Fu,这是主要的抗肿瘤药物成分;吉美嘧啶可以抑制肝脏中5-Fu的分解,从而增加药物的体内浓度;奥替拉西钾可以减少药物对胃肠道的不良反应[7]。然而,在晚期结直肠癌的化疗指南中,尚未明确推荐使用S-1替代卡培他滨或氟尿嘧啶。并且,目前也没有较为严谨的Meta分析来支持S-1替代卡培他滨或氟尿嘧啶在晚期结直肠癌中的应用。因此,我们基于现有的文献数据对此进行了分析。
1 资料与方法 1.1 文献检索策略通过Cochrane Library、PubMed和Embase及临床试验中心网站搜索关键词:“colorectal cancer”或“colorectal tumor”、“tegafur”或“S-1”、“capecitabine”或“Xeloda”、“fluorouracil”或“5-Fu”。在CNKI中设置的关键词为:替吉奥或S-1、卡培他滨、氟尿嘧啶、结直肠癌或结直肠肿瘤。为了选择更多符合条件的文章进行Meta分析,将搜索范围设置为“随机对照试验”,不限制发布时间及来源等。
1.2 选择标准纳入标准:(1)试验组为S-1组合方案,对照组为卡培他滨或氟尿嘧啶组合方案,无其他化疗药物的不同;(2)所选患者经病理及影像学证实为晚期或局部复发结直肠肿瘤;(3)除去化疗方案的不同,其余辅助治疗无特殊影响。
排除标准:(1)没有疗效和安全性数据对比的Ⅰ期、Ⅱ期或者单组研究的临床试验;(2)有着重复患者的研究项目;(3)病例报告、摘要、综述、会议报告。(4)除去S-1对比卡培他滨或氟尿嘧啶的不同,还有其他化疗药物的临床研究;(5)新辅助化疗的对比分析。
1.3 统计学方法利用Review Manager 5.3进行数据分析和生成。异质性的判断利用Q统计量检验及I2检验,若Q统计量检验中的P < 0.1或I2 > 0则提示有异质性,若I2 > 50%则提示有异质性且不可接受,I2 < 50%则提示有异质性但可接受。如果出现异质性,则采用随机效应模型,并分析其异质性来源,否则使用固定效应模型。风险比(HR)用于无进展生存期(PFS)和总生存期(OS),疾病缓解率(ORR)、疾病控制率(DCR)和不良事件数据则使用危险比(Risk ratio, RR)。P < 0.05为差异有统计学意义。本研究同意系统综述和荟萃分析指南中首选的报告项目[8]。
2 结果 2.1 检索结果、文献基本特征和质量评价从4个数据库中检索文献的流程图见图 1,最终11项文献可纳入研究行Meta分析。被纳入研究的详细基线特征见表 1。基于Cochrane Handbook 5.1.0中描述的工具,我们评估了每个纳入文献的质量偏倚,见图 2A~B,结果提示多数为低风险偏倚,故可进行进一步Meta分析。

|
| 图 1 文献检索的流程图 Figure 1 Flow chart of literature retrieval |

|

|
| The red region represented high risk, mainly focusing on generation bias and allocation hidden bias of random sequence; the yellow region represented insuffcient evidence to determine whether it was high risk or low risk, mainly focusing on result bias and allocation hidden bias caused by selective result reporting; the green region represented low risk bias. 图 2 文献质量评价 Figure 2 Quality assessment of literatures |
共纳入6项研究报告数据,各研究间无异质性(P=0.99, I2=0),故采用固定效应模型来计算合并。结果显示在晚期结直肠癌的治疗中S-1组与卡培他滨/氟尿嘧啶组相比,差异有统计学意义(P=0.02),S-1组OS有明显改善,见图 3。

|
| 图 3 S-1与卡培他滨/氟尿嘧啶治疗晚期结直肠癌的OS对比森林图 Figure 3 Forest plots of OS of advanced colorectal cancer patients treated with S-1 vs. Capecitabine/Fluorouracil |
将5项研究PFS数据进行合并分析,提示各项研究无异质性,可采用固定效应模型进行数据整合。结果提示S-1组的PFS与对照组相比,差异并无统计学意义(P=0.07),见图 4。

|
| 图 4 S-1与卡培他滨/氟尿嘧啶治疗晚期结直肠癌的PFS对比森林图 Figure 4 Forest plots of PFS of advanced colorectal cancer patients treated with S-1 vs. Capecitabine/Fluorouracil |
共纳入8项研究报告数据进行疾病控制率的分析,各研究间轻度异质性(P=0.37, I2=36%),进行单项研异质性审查后发现Kwakman等研究的人群为荷兰人,其他研究人群为亚洲人,去除这一影响因素后分析得到(P=0.31, I2=16%),采用随机效应模型,其中P=0.27,提示S-1组与对照组相比较疾病控制率差异无统计学意义,见图 5。

|
| 图 5 S-1与卡培他滨/氟尿嘧啶治疗晚期结直肠癌的DCR对比森林图 Figure 5 Forest plots of DCR of advanced colorectal cancer patients treated with S-1 vs. Capecitabine/Fluorouracil |
将9项研究疾病缓解率数据进行合并分析,提示轻度异质性(P=0.37, I2=8%),在去除含有人种不同因素的Kwakman等研究数据后,异质性减小,得到图 6(P=0.64, I2=0),可采用固定效应模型进行数据整合,提示S-1组的疾病缓解率对比卡培他滨/氟尿嘧啶组差异无统计学意义(P=0.63),见图 6。

|
| 图 6 S-1与卡培他滨/氟尿嘧啶治疗晚期结直肠癌的ORR对比森林图 Figure 6 Forest plots of ORR of advanced colorectal cancer patients treated with S-1 vs. Capecitabine/Fluorouracil |
从4~9项研究中提取白细胞减少症、血小板减少症、手足综合征(hand-foot syndrome, HFS)、黏膜或口腔炎、恶心和呕吐、肾功能不全、色素沉着过度、腹泻的对比数据。
2.4.1 白细胞减少白细胞减少提示重度异质性(P=0.0001, I2=80%)。通过审查数据,我们排除了Hamaguchi等的研究数据,因其中S-1的使用天数为28天,而其余研究组的使用天数为14天。再次分析得到(P=0.70, I2=0),故采用固定效应模型,得出S-1组的白细胞降低发生率较卡培他滨/氟尿嘧啶组低,差异有统计学意义(P=0.0003),见图 7。

|
| 图 7 S-1与卡培他滨/氟尿嘧啶治疗晚期结直肠癌白细胞减少发生率的对比森林图 Figure 7 Forest plots of incidence of leukopenia in advanced colorectal cancer patients treated with S-1 vs. Capecitabine/ Fluorouracil |
血小板减少提示中度异质性(P=0.01, I2=63%)。通过异质性审查得出Kim等、WANG等的研究数据纳入后会使异质性增加。在进行数据对比后发现这两项临床研究中S-1与卡培他滨相比剂量相差较大,遂进行排除后再次分析得到(P=0.43, I2=0),采用随机效应模型,可得结论为在S-1和卡培他滨剂量相差相对合理的研究中,S-1组的血小板减少发生率高于卡培他滨,并且差异具有统计学意义(95%CI: 1.29(1.14~1.45), P < 0.0001),见图 8。

|
| 图 8 S-1与卡培他滨/氟尿嘧啶治疗晚期结直肠癌血小板减少发生率对比的森林图 Figure 8 Forest plots of incidence of thrombocytopenia in advanced colorectal cancer patients treated with S-1 vs. Capecitabine/Fluorouracil |
分析时发现S-1使用天数的影响因素会导致异质性增加,去除Hamaguchi等的数据后再次分析得到(P=0.17, I2=33%),提示轻度可接受异质性,采用随机效应模型,结论为S-1组HFS发生率较对照组低,差异有统计学意义(P < 0.00001)。
2.4.4 肾功能异常肾功能异常(P=0.75, I2=0),选择固定效应模型,可得出S-1组的肾功能异常发生率较卡培他滨/氟尿嘧啶组低,且差异具有统计学意义(P=0.008),见图 9。

|
| 图 9 S-1与卡培他滨/氟尿嘧啶治疗晚期结直肠癌肾功能异常对比的森林图 Figure 9 Forest plots of renal dysfunction in advanced colorectal cancer patients treated with S-1 vs. Capecitabine/ Fluorouracil |
色素沉着表明存在严重的异质性(P=0.0006, I2=83%)。将S-1使用天数影响因素的Hamaguchi等研究数据去除后再次分析得到(P=0.48, I2=0),采用固定效应模型,提示S-1组色素沉着发生率高于对照组,差异具有统计学意义(95%CI: 1.07(1.07~1.59), P=0.008),见图 10。

|
| 图 10 S-1与卡培他滨/氟尿嘧啶治疗晚期结直肠癌色素沉着发生率对比森林图 Figure 10 Forest plots of chromatosis in advanced colorectal cancer patients treated with S-1 vs. Capecitabine/Fluorouracil |
腹泻(P=0.55, I2=0),采用固定效应模型,提示S-1组腹泻的发生率高于对照组,差异有统计学意义(95%CI: 1.42(1.30~1.54), P < 0.00001),见图 11。
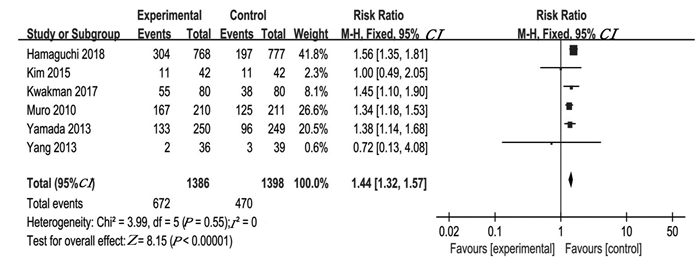
|
| 图 11 S-1与卡培他滨/氟尿嘧啶治疗晚期结直肠癌腹泻发生率对比森林图 Figure 11 Forest plots of diarrhea in advanced colorectal cancer patients treated with S-1 vs. Capecitabine/Fluorouracil |
黏膜或口腔炎、恶心呕吐的数据合并后分析得出S-1与对照组相比差异无统计学意义(P=0.89)(图略)。
3 讨论本Meta分析证实了在晚期结直肠癌的治疗中,卡培他滨/氟尿嘧啶被S-1取代后(例如,奥沙利铂+S-1、伊立替康+S-1和贝伐单抗+S-1),OS得到了提升,但PFS、DCR、ORR差异无统计学意义,其中OS和PFS的数据分析并未受人种的不同及S-1使用天数不同的影响,而DCR、ORR的分析因人种因素使其异质性增大,去除后再次分析,异质性降低并且可以接受。不良反应方面,S-1的使用天数延长会干扰白细胞降低、色素沉着、手足综合征、恶心呕吐的数据整合分析,人种因素会影响恶心呕吐的数据分析,去除后的异质性均可接受。
综合这些数据分析结果可得S-1相对于卡培他滨或者氟尿嘧啶在晚期结直肠癌的治疗中可延长总生存期,而在PFS、DCR、ORR却无明显改善,其原因考虑为S-1相对于对照组在疾病的控制以及缓解方面并无明显优势,但可以通过降低不良反应的发生而使肿瘤患者因不良反应死亡或者因不良反应而导致的未能按时化疗从而导致疾病进展过快而死亡的概率降低,这可解释为何PFS、DCR和ORR差异无统计学意义而OS是延长的,也与不良反应的分析数据相符合,这在晚期肿瘤患者的治疗中有着重要的意义。
在本文中,因其中各项研究的肝功能异常数据呈现方式不同且无法获得原始数据,所以未能进行有效整合,但试验组及对照组均观察到谷丙转氨酶、谷草转氨酶和胆红素的异常升高。并且由于大多数研究中的不良反应未进行分级,故无法获得3~4级不良反应数据的整合分析。
肿瘤患者的治疗需综合考虑患者的生存受益和不良反应耐受,目前临床中虽将S-1作为治疗消化系统恶性肿瘤的常规化疗药物,但该药物在抗癌的同时亦会对机体带来一定的损伤。对比卡培他滨及氟尿嘧啶,即使有些较为严重的不良反应发生率有所降低,但也有些轻症的不良反应发生率偏高。随着现代医学的快速发展,大多数药物的轻度不良反应已可通过对症处理得到明显改善,但较为严重的不良反应仍会阻碍药物的继续使用。晚期结直肠癌患者大多已远处转移,并已失去了手术治疗的机会,化疗是避免恶化的最后保护伞,故在选择方案时必须谨慎以及适合。因目前仅有上述11项符合要求的临床研究,期待后续能有更多更加严谨的研究数据来补充说明各人种之间差异、不良反应的分级分析以及对生存指标的分析验证。
总之,在晚期结直肠癌的治疗中,S-1取代卡培他滨/氟尿嘧啶后具有一定的优势,其总生存期有所延长,并且亚洲人群的使用中具有较少的白细胞减少、HFS、肾功能障碍发生率,但色素沉着和腹泻的发生率较卡培他滨/氟尿嘧啶高,临床使用中需根据患者的个体情况选择适当的方案,并辅以对症治疗。
作者贡献
赵荣昌:文章的选题、文献的检索、数据分析以及文章的撰写
于文艳、冯羽昕、张宛莉:协助数据的分析处理
朱春荣:协助文章修改
| [1] |
Schoffski P. The modulated oral fluoropyrimidine prodrug S-1, and its use in gastrointestinal cancer and other solid tumors[J]. Anticancer Drugs, 2004, 15(2): 85-106. |
| [2] |
Meta-analysis Group In Cancer, Piedbois P, Rougier P, et al. Efficacy of intravenous continuous infusion of fluorouracil compared with bolus administration in advanced colorectal cancer[J]. J Clin Oncol, 1998, 16(1): 301-308. DOI:10.1200/JCO.1998.16.1.301 |
| [3] |
Cascinu S. Oral treatment for gastric cancer: new choices, better choices?[J]. Lancet Oncol, 2008, 9(3): 188-189. DOI:10.1016/S1470-2045(08)70042-1 |
| [4] |
Cervantes A, Roda D, Tarazona N, et al. Current questions for the treatment of advanced gastric cancer[J]. Cancer Treat Rev, 2013, 39(1): 60-67. DOI:10.1016/j.ctrv.2012.09.007 |
| [5] |
Pieters A, Laurent S, Dero I, et al. The role of oral fluoropyrimidines in the treatment of advanced gastric cancer[J]. Acta Gastroenterol Belg, 2008, 71(4): 361-366. |
| [6] |
沈旭东, 庄志祥, 甘蕾, 等. 每周脂质体紫杉醇或奥沙利铂联合替吉奥方案治疗老年晚期胃癌的疗效及安全性分析[J]. 肿瘤防治研究, 2016, 43(5): 400-403. [Shen XD, Zhuang ZX, Gan L, et al. Efficacy and safety of weekly liposome-paclitaxel or oxaliplatin combined with tegafur on elderly advanced gastric cancer[J]. Zhong Liu Fang Zhi Yan Jiu, 2016, 43(5): 400-403. DOI:10.3971/j.issn.1000-8578.2016.05.017] |
| [7] |
Shirasaka T. Development history and concept of an oral anticancer agent S-1 (TS-1): its clinical usefulness and future vistas[J]. Jpn J Clin Oncol, 2009, 39(1): 2-15. |
| [8] |
Liberati A, Altman DG, Tetzlaff J, et al. The PRISMA statement for reporting systematic reviews and meta-analyses of studies that evaluate health care interventions: explanation and elaboration[J]. Ann Intern Med, 2009, 151(4): W65-94. |
| [9] |
Hamaguchi T, Shimada Y, Mizusawa J, et al. Capecitabine versus S-1 as adjuvant chemotherapy for patients with stage Ⅲ colorectal cancer (JCOG0910): an open-label, non-inferiority, randomised, phase 3, multicentre trial[J]. Lancet Gastroenterol Hepatol, 2018, 3(1): 47-56. DOI:10.1016/S2468-1253(17)30297-2 |
| [10] |
Kwakman JJM, Simkens LHJ, van Rooijen JM, et al. Randomized phase Ⅲ trial of S-1 versus capecitabine in the first-line treatment of metastatic colorectal cancer: SALTO study by the Dutch Colorectal Cancer Group[J]. Ann Oncol, 2017, 28(6): 1288-1293. DOI:10.1093/annonc/mdx122 |
| [11] |
Kim ST, Hong YS, Lim HY, et al. S-1 plus oxaliplatin versus capecitabine plus oxaliplatin for the first-line treatment of patients with metastatic colorectal cancer: updated results from a phase 3 trial[J]. BMC Cancer, 2014, 14: 883. DOI:10.1186/1471-2407-14-883 |
| [12] |
Kim JH, Zang DY, Chung IJ, et al. A Muti-center, Randomized Phase Ⅱ Study of Oxaliplatin and S-1 versus Capecitabine and Oxaliplatin in Patients with Metastatic Colorectal Cancer[J]. J Cancer, 2015, 6(10): 1041-1048. DOI:10.7150/jca.12819 |
| [13] |
Muro K, Boku N, Shimada Y, et al. Irinotecan plus S-1 (IRIS) versus fluorouracil and folinic acid plus irinotecan (FOLFIRI) as second-line chemotherapy for metastatic colorectal cancer: a randomised phase 2/3 non-inferiority study (FIRIS study)[J]. Lancet Oncol, 2010, 11(9): 853-860. DOI:10.1016/S1470-2045(10)70181-9 |
| [14] |
王凤歧. 替吉奥或卡培他滨联合奥沙利铂一线治疗晚期结直肠癌的临床对比[J]. 世界最新医学信息文摘(电子版), 2017, 17(11): 96-97. [Wang FQ. The Clinical Comparison of Tigio or Capecitabine Combined with Oxaliplatin in the Treatment of Advanced Colorectal Cancer[J]. Shi Jie Zui Xin Yi Xue Xin Xi Wen Zhai (Dian Zi Ban), 2017, 17(11): 96-97.] |
| [15] |
陈其珠. 替吉奥或卡培他滨联合奥沙利铂一线治疗晚期结直肠癌效果对比分析[J]. 临床医药文献电子杂志, 2017, 4(103): 20396. [Chen QZ. Comparative analysis of the efficacy of tigapetabine or capecitabine combined with oxaliplatin in the first-line treatment of advanced colorectal cancer[J]. Lin Chuang Yi Yao Wen Xian Dian Zi Za Zhi, 2017, 4(103): 20396.] |
| [16] |
杨晓利, 王峰, 夏金, 等. 替吉奥或卡培他滨联合奥沙利铂一线治疗晚期结直肠癌效果对比分析[J]. 郑州大学学报(医学版), 2013, 48(5): 688-690. [Yang XL, Wang F, Xia J, et al. Retrospective study on S-1 plus oxaliplatin versus capecitabine plus oxaliplatin for first-line treatment of patients with advanced colorectal cancer[J]. Zhengzhou Da Xue Xue Bao(Yi Xue Ban), 2013, 48(5): 688-690.] |
| [17] |
郭浩. 晚期结直肠癌患者行替吉奥或卡培他滨联合奥沙利铂一线治疗的临床疗效对比分析[J]. 现代消化及介入诊疗, 2016, 21(5): 765-767. [Guo H. Comparative analysis of clinical efficacy of tigapetabine or capecitabine combined with oxaliplatin in advanced colorectal cancer patients[J]. Xian Dai Xiao Hua Ji Jie Ru Zhen Liao, 2016, 21(5): 765-767. DOI:10.3969/j.issn.1672-2159.2016.05.035] |
| [18] |
张瑞亮, 李文见, 姜统杰. 奥沙利铂联合卡培他滨或替吉奥对晚期结肠癌患者疗效对比[J]. 癌症进展, 2017, 15(2): 196-198. [Zhang RL, Li WJ, Jiang TJ. The effect of oxaliplatin combined with capecitabine or S-1 in patients with advanced colon cancer[J]. Ai Zheng Jin Zhan, 2017, 15(2): 196-198.] |
| [19] |
Yamada Y, Takahari D, Matsumoto H, et al. Leucovorin, fluorouracil, and oxaliplatin plus bevacizumab versus S-1 and oxaliplatin plus bevacizumab in patients with metastatic colorectal cancer (SOFT): an open-label, non-inferiority, randomised phase 3 trial[J]. Lancet Oncol, 2013, 14(13): 1278-1286. DOI:10.1016/S1470-2045(13)70490-X |
 2019, Vol. 46
2019, Vol. 46


