文章信息
- 皮肤恶性肿瘤皮损病原体感染分析
- Infections of Pathogens in Lesions of Cutaneous Carcinoma
- 肿瘤防治研究, 2019, 46(7): 614-616
- Cancer Research on Prevention and Treatment, 2019, 46(7): 614-616
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.19.0083
- 收稿日期: 2019-01-21
- 修回日期: 2019-02-22
2. 274031 菏泽,菏泽市立医院皮肤科;
3. 210042 南京,中国医学科学院 北京协和医学院 皮肤病研究所皮肤外科
2. Department of Dermatology, Heze Municipal Hospital, Heze 274031, China;
3. Department of Dermatological Surgery, Institute of Dermatology and Hospital for Skin Diseases, Peking Union Medical College Hospital, Chinese Academy of Medical Sciences, Nanjing 210042, China
皮肤癌是美国人最常见的恶性肿瘤,而且其发病率逐年升高[1]。在美国2007—2011年治疗皮肤恶性肿瘤的平均年度开销达到了81亿美元,较2002—2006年的36亿美元增加了126.2%[2]。在我国,尚缺乏近年来对于皮肤癌大规模、广区域的流行病学调查。高天文等对我国西部两所医院(西安西京医院及重庆西南医院)诊断的1 905例皮肤癌进行回顾性分析,发现80年代确诊患者总数占同期行病理检查各种疾病患者总数的0.34%,90年代此比例增加至0.58%。同期皮肤恶性肿瘤占所有经病理确诊的各种恶性肿瘤的比例也同样升高[3]。
早期的皮肤恶性肿瘤可以表现为斑疹、斑片、丘疹、结节、斑块等,随着病情的发展,皮疹逐渐扩大,常常在原皮损的基础上出现破溃、坏死、糜烂及溃疡等。皮肤恶性肿瘤首选的治疗方案是手术[4],因其皮损的发展特点,使手术区域往往存在不同程度的皮肤软组织感染。因此了解皮肤恶性肿瘤皮损的感染情况,采取适宜的干预措施,对手术的预后意义重大。为此我们对皮肤外科住院的皮肤恶性肿瘤患者的病原体感染进行研究与分析。
1 资料与方法 1.1 一般资料选取2017年9月—2017年12月入住中国医学科学院皮肤病医院皮肤外科的88名皮肤恶性肿瘤住院患者。纳入标准:(1)所有患者均经病理检查确诊皮肤恶性肿瘤;(2)所有患者入院目的为接受手术治疗;(3)取得患者知情同意;(4)入院前皮损未经过抗菌处理。
1.2 标本采集及病原菌鉴定对所有入院诊断为皮肤恶性肿瘤的患者,通过观察皮损特点分为无破溃组:皮损表现为斑片、斑疹、丘疹、结节、斑块等,皮损完整,无破溃渗出,无异味。破溃组:皮损在上述表现基础上出现破溃,伴有溃疡糜烂,甚至表面有脓性分泌物,伴有恶臭。对破溃组的患者皮损进行取材,用无菌0.9%氯化钠溶液擦去表面渗出物,用拭子探入溃疡基底部或边缘部采集标本后密封于无菌试管,送细菌培养加药敏检查。将采集到的标本接种于麦克培养基,使用法国梅里埃公司的VITEK 2 Compact全自动细菌鉴定及药敏分析系统进行细菌鉴定及药敏检测。质控菌株:金黄色葡萄球菌ATCC27923、大肠埃希菌ATCC25922及铜绿假单胞菌ATCC27853,来自卫生部临床检验中心。所有操作严格遵守《全国临床检验操作规程》的要求。
1.3 统计学方法本研究采用描述式统计分析,如病原菌的构成比及耐药率采用百分率表示。
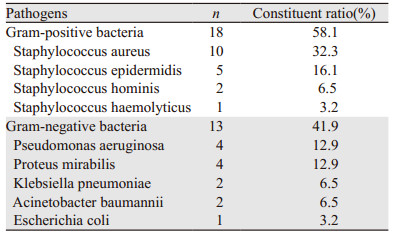
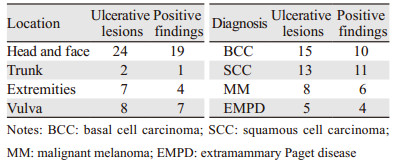
2 结果 2.1 患者一般情况88例患者中,男48例、女40例,平均年龄(66.8±13)岁。入院诊断基底细胞癌40例、鳞状细胞癌22例、恶性黑素色瘤14例、乳房外Paget病7例、鲍温病3例、隆突性皮肤纤维肉瘤2例。皮损分布于头面部51例、躯干6例、四肢20例、外阴11例,其中破溃型皮损41例,占总病例数46.6%,我们对该类型的皮损的病原体感染情况进行检测,见表 1。
|
于破溃组患者皮损处取材行细菌培养加药敏实验,41例患者中阳性结果为31例,阳性率为75.6%。其中革兰阳性菌18株,以金黄色葡萄球菌为主,革兰阴性菌13株,以铜绿假单胞菌和奇异变形杆菌为主,见表 2。
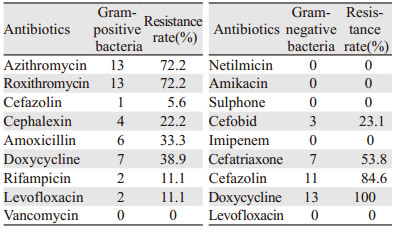
革兰阳性菌对受检测的抗生素中的万古霉素以外的药物均有耐药发生,其中对大环内脂类抗生素中的阿奇霉素和罗红霉素耐药率最高,均为72.2%,四环素类药物中的多西环素紧随其后为38.9%。此外在革兰阳性菌中发现3例多重耐药菌,2例金黄色葡萄球菌对β-内酰胺类、大环内脂类、四环素类及喹诺酮类皆耐药;1例人葡萄球菌和溶血性葡萄球菌对β-内酰胺类、大环内脂类及四环素类耐药。革兰阴性菌对四环素类的多西环素耐药率达到100%,此外对头孢类抗生素也高度耐药,其中一代头孢菌素头孢唑林钠耐药率达到84.6%。革兰阴性菌中检测出1例多重耐药的大肠埃希菌,对β-内酰胺类、四环素类及喹诺酮类耐药,见表 3。
|
皮肤恶性肿瘤好发于老年人,长期暴露于过量的紫外线辐射是一个重要的诱因[5]。老年人普遍对于皮肤癌的早期皮肤损害缺乏足够的重视,往往当皮损出现破溃出血时才不得已寻求医生的诊治[6]。这提示我们对临床上久治不愈的皮肤溃疡,需要考虑到癌变的可能,特别是对于老年人。国内有研究急性蜂窝组织炎、疖、痈、淋巴管炎、脓疱疮、湿疹感染等原因引发的皮肤软组织感染的病原体,发现最常见的革兰阳性菌为金黄色葡萄球菌,最常见的革兰阴性菌为铜绿假单胞菌[7]。与此次得出的结论相同,肿瘤组织生长迅速,当无法获得充足的血供就会发生组织缺氧坏死,坏死组织容易受各种微生物侵袭,微生物定植分解坏死组织,进一步加重皮损的坏死与溃疡。
手术切口感染是手术患者常见且极具破坏性的并发症,其原因相当复杂,患者手术全过程中的诸多因素皆有可能成为导致手术切口感染的原因,同时大部分的手术切口感染是可以避免的[8]。皮肤外科住院患者都以接受手术治疗为目的入院,破溃组的患者手术切口等级为Ⅱ~Ⅳ类。明确手术区域及远隔部位存在的感染,对预防术后手术切口的感染至关重要[9]。对于皮损存在破溃糜烂的患者,入院后我们第一时间进行了采样送检,同时积极给予局部处理,如3%硼酸液、3%过氧化氢液以及0.9%氯化钠溶液湿敷、清创、冲洗,达到去除分泌物、坏死组织目的等局部处理,并根据药敏结果给予敏感抗生素。
多重耐药菌是指对通常敏感常用的3类或3类以上抗菌药物同时呈现耐药的细菌,多重耐药也包括泛耐药和全耐药[10]。多重耐药菌的感染可导致治疗效果不佳、住院时间和费用增加、不良的预后及患者死亡[11]。随着越来越多的抗生素应用于临床,人口老龄化,平均寿命延长,多重耐药菌感染的问题日益严重[12]。此次我们调查研究中发现4例多重耐药菌株,占12.9%,对此我们采取了一系列的管控措施,执行严格的穿旁隔离,给予患者专用的体温计、输液架等,对患者换药时产生的医疗垃圾独立包装及时处理,患者出院后床铺及卧具特殊消毒处理。
国内有不少关于皮肤软组织感染病原体分布及药敏的调查,但对于皮肤恶性肿瘤皮损合并的病原体感染的研究尚且存在空缺。此次我们的调查研究发现许多老年患者对皮肤恶性肿瘤重视不足,往往当皮损扩大出现破溃,严重影响生活质量时才选择就诊。皮肤恶性肿瘤破溃糜烂的皮损普遍存在感染,病原体耐药情况也不容忽视。外科医师必须重视这一点,给予相应的术前术后处理,才能提高手术效果与安全性。本研究标本样少、采集的数据简单,还有待进一步深入研究。
作者贡献
毛世旺: 课题设计、病历资料收集、数据分析及撰写论文
闫越颖、冯广东、布文博: 病例资料收集与整理
赵亮: 课题设计
翟建新、方方: 课题指导
| [1] | Rogers HW, Weinstock MA, Feldman SR, et al. Incidence estimate of nonmelanoma skin cancer (keratinocyte carcinomas) in the US population, 2012[J]. JAMA Dermatol, 2015, 151(10): 1081–1086. DOI:10.1001/jamadermatol.2015.1187 |
| [2] | Guy GP Jr, Machlin SR, Ekwueme DU, et al. Prevalence and costs of skin cancer Treatment in the U.S., 2002-2006 and 2007- 2011[J]. Am J Prev Med, 2015, 48(2): 183–187. DOI:10.1016/j.amepre.2014.08.036 |
| [3] | 高天文, 孙东杰, 李春英, 等. 中国西部两医院1905例皮肤恶性肿瘤回顾分析[J]. 北京大学学报(医学版), 2004, 36(5): 469–472. [ Gao TW, Sun DJ, Li CY, et al. Retrospective analysis of 1905 patients with skin cancer from two general hospitals in western China from 1981 to 2000[J]. Beijing Da Xue Xue Bao (Yi Xue Ban), 2004, 36(5): 469–472. DOI:10.3321/j.issn:1671-167X.2004.05.005 ] |
| [4] | Thompson AK, Kelley BF, Prokop LJ, et al. Risk factors for cutaneous squamous cell carcinoma recurrence, metastasis, and disease-specific death: a systematic review and meta-analysis[J]. JAMA Dermatol, 2016, 152(4): 419–428. DOI:10.1001/jamadermatol.2015.4994 |
| [5] | Craig S, Earnshaw CH, Virós A. Ultraviolet light and melanoma[J]. J Pathol, 2018, 244(5): 578–585. DOI:10.1002/path.5039 |
| [6] | Alaauldeen S, Al Hawsawi K, Al Sufyani H, et al. Squamous cell carcinoma presenting as cutaneous horn: a case report[J]. Egypt J Hosp Med, 2018, 71(1): 2370–2372. DOI:10.12816/0045314 |
| [7] | 毕晓东, 宋明爱, 翟磊. 皮肤软组织感染患者病原菌分布与耐药性分析[J]. 中华医院感染学杂志, 2015, 25(14): 3186–3188. [ Bi XD, Song MA, Zhai L. Analysis of distribution and drug resistance of pathogens causing skin and soft tissue infections[J]. Zhonghua Yi Yuan Gan Ran Xue Za Zhi, 2015, 25(14): 3186–3188. ] |
| [8] | Allegranzi B, Aiken AM, Zeynep Kubilay N, et al. A multimodal infection control and patient safety intervention to reduce surgical site infections in Africa: a multicentre, before-after, cohort study[J]. Lancet Infect Dis, 2018, 18(5): 507–515. DOI:10.1016/S1473-3099(18)30107-5 |
| [9] | Allegranzi B, Bischoff P, de Jonge S, et al. New WHO recommendations on preoperative measures for surgical site infection prevention: an evidence-based global perspective[J]. Lancet Infect Dis, 2016, 16(12): e276–e287. DOI:10.1016/S1473-3099(16)30398-X |
| [10] | 黄勋, 邓子德, 倪语星, 等. 多重耐药菌医院感染预防与控制中国专家共识[J]. 中国感染控制杂志, 2015, 14(1): 1–9. [ Huang X, Deng ZD, Ni YX, et al. Chinese experts' consensus on prevention and control of multidrug resistance organism healthcare-associated infection[J]. Zhongguo Gan Ran Kong Zhi Za Zhi, 2015, 14(1): 1–9. DOI:10.3969/j.issn.1671-9638.2015.01.001 ] |
| [11] | Sanchez LO, Gustot T. Multidrug-resistant bacterial infection in patients with cirrhosis. A Review[J]. Curr Hepatol Rep, 2019, 18(1): 28–35. DOI:10.1007/s11901-019-00447-3 |
| [12] | Tang SS, Apisarnthanarak A, Hsu LY. Mechanisms of β-lactam antimicrobial resistance and epidemiology of major community-and healthcare-associated multidrug-resistant bacteria[J]. Adv Drug Deliv Rev, 2014, 78: 3–13. DOI:10.1016/j.addr.2014.08.003 |
 2019, Vol. 46
2019, Vol. 46