文章信息
- 多西他赛联合ADT治疗转移性去势敏感性前列腺癌的疗效及预后因素分析
- Efficacy and Prognostic Factors of Docetaxel Combined with ADT on Metastatic Hormone-sensitive Prostate Cancer Patients
- 肿瘤防治研究, 2019, 46(6): 526-531
- Cancer Research on Prevention and Treatment, 2019, 46(6): 526-531
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.19.0051
- 收稿日期: 2019-01-14
- 修回日期: 2019-04-18
在世界范围内,前列腺癌是一种高发生率的肿瘤,并有逐年增加趋势[1]。根据2018年美国SEER报告显示:前列腺癌是男性最常见的恶性肿瘤,估计每年有164 690例新增病例,其中2018年死亡29 430例[2]。诊断时,约20%的患者存在局部淋巴结或远处转移,约4%的患者发生远处转移性疾病[2]。同时,前列腺癌又是一种高异质性肿瘤,不同的患者治疗效果及预后迥异[3]。自二十世纪中期以来,雄激素剥夺治疗(androgen deprivation therapy, ADT)一直是转移性激素敏感性前列腺癌(metastatic hormone-sensitive prostate cancer, mHSPC)的标准治疗[4]。2004年,TAX327研究[5]第一次将多西他赛化疗用于转移性激素抵抗性前列腺癌(metastatic castration-resistant prostate cancer, mCRPC)的治疗,此后,不断有新的探索将多西他赛用于新诊断的转移性前列腺癌的早期治疗,包括激素敏感阶段[6]。直至2013年,来自法国的GETUG-AFU 15研究[7]第一次评估了多西他赛联合ADT治疗在mHSPC中的疗效,此后,多项大规模多中心前瞻性随机对照研究奠定了多西他赛联合ADT在mHSPC治疗中的地位[8-10]。这些研究显示:多西他赛联合ADT治疗mHSPC患者相较于单纯ADT治疗,显著延长了总生存时间,在高肿瘤负荷患者尤为明显[9, 11]。湖北省肿瘤医院泌尿外科早在2004年就开展了针对mCRPC患者的多西他赛化疗,是国内较早开展晚期前列腺癌多西他赛化疗的中心之一,并于2014年开始针对高肿瘤负荷mHSPC患者的多西他赛化疗联合ADT治疗,疗效较好。本研究回顾性分析了多西他赛联合ADT治疗mHSPC患者的临床资料,探讨影响治疗效果的预后因素。
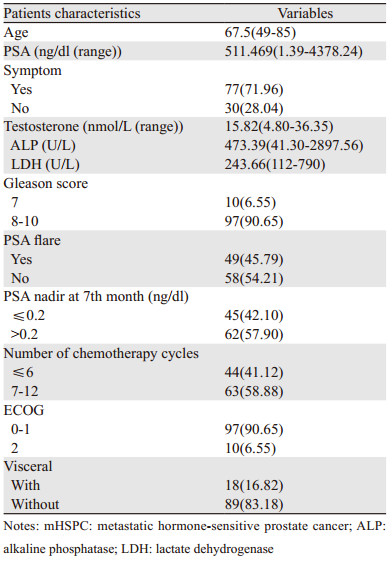
1 资料与方法 1.1 一般资料收集2014年1月—2018年12月湖北省肿瘤医院收治的新诊断的107例mHSPC患者的临床资料,包括:年龄、初始血清前列腺特异性抗原(prostate-specific antigen, PSA)水平、有无临床症状、睾酮水平、Gleason评分、碱性磷酸酶(alkaline phosphatase, ALP)水平、乳酸脱氢酶(lactate dehydrogenase, LDH)水平、化疗过程中是否存在PSA闪烁现象(PSA flare)、化疗周期数、东部肿瘤协作组(Eastern Cooperative Oncology Group, ECOG)评分、治疗7月时PSA最低值是否低于0.2 ng/dl、是否伴随内脏转移性疾病、随访时间以及结局。入选标准:(1)所有患者均经病理学检查确诊为前列腺腺泡腺癌。(2)具备病灶转移的证据(按照实体瘤疗效评价标准RECIST1.1,骨扫描或CT/MRI检查证实存在转移病灶,且为高转移负荷[9]:内脏转移或者≥4处骨转移且至少有一处为脊柱或骨盆之外的骨转移)。(3)ECOG评分≤2分。进展标准:(1)PSA进展:治疗后血清PSA较治疗前下降至少50%后在最低值基础上升高至少25%,并且PSA绝对值升高 > 2 ng/dl;影像学进展:影像学出现新的转移病灶或者原有转移病灶较前体积增大。无论是PSA进展还是影像学进展均符合PCWG3标准[12]。
1.2 治疗方法所有患者确诊后两月内行多西他赛75 mg/m2第一天一次性静脉滴注、21天为一周期,4~12周期+持续ADT治疗(促黄体激素释放激素(luteinizing hormone-releasing hormone, LHRH)激动剂/拮抗剂,每28天一次或睾丸切除术+第一代抗雄激素药物口服)+唑来膦酸4 mg,每28天一次。
1.3 观察指标化疗期间,患者每3周于化疗开始前一天复查血常规、肝肾功能、电解质、血清PSA等,化疗结束后每1~3月复查上述指标,每3月复查CT、MRI、骨扫描,出现血清PSA变化或者临床症状变化随时复查影像学。询问并记录不良反应,出现发热性中性粒细胞减少及时使用长效集落刺激因子干预。通过主动复诊及电话回访方式对患者进行跟踪随访。血清PSA进展及影像学进展作为主要随访终点,记录前列腺特异性抗原无进展生存期(PSA progression-free survival, PSA PFS)和影像学无进展生存期(Radiographic progression-free survival, rPFS)。
1.4 统计学方法采用SPSS25.0统计软件进行处理,定量资料以中位数(四分位间距)表示。PSA PFS和rPFS采用Kaplan-Meier曲线分析。以单因素和多因素Cox回归分析与患者PSA PFS和rPFS相关的预后因素。本研究单因素分析中,为避免遗漏可能影响预后的因素,将所有P < 0.2的因素均纳入多因素分析。记录危险比(hazard ratio, HR)和95%可信区间(confidence intervals, CI),P < 0.05被认为差异有统计学意义。
2 结果 2.1 患者的临床特征入选患者的基本情况,见表 1。
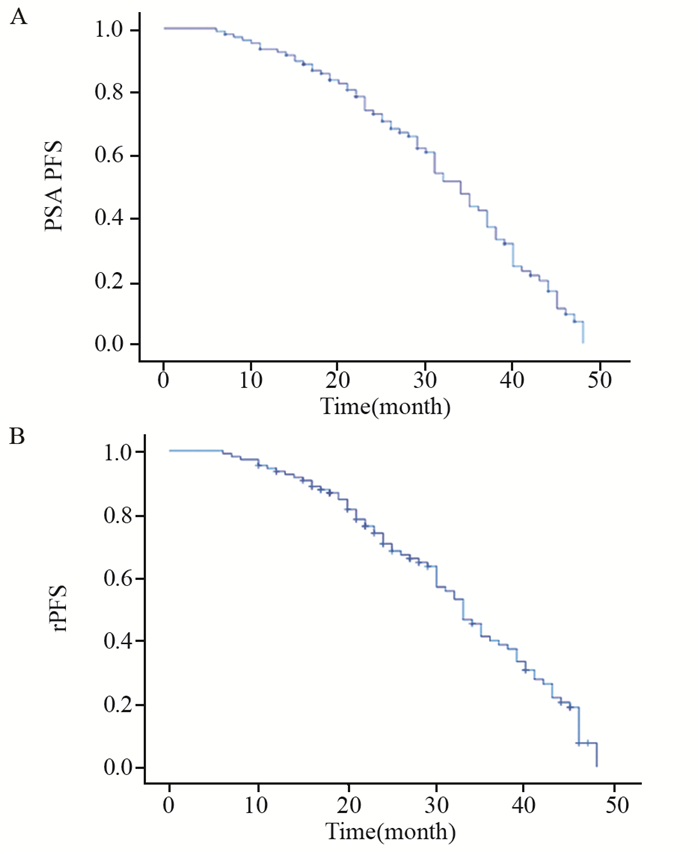
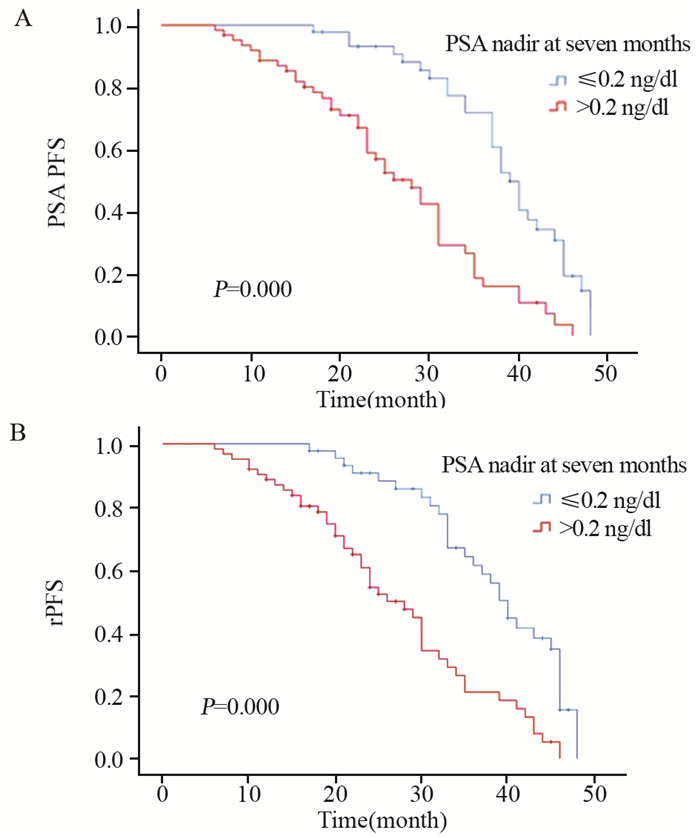
本研究中位随访时间36.000(16.024~45.876)月,多西他赛联合ADT治疗高肿瘤负荷mHSPC患者的中位PSA PFS为34.000(30.878~37.122)月,中位rPFS为33.000(30.031~35.969)月,见图 1。治疗第7月时血清PSA最低值≤0.2 ng/dl组中位PSA PFS、rPFS均长于治疗第7月时血清PSA最低值> 0.2 ng/dl组(39.000(36.626~41.374)月vs. 28.000(23.211~32.789)月),(40.000(37.126~42.874)月vs. 26.000(20.812~31.188)月),差异有统计学意义(均P=0.000),见图 2。不伴有内脏转移的mHSPC患者组中位PSA PFS、rPFS均长于伴内脏转移组(37.000(34.160~39.840)月vs. 22.000(14.624~29.376)月)(35.000(29.630~40.370)月vs. 19.000(12.795~25.205)月),差异有统计学意义(均P=0.000),见图 3。
|
| PSA: prostate-specific antigen; PFS: progression-free survival; rPFS: radiographic progression-free survival 图 1 多西他赛联合ADT治疗mHSPC患者的PSA PFS(A)和rPFS(B)Kaplan-Meier曲线图 Figure 1 Kaplan-Meier curves of PSA PFS(A) and rPFS(B) of mHSPC patients treated with docetaxel combined with ADT |
|
| 图 2 多西他赛联合ADT治疗第7月时PSA最低值≤0.2ng/dl与PSA最低值> 0.2ng/dl的mHSPC患者PSA PFS(A)和rPFS(B)情况比较 Figure 2 Comparison of PSA PFS(A) and rPFS(B) of mHSPC patients with PSA nadir at 7th month ≤0.2ng/dl and > 0.2ng/dl cohorts treated with docetaxel combined with ADT |

|
| 图 3 多西他赛联合ADT治疗伴内脏转移与不伴内脏转移的mHSPC患者PSA PFS(A)和rPFS(B)情况比较 Figure 3 Comparison of PSA PFS(A) and rPFS(B) of mHSPC patients with and without visceral cohorts treated with docetaxel combined with ADT |
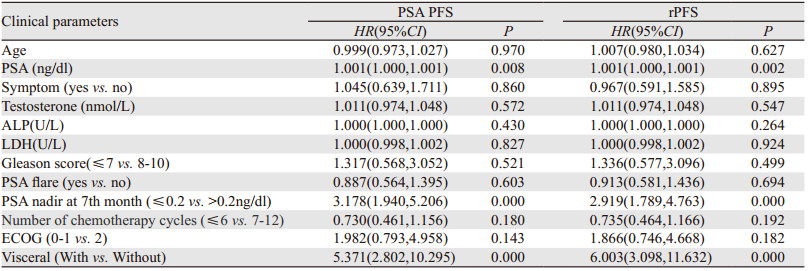
Logistic单因素回归分析显示:初始血清PSA值、治疗7月时PSA最低值是否低于0.2 ng/dl、化疗周期数、患者体能状态评分(ECOG)、是否伴有内脏转移与患者的PSA FPS、rPFS显著相关(P < 0.2),见表 2。多因素回归分析显示:治疗7月时PSA最低值是否低于0.2 ng/dl以及是否伴有内脏转移与患者的PSA FPS、rPFS显著相关(P < 0.05),见表 3。
|
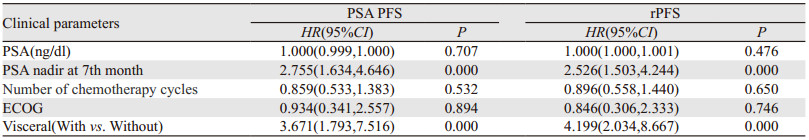
|
近年来,我国前列腺癌的发病率和病死率呈逐年递增趋势,并且高危进展性和转移性前列腺癌所占比例较高,约70%的前列腺癌患者发现时已是晚期[13]。基于国外GETUG-AFU 15、CHAARTED、STAMPEDE三大研究的结论,针对mHSPC患者的多西他赛化疗目前已写入NCCN、AUA、EUA等各大指南。多西他赛化疗目前已是贯穿于晚期前列腺癌整个治疗过程的基础治疗手段之一[14]。亚洲人,尤其是中国人的数据显示,前列腺癌分期明显晚于西方患者[15]。有关多西他赛联合ADT治疗mHSPC患者的临床数据极其有限[16],目前为止,仅一项在香港六个肿瘤中心进行的跨区域研究作了相关报道[17]。因此,我们迫切需要总结属于中国人自己的数据,以指导mHSPC患者进行序贯治疗还是联合治疗的选择并预测患者的预后[16]。
CHAARTED是第一个证实多西他赛联合ADT治疗mHSPC患者有临床受益的研究[18]。该研究将mHSPC患者分成高肿瘤负荷组和低肿瘤负荷组,结果显示:高肿瘤负荷组中多西他赛联合ADT治疗组的中位OS(Overall survival)为51.2月,而单纯ADT组中位OS为34.4月(HR=0.63; 95%CI: 0.50~0.79, P < 0.001)。STAMPEDE研究[10]纳入了转移性前列腺癌患者、淋巴结阳性患者、高危局部进展患者及高危局部复发患者,通过森林图分析结果显示:多西他赛联合ADT组治疗转移性前列腺癌患者明显获益(HR=0.76, 95%CI: 0.62~0.92),而局限性前列腺癌患者则未见明显获益(HR=0.95, 95%CI: 0.62~1, 47)。二者得出的结论是:对于高肿瘤负荷的mHSPC患者,多西他赛化疗联合ADT治疗能够获得更长的OS。GETUG-AFU 15的后续研究也证实多西他赛化疗联合ADT治疗mHSPC患者,使高肿瘤负荷组的死亡风险降低了20%[19]。Alhanafy等[20]针对埃及患者的研究,纳入了128例单纯ADT治疗的mHSPC患者,其中62%的患者为高肿瘤负荷,中位随访时间28月,高肿瘤负荷组中位OS为27月,明显低于低肿瘤负荷组49月(HR=2.1, 95%CI: 1.2~4.4; P=0.02),高肿瘤负荷组中位PFS为19月,明显低于低肿瘤负荷组48月(HR=2.44, 95%CI: 1.42~7.4; P=0.009)。因此可以得出:肿瘤负荷为mHSPC患者独立预后因素。Francini等[21]报告的一项回顾性研究纳入了436例ADT治疗的mHSPC患者,高肿瘤负荷组的中位OS和进展至CRPC的时间分别为43.2(95%CI: 37.2~56.4)月和12.2(95%CI: 9.8~14.8)月,结果也证实了肿瘤负荷是ADT治疗mHSPC患者独立预后因素。基于以上研究,对于高肿瘤负荷的mHSPC患者,多西他赛应早期应用。本研究将高肿瘤负荷mHSPC患者单独进行疗效分析及预后因素分析。遗憾的是,因随访时间不够,部分患者尚未达到观察终点,中位OS数据未观察到,仅观察到多西他赛联合ADT治疗高瘤荷mHSPC患者的中位PSA PFS为34月,中位rPFS为33月。
Alhanafy等[20]针对埃及患者的单因素分析显示:肿瘤负荷、体能状态评分、PSA水平、疼痛症状为影响患者OS的因素,多因素分析显示体能状态评分、PSA水平、肿瘤负荷是影响患者生存的独立因素。Halabi等[22]认为,转移性前列腺癌患者的预期生存取决于患者的体能状态、基线PSA水平、高Gleason评分、伴随内脏转移性疾病、基线血红蛋白、白蛋白、LDH、ALP水平等多种因素。CHAARTED研究则提示ADT治疗7月时PSA≤0.2 ng/dl的患者无论是否联合多西他赛化疗均有更好的生存预后[18]。Nieder等[23]研究了101例mHSPC患者,最终仅7%患者达到了PSA≤0.2 ng/dl,治疗7月PSA > 4 ng/dl组中位OS为22月,治疗7月PSA为(0.3~4)ng/dl中位OS为54月(P=0.0001),治疗7月PSA≤1.0 ng/dl和 > 1.0 ng/dl两组比较,存在明显差异,中位OS分别为55月和32月。本研究纳入的观察指标基本涵盖以上因素,单因素分析显示:PSA水平、体能状态评分、是否存在内脏转移性疾病、化疗周期数、治疗7月时PSA最低值是否低于0.2 ng/dl为影响患者PSA PFS、rPFS的因素,多因素分析提示治疗7月时PSA最低值是否低于0.2 ng/dl以及是否伴有内脏转移是mHSPC患者的独立预后因素,与以往文献结果一致。
然而,本研究是回顾性非随机对照研究,内在固有的偏倚,包括较短的中位随访时间,较小的样本量,样本来自单中心,患者OS未纳入观察指标等,使得研究结论价值有限,尚需要更大样本前瞻性随机对照试验证实。
迄今为止,转移性前列腺癌的治疗是复杂的,序贯治疗、联合治疗、治疗顺序、药物组合,以及不断涌现的新药物,这些给临床带来更多选择的同时,也伴随着不断的争议[24]。关于mHSPC患者预后因素的研究可以给患者的治疗带来一些提示和帮助,也进一步验证了多西他赛化疗在mHSPC患者中的治疗作用。
作者贡献
刘三河:论文撰写
崔殿生:论文设计
贾全安:病例收集
段丽群:统计分析
邓康俐:统计指导
黄雷:方案实施
魏少忠:论文指导
| [1] | Sonnenburg DW, Morgans AK. Emerging Therapies in Metastatic Prostate Cancer[J]. Curr Oncol Rep, 2018, 20(6): 46. DOI:10.1007/s11912-018-0692-z |
| [2] | Siegel RL, Miller KD, Jemal A. Cancer statistics, 2018[J]. CA Cancer J Clin, 2018, 68(1): 7–30. DOI:10.3322/caac.21442 |
| [3] | Corn PG, Agarwal N, Araujo JC, et al. Taxane-based Combination Therapies for Metastatic Prostate Cancer[J]. Eur Urol Focus, 2017. pii: S2405-4569(17)30265-1. https://www.sciencedirect.com/science/article/abs/pii/S2405456917302651 |
| [4] | Damodaran S, Kyriakopoulos CE, Jarrard DF. Newly Diagnosed Metastatic Prostate Cancer:Has the Paradigm Changed?[J]. Urol Clin North Am, 2017, 44(4): 611–21. DOI:10.1016/j.ucl.2017.07.008 |
| [5] | Tannock IF, de Wit R, Berry WR, et al. Docetaxel plus prednisone or mitoxantrone plus prednisone for advanced prostate cancer[J]. N Engl J Med, 2004, 351(15): 1502–12. DOI:10.1056/NEJMoa040720 |
| [6] | Xu L, Pachynski RK. Contemporary Management of the Newly Diagnosed Prostate Cancer Patient with Metastatic Disease at Presentation[J]. Curr Urol Rep, 2018, 19(10): 79. DOI:10.1007/s11934-018-0835-7 |
| [7] | Gravis G, Fizazi K, Joly F, et al. Androgen-deprivation therapy alone or with docetaxel in non-castrate metastatic prostate cancer (GETUG-AFU 15):a randomised, open-label, phase 3 trial[J]. Lancet Oncol, 2013, 14(2): 149–58. DOI:10.1016/S1470-2045(12)70560-0 |
| [8] | Nevedomskaya E, Baumgart SJ, Haendler B. Recent Advances in Prostate Cancer Treatment and Drug Discovery[J]. Int J Mol Sci, 2018, 19(5): pii:E1359. DOI:10.3390/ijms19051359 |
| [9] | Sweeney CJ, Chen YH, Carducci M, et al. Chemohormonal Therapy in Metastatic Hormone-Sensitive Prostate Cancer[J]. N Engl J Med, 2015, 373(8): 737–46. DOI:10.1056/NEJMoa1503747 |
| [10] | James ND, Sydes MR, Clarke NW, et al. Addition of docetaxel, zoledronic acid, or both to first-line long-term hormone therapy in prostate cancer (STAMPEDE):survival results from an adaptive, multiarm, multistage, platform randomised controlled trial[J]. Lancet, 2016, 387(10024): 1163–77. DOI:10.1016/S0140-6736(15)01037-5 |
| [11] | Vale CL, Burdett S, Rydzewska LHM, et al. Addition of docetaxel or bisphosphonates to standard of care in men with localised or metastatic, hormone-sensitive prostate cancer:a systematic review and meta-analyses of aggregate data[J]. Lancet Oncol, 2016, 17(2): 243–56. DOI:10.1016/S1470-2045(15)00489-1 |
| [12] | Cassinello J, Arranz Já, Piulats JM, et al. SEOM clinical guidelines for the treatment of metastatic prostate cancer (2017)[J]. Clin Transl Oncol, 2018, 20(1): 57–68. |
| [13] | Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115–32. DOI:10.3322/caac.21338 |
| [14] | Attard G, Parker C, Eeles RA, et al. Prostate cancer[J]. Lancet, 2016, 387(10013): 70–82. DOI:10.1016/S0140-6736(14)61947-4 |
| [15] | Chen R, Ren S, Chinese Prostate Cancer Consortium, et al. Prostate cancer in Asia:A collaborative report[J]. Asian J Urol, 2014, 1(1): 15–29. DOI:10.1016/j.ajur.2014.08.007 |
| [16] | Teoh JY, Ng CF, Poon DM. Chemohormonal therapy for metastatic hormone-sensitive prostate cancer:An Asian perspective[J]. Asia Pac J Clin Oncol, 2018, 14(Suppl 5): 5–8. |
| [17] | Teoh JYC, Poon DMC, Lam D, et al. A Territory-wide, Multicenter, Age-and Prostate-specific Antigen-matched Study Comparing Chemohormonal Therapy and Hormonal Therapy Alone in Chinese Men With Metastatic Hormone-sensitive Prostate Cancer[J]. Clin Genitourin Cancer, 2019, 17(14): e203–8. |
| [18] | McNamara M, Sweeney C, Antonarakis ES, et al. The evolving landscape of metastatic hormone-sensitive prostate cancer:a critical review of the evidence for adding docetaxel or abiraterone to androgen deprivation[J]. Prostate Cancer Prostatic Dis, 2018, 21(3): 306–18. |
| [19] | Gravis G, Boher JM, Joly F, et al. Androgen Deprivation Therapy (ADT) Plus Docetaxel Versus ADT Alone in Metastatic Non castrate Prostate Cancer:Impact of Metastatic Burden and Long-term Survival Analysis of the Randomized Phase 3 GETUG-AFU15 Trial[J]. Eur Urol, 2016, 70(2): 256–62. |
| [20] | Alhanafy AM, Zanaty F, Ibrahem R, et al. Prognostic Factors for Hormone Sensitive Metastatic Prostate Cancer:Impact of Disease Volume[J]. Asian Pac J Cancer Prev, 2018, 19(4): 1113–8. |
| [21] | Francini E, Gray KP, Xie W, et al. Time of metastatic disease presentation and volume of disease are prognostic for metastatic hormone sensitive prostate cancer (mHSPC)[J]. Prostate, 2018, 78(12): 889–95. DOI:10.1002/pros.v78.12 |
| [22] | Halabi S, Small EJ, Kantoff PW, et al. Prognostic model for predicting survival in men with hormone-refractory metastatic prostate cancer[J]. J Clin Oncol, 2003, 21(7): 1232–7. DOI:10.1200/JCO.2003.06.100 |
| [23] | Nieder C, Haukland E, Pawinski A, et al. Seven-month prostate-specific antigen (PSA) is prognostic in patients with prostate cancer initially diagnosed with distant metastases[J]. Med Oncol, 2018, 35(4): 46. DOI:10.1007/s12032-018-1110-y |
| [24] | Francini E, Yip S, Ahmed S, et al. Clinical Outcomes of First-line Abiraterone Acetate or Enzalutamide for Metastatic Castration-resistant Prostate Cancer After Androgen Deprivation Therapy+Docetaxel or ADT Alone for Metastatic Hormone-sensitive Prostate Cancer[J]. Clin Genitourin Cancer, 2018, 16(2): 130–4. DOI:10.1016/j.clgc.2017.12.012 |
 2019, Vol. 46
2019, Vol. 46