文章信息
- MicroRNA-4465对结肠癌细胞凋亡和侵袭的影响
- Effects of MicroRNA-4465 on Apoptosis and Invasion of Colon Cancer Cells
- 肿瘤防治研究, 2019, 46(9): 778-783
- Cancer Research on Prevention and Treatment, 2019, 46(9): 778-783
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.19.0050
- 收稿日期: 2019-01-11
- 修回日期: 2019-06-21
结直肠癌(colorectal cancer, CRC)是常见的恶性肿瘤之一,严重危害人类健康。有关结肠癌发生、发展及转移的分子机制仍不十分清楚,发现及研究新的分子在肿瘤发生发展过程中的作用具有重要的意义。微小RNA(microRNA, miRNA)是一类负向调控基因表达的非编码单链RNA,通过与靶基因信使RNA(mRNA)的3'-非翻译区(3'-untranslated region, 3'-UTR)完全或不完全碱基配对,引发靶基因mRNA的降解和(或)翻译抑制,从而对生物体的生长、发育和分化起着广泛的调控作用,并与包括肿瘤在内的多种疾病的发生、发展密切相关[1-2]。近年来研究发现,miR-26家族在肿瘤调控过程中具有重要的作用,通常被认为是肿瘤抑制因子[3-4]。作为miR-26家族的一员,miR-4465影响非小细胞肺癌进程[5],但其在CRC中的作用仍需进一步探讨。本研究主要探讨miR-4465对结肠癌细胞活性、凋亡以及侵袭的影响,初步探索其潜在的调控机制。
1 材料与方法 1.1 材料NCM460、SW480、HT-29和HCT-116细胞均购自中国科学院上海生化和细胞生物研究所。DMEM培养液、胎牛血清、胰蛋白酶购自美国Gibco公司。MiR-4465 mimic及阴性对照mimic-NC购自上海吉玛制药技术有限公司。转染试剂Lipofectamine3000和RNA提取试剂TRIzol购自美国Invitrogen公司。反转录试剂盒和实时荧光定量PCR检测试剂盒均购自日本TaKaRa公司。MTT试剂盒、Annexin V-FITC/PI细胞凋亡试剂盒购自南京凯基生物有限公司。Caspase-3活性检测试剂盒、RIPA细胞裂解液、PMSF和BCA蛋白含量测定试剂盒购自上海碧云天生物技术研究所。HMGA1多克隆抗体、HMGA2多克隆抗体、EZH2多克隆抗体和β-actin多克隆抗体均购自美国Abcam公司。山羊抗兔、山羊抗小鼠等二抗购自北京中杉金桥生物技术有限公司。荧光素酶报告基因检测试剂盒购自广州锐博生物科技有限公司。
1.2 细胞培养和转染将细胞置于含10%胎牛血清、100 u/ml青霉素和100 μg/ml链霉素的DMEM培养基中,在95%O2、5%CO2、37℃的培养箱中培养。细胞融合至80%~90%时,进行消化传代,将细胞接种于合适规格的孔板中,待细胞融合达到60%~70%时,按说明书进行操作Lipofectamine3000转染mimics和质粒。
1.3 qPCR分析miR-4465以及HMGA1、HMGA2和EZH2的mRNA表达水平TRIzol法提取细胞总RNA,紫外分光光度计测定D260nm和D280nm值,测定总RNA的浓度和纯度。用反转录试剂盒将RNA反转录成cDNA,以cDNA为模板按实时荧光定量PCR检测试剂盒说明书进行PCR扩增。PCR反应条件为:预变性95℃ 10 min;变性94℃ 30 s;退火59℃ 20 s;延伸72℃ 30 s;40个循环。以U6的表达水平为内参,用2-ΔΔCt方法分析miR-4465以及HMGA1、HMGA2和EZH2的相对表达水平。
1.4 MTT法检测细胞活性细胞转染48 h后,每孔加入10 μl MTT试剂(0.5 mg/μl),在37℃培养箱中孵育4 h。弃培养基,每孔加入150 μl二甲基亚砜溶液,轻轻振荡使蓝色结晶完全溶解,在酶标仪490 nm处检测吸光度(OD)值。细胞活性(%)=(OD实验组-OD空白组)/(OD对照组-OD空白组)×100%。
1.5 流式细胞仪检测细胞凋亡水平细胞转染48 h后,经消化、洗涤、离心后,弃去上清液,然后每管加100 μl 1×结合缓冲液吹打悬浮细胞,再加入5 μl Annexin V-FITC和5 μl PI染色,轻轻摇匀后,在室温下闭光孵育15 min。随后加入400 μl 1×结合缓冲液,于1 h内上机检测细胞凋亡水平。
1.6 Caspase-3活性检测细胞转染48 h后,按Caspase-3活性检测试剂盒说明书进行操作,在酶标仪405 nm处检测OD值。OD值越大,Caspase-3活性越强。
1.7 Transwell检测细胞侵袭能力细胞转染48 h后,经消化、洗涤、离心后,更换无血清培养基,调整细胞密度为5×105个/毫升。在预铺有Matrigel胶的Transwell小室中加入200 μl细胞悬液,下室中加入含10%FBS的DMEM培养基,共培养24 h后,取出上室,棉签擦去上室的残留细胞,90%酒精常温固定30 min,0.1%结晶紫常温染色10 min,显微镜拍照并计数。每组均设3个复孔,且每个复孔均随机选取5个视野进行统计。
1.8 荧光素酶报告基因检测通过PCR扩增出含有miR-4465结合位点的HMGA1 3'-UTR、HMGA2 3'-UTR以及EZH2 3'-UTR序列,将扩增序列分别克隆到pGL3-basic载体中,命名为pGL3-HMGA1 3'-UTR载体、pGL3-HMGA2 3'-UTR载体或pGL3-EZH2 3'-UTR载体。通过基因定点诱变构建出pGL3-HMGA1 3'-UTR mut载体、pGL3-HMGA2 3'-UTR mut载体或pGL3-EZH2 3'-UTR mut载体,作为阴性对照。然后,将pGL3载体与mimic或mimic-NC,连同pRL-TK载体共转染到细胞中。转染48 h后,收集细胞,按照双荧光素酶报告基因检测试剂盒说明书检测荧光素酶活性。
1.9 Western blot分析HMGA1、HMGA2和EZH2的蛋白表达水平用RIPA裂解液与PMSF的混合液(99:1)裂解细胞15 min,离心收集上清液,BCA蛋白试剂盒进行蛋白定量。取适量蛋白进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,采用半干转方法将蛋白质转移到硝酸纤维素膜上。用5%脱脂奶粉室温封闭1 h后,加入HMGA1(1:1 000)、HMGA2(1:1 000)和EZH2(1:1 000)一抗4℃孵育过夜,之后加入二抗室温孵育1 h。用Odyssey红外激光成像系统检测各条带的灰度值,以GAPDH为内参分析相对蛋白表达。
1.10 统计学方法采用GraphPad Prism 5软件进行数据分析,所有数据以至少三次独立实验的平均值±标准差表示。多组之间的比较采用单因素方差分析,组内两两比较进行Bonferroni检验。P < 0.05为差异有统计学意义。
2 结果 2.1 miR-4465过表达抑制结肠癌细胞活性qPCR检测发现,与人的正常结肠上皮细胞系NCM460相比,miR-4465在SW480、HT-29和HCT-116三种结肠癌细胞系中的表达显著下调(P=0.0002),见图 1A,提示miR-4465在结肠癌细胞中具有重要的作用。然后在HCT-116细胞中转染miR-4465 mimic,转染mimic-NC作为阴性对照,与对照组或mimic-NC组相比,miR-4465表达显著升高(P < 0.05),见图 1B。MTT检测发现,与对照组或mimic-NC组相比,miR-4465过表达显著降低HCT-116的细胞活性(P=0.0076),见图 1C。

|
| *: P < 0.05, compare with NCM460 group or control group or mimic-NC group 图 1 miR-4465过表达抑制结肠癌细胞活性 Figure 1 miR-4465 overexpression suppressed viability of colon cancer cells |
流式细胞仪检测发现,与对照组或mimic-NC组相比,miR-4465过表达显著提升HCT-116细胞的凋亡率(P < 0.0001),见图 2A、B。同时,检测Caspase-3活性发现,miR-4465过表达显著提高其活性(P=0.0001),见图 2C。

|
| *: P < 0.05, compared with control group or mimic-NC group 图 2 miR-4465过表达促进结肠癌细胞凋亡 Figure 2 miR-4465 overexpression promoted apoptosis of colon cancer cells |
Transwell检测发现,与对照组或mimic-NC组相比,miR-4465 mimic组的侵袭细胞数显著降低(P=0.0066),见图 3。

|
| *: P < 0.05, compared with control group or mimic-NC group 图 3 miR-4465过表达抑制结肠癌细胞侵袭 Figure 3 miR-4465 overexpression suppressed invasion of colon cancer cells |
通过软件预测,miR-4465与HMGA1、HMGA2以及EZH2的3'-UTR之间均存在靶向序列,见图 4A。进一步通过荧光素酶报告基因检测发现,与mimic-NC组相比,miR-4465过表达显著降低pGL3-HMGA1 3'-UTR质粒(P=0.0003,见图 4B)、pGL3-HMGA2 3'-UTR质粒(P=0.0017,图 4C)以及pGL3-EZH2 3'-UTR质粒(P=0.002,图 4D)的荧光素酶活性,而不影响对应的突变质粒的荧光素酶活性(P > 0.05)。
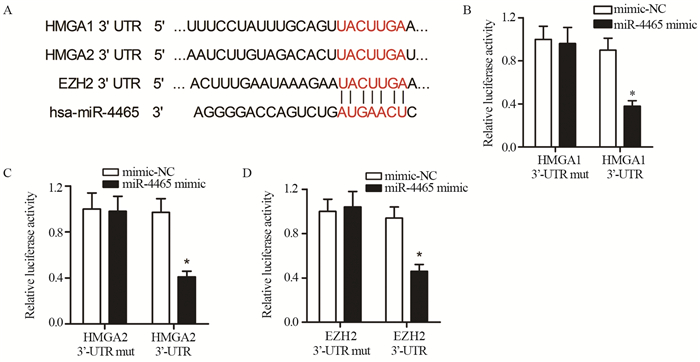
|
| *: P < 0.05, compared with mimic-NC group 图 4 miR-4465分别靶向HMGA1、HMGA2和EZH2的3’-UTR Figure 4 miR-4465 respectively targeted 3'-UTR of HMGA1, HMGA2 and EZH2 |
Western blot检测发现,与对照组或mimic-NC组相比,miR-4465过表达显著下调HMGA1(P=0.0006,图 5A)、HMGA2(P=0.0023,图 5B)以及EZH2(P=0.0039,图 5C)蛋白的表达。进一步通过qPCR检测发现,与对照组或mimic-NC组相比,miR-4465过表达显著下调HMGA1(P < 0.0001,图 5D)、HMGA2(P=0.0003,图 5E)以及EZH2(P=0.0021,图 5F)mRNA的表达。

|
| *: P < 0.05, compared with control group or mimic-NC group 图 5 miR-4465过表达抑制HMGA1、HMGA2和EZH2的蛋白和mRNA表达 Figure 5 miR-4465 overexpression suppressed protein and mRNA expression of HMGA1, HMGA2 and EZH2 |
MiRNAs是一类进化上十分保守的RNA,通过转录后降解靶mRNA和(或)抑制基因翻译,调控多种靶基因的表达,且每一种miRNA都可以靶向多个靶基因。因此,miRNAs在调控基因表达和生命活动方面发挥着广泛的作用。异常表达的miRNA及其靶基因在肿瘤的发生发展中具有重要的调控功能,作为肿瘤的抑癌基因和(或)癌基因调控肿瘤的增殖、凋亡、迁移、侵袭等。越来越多的证据表明,miRNAs在CRC的发生发展中起重要作用,如miR-21-3p[6]、miR-184[7]、miR-630[8]和miR-150[9]。本研究通过过表达miR-4465,探讨其对结肠癌细胞活性、凋亡以及侵袭的影响,旨在为阐明结肠癌的病理机制提供一个新的依据。
本研究发现,miR-4465在SW480、HT-29和HCT-116三种结肠癌细胞系中的表达均显著下调,提示miR-4465在结肠癌细胞中的重要作用。细胞增殖和凋亡不受控制是肿瘤发生的重要原因之一,其中Caspase-3是线粒体凋亡信号途径的一个关键蛋白。肿瘤细胞侵袭是肿瘤转移的一个重要部分。因此,启动肿瘤细胞的凋亡途径,抑制过度增殖和侵袭,是治疗肿瘤常用的重要手段。有研究表明,miRNAs在调控肿瘤细胞的凋亡和侵袭方面发挥重要的作用。张晓云等[10]研究发现,miR-143在CRC组织中表达量显著低于癌周正常组织。miR-143过表达可促进结肠癌细胞凋亡、抑制细胞迁移,且可能与其调控FOSL2基因表达相关。Wu等[11]研究发现,miR-21在CRC组织中的表达显著高于正常组织,其高表达与患者晚期肿瘤结节转移、淋巴结转移等密切相关。MiR-21过表达可通过靶向下调PTEN表达来抑制结肠癌细胞凋亡,促进细胞增殖和侵袭。Gao等[12]研究发现,miR-222过表达可通过靶向下调MIA3表达来促进结肠癌细胞的迁移和侵袭。本研究中发现miR-4465同样具有调控结肠癌细胞凋亡和侵袭的功能。MiR-4465过表达显著降低HCT-116的细胞活性,诱导细胞凋亡、提高Caspase-3活性,并且抑制细胞侵袭能力,提示miR-4465在CRC中发挥抑癌作用。
进一步探讨miR-4465的调控机制,通过预测miR-4465与HMGA1、HMGA2和EZH2之间均存在靶向互补序列,提示这三个基因可能是miR-4465的靶基因。有文献报道这三种基因在多种癌症,包括结肠癌中发挥促癌作用[13-15],且受到miRNAs的调控。Fan等[16]研究发现,miR-543在CRC患者组织中表达下调,且体外过表达miR-543能够通过抑制HMGA2等基因来阻碍结肠癌细胞的增殖和侵袭。Sun等[5]研究发现,miR-4465能够通过直接靶向抑制EZH2的表达来阻碍非小细胞肺癌细胞的增殖和侵袭。本研究通过荧光素酶报告基因检测证实miR-4465能够分别靶向HMGA1、HMGA2和EZH2的3’-UTR来抑制它们的表达,提示miR-4465在CRC中的抗癌作用可能与抑制这三个致癌基因的表达有关。
综上所述,本研究表明miR-4465是结直肠癌的一个抑制因子,过表达能够降低结肠癌细胞的活性,促进细胞凋亡并降低细胞侵袭,这可能与靶向抑制HMGA1、HMGA2、EZH2的表达有关。本研究为进一步阐明结直肠癌的病理机制提供了新的依据,提示miR-4465可能是治疗结直肠癌的潜在靶点。
作者贡献
杨继岚:课题设计、实验操作、实验数据统计及文章撰写
李杨、邓明佳:实验操作
胡凤娣:实验数据统计
谢琳:课题设计、文章审核
龙庭凤:文章审核
| [1] | 徐钢, 高轶, 闫茂生. miR-155/PTEN调控轴在肝癌中的表达及其机制[J]. 肿瘤防治研究, 2018, 45(2): 67–72. [ Xu G, Gao Y, Yan MS. Expression of miR-155/PTEN axis in hepatocellular carcinoma and its mechanism[J]. Zhong Liu Fang Zhi Yan Jiu, 2018, 45(2): 67–72. DOI:10.3971/j.issn.1000-8578.2018.17.0931 ] |
| [2] | 王玉霞, 王芳, 崔华胜, 等. miR-205对胃癌细胞侵袭迁移的调控作用及其潜在机制[J]. 肿瘤防治研究, 2018, 45(5): 280–284. [ Wang YX, Wang F, Cui HS, et al. Regulatory effects of miR-205 on invasion and migration of gastric cancer cells and potential mechanism[J]. Zhong Liu Fang Zhi Yan Jiu, 2018, 45(5): 280–284. DOI:10.3971/j.issn.1000-8578.2018.17.1217 ] |
| [3] | Li J, Liang Y, Lv H, et al. miR-26a and miR-26b inhibit esophageal squamous cancer cell proliferation through suppression of c-MYC pathway[J]. Gene, 2017, 625: 1–9. DOI:10.1016/j.gene.2017.05.001 |
| [4] | Chen CY, Chang JT, Ho YF, et al. MiR-26 down-regulates TNF-α/NF-κB signalling and IL-6 expression by silencing HMGA1 and MALT1[J]. Nucleic Acids Res, 2016, 44(8): 3772–3787. DOI:10.1093/nar/gkw205 |
| [5] | Sun J, Tian X, Lu SQ, et al. MicroRNA-4465 suppresses tumor proliferation and metastasis in non-small cell lung cancer by directly targeting the oncogene EZH2[J]. Biomed Pharmacother, 2017, 96: 1358–1362. DOI:10.1016/j.biopha.2017.11.070 |
| [6] | Hou N, Guo Z, Zhao G, et al. Inhibition of microRNA-21-3p suppresses proliferation as well as invasion and induces apoptosis by targeting RNA-binding protein with multiple splicing through Smad4/extra cellular signal-regulated protein kinase signalling pathway in human colorectal cancer HCT116 cells[J]. Clin Exp Pharmacol Physiol, 2018, 45(7): 729–741. DOI:10.1111/1440-1681.12931 |
| [7] | Wang YB, Zhao XH, Li G, et al. MicroRNA-184 Inhibits Proliferation and Promotes Apoptosis of Human Colon Cancer SW480 and HCT116 Cells by Downregulating C-MYC and BCL-2[J]. J Cell Biochem, 2018, 119(2): 1702–1715. DOI:10.1002/jcb.26330 |
| [8] | Zhang L, Feng G, Zhang X, et al. microRNA-630 promotes cell proliferation and inhibits apoptosis in the HCT116 human colorectal cancer cell line[J]. Mol Med Rep, 2017, 16(4): 4843–4848. DOI:10.3892/mmr.2017.7159 |
| [9] | Li C, Du X, Xia S, et al. MicroRNA-150 inhibits the proliferation and metastasis potential of colorectal cancer cells by targeting iASPP[J]. Oncol Rep, 2018, 40(1): 252–260. |
| [10] | 张晓云, 王立峰. miR-143在结肠癌组织中的差异表达及其对结肠癌细胞凋亡和迁移的影响[J]. 上海交通大学学报(医学版), 2017, 37(3): 325–329. [ Zhang XY, Wang LF. Differential expression of miR-143 in colon cancer tissue and its effect on apoptosis and migration of colon cancer cell[J]. Shanghai Jiao Tong Da Xue Xue Bao(Yi Xue Ban), 2017, 37(3): 325–329. DOI:10.3969/j.issn.1674-8115.2017.03.009 ] |
| [11] | Wu Y, Song Y, Xiong Y, et al. MicroRNA-21 (Mir-21) Promotes Cell Growth and Invasion by Repressing Tumor Suppressor PTEN in Colorectal Cancer[J]. Cell Physiol Biochem, 2017, 43(3): 945–958. DOI:10.1159/000481648 |
| [12] | Gao H, Cong X, Zhou J, et al. MicroRNA-222 influences migration and invasion through MIA3 in colorectal cancer[J]. Cancer Cell Int, 2017, 17: 78. DOI:10.1186/s12935-017-0447-1 |
| [13] | Xing J, Cao G, Fu C. HMGA1 interacts with β-catenin to positively regulate Wnt/β-catenin signaling in colorectal cancer cells[J]. Pathol Oncol Res, 2014, 20(4): 847–851. DOI:10.1007/s12253-014-9763-0 |
| [14] | Wang X, Liu X, Li AY, et al. Overexpression of HMGA2 promotes metastasis and impacts survival of colorectal cancers[J]. Clin Cancer Res, 2011, 17(8): 2570–2580. DOI:10.1158/1078-0432.CCR-10-2542 |
| [15] | Kurihara H, Maruyama R, Ishiguro K, et al. The relationship between EZH2 expression and microRNA-31 in colorectal cancer and the role in evolution of the serrated pathway[J]. Oncotarget, 2016, 7(11): 12704–12717. |
| [16] | Fan C, Lin Y, Mao Y, et al. MicroRNA-543 suppresses colorectal cancer growth and metastasis by targeting KRAS, MTA1 and HMGA2[J]. Oncotarget, 2016, 7(16): 21825–21839. |
 2019, Vol. 46
2019, Vol. 46


