文章信息
- 浸润性膀胱癌NOSE手术联合乙状结肠原位新膀胱术6例报道
- Report on Six Cases of Invasive Bladder Cancer Treated with Natural Orifice Specimen Extraction Combined with Sigmoid Colon in situ Neo-bladder Surgery
- 肿瘤防治研究, 2019, 46(6): 575-578
- Cancer Research on Prevention and Treatment, 2019, 46(6): 575-578
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.19.0048
- 收稿日期: 2019-01-09
- 修回日期: 2019-04-12
随着科技的进步和腹腔镜技术的发展, 泌尿外科也由传统的开放手术进入微创时代。从最开始的2D腹腔镜到3D腹腔镜, 再到现在的达芬奇机器人腹腔镜技术, 泌尿外科医生手术操作越来越精细, 但始终无法达到腹部无切口的手术要求。早在1993年美国德克萨斯内镜外科研究所Franklin等就提出完全腹腔镜下结肠癌根治性切除术, 标本经肛门拖出的手术方式, 希望能达到腹部无切口、进一步减少患者痛苦及并发症的目的[1]。经过10余年的锤炼和创新, 经自然腔道标本取出(natural orifice specimen extraction, NOSE)手术方式越来越受到外科医生的重视。现在结直肠癌NOSE手术已经非常成熟, 但鲜有浸润性膀胱癌NOSE手术的报告, 本研究借鉴胃肠外科NOSE手术方式, 探讨膀胱癌NOSE手术方式的可行性, 现报告如下。
1 资料与方法 1.1 临床资料收集2017年1月—2018年6月湖北省肿瘤医院泌尿外科住院的6例男性膀胱癌患者病历资料, 年龄55~65岁, 平均62岁。膀胱镜下活检提示均为浸润性尿路上皮癌, 肿瘤大小不超过5 cm。每例患者术前均行结肠镜检查, 排除乙状结肠及直肠存在肿瘤性病变及乙状结肠憩室者。排除肿瘤侵及膀胱颈及尿道内口的患者, 术前均经泌尿系造影(CTU)及磁共振检查未发现远处转移和盆腔淋巴结转移, 心肺检查及肝肾功能正常, 无合并其他基础性疾病。
1.2 术前准备术前3天开始进食流质饮食, 每天口服30 ml甲硝唑及2 ml庆大霉素, 术前1天禁饮食, 口服肠内营养制剂, 并给予聚乙二醇电解质散剂清洁肠道, 手术当天行清洁灌肠一次。
1.3 手术方法(1)常规行腹腔镜下双侧闭孔淋巴结清扫术及全膀胱切除术, 在离断尿道时尽可能保留前列腺尖部组织及尿道两侧的筋膜, 见图 1A, 避免损伤尿道外括约肌。(2)截取一段长约20 cm的乙状结肠, 见图 1B, 保留其系膜及血供, 作为贮尿囊。充分扩肛及肠道稀释碘伏灌洗后, 用腔镜下切割缝合器离断选取的乙状结肠近端及远端后, 置入直肠保护装置, 标本经直肠肛门拖出, 见图 1C。钉砧头自肛门送入腹腔并缝合固定于近端乙状结肠末端, 见图 1D, 腔内闭合直肠残端, 肛门置入圆形吻合器完成腔内吻合, 恢复肠道连续性, 见图 1E。(3)在乙状结肠近端两侧结肠带保留2 cm结肠带供输尿管与肠管吻合, 在肠系膜对侧保留2 cm×2 cm完整肠壁供肠管与尿道吻合, 其余结肠带及肠壁浆肌层完全剔除, 见图 1F。(4)在腔镜下置入双侧输尿管双J管, 见图 1G, 在结肠带上分别置入左侧及右侧输尿管, 左侧输尿管与肠管用3-0可吸收线缝合4针, 同法处理右侧输尿管, 见图 1H。封闭乙状结肠近端及远端, 在距离乙状结肠远端约5 cm处截取1 cm圆孔, 从尿道置入22F三腔气囊导尿管经圆孔进入乙状结肠新膀胱内, 见图 1I, 用3-0倒刺可吸收缝合线将新膀胱与后尿道吻合8针, 见图 1J。查看肠壁无张力后, 气囊内注入20 ml 0.9%氯化钠溶液, 适当牵拉尿管确保新膀胱与尿道对合良好。(5)盆腔两侧各留置一根引流管通畅引流。术后3天用碳酸氢钠低压冲洗新膀胱。术后2周行膀胱造影检查, 若新膀胱无造影剂渗漏则拔除双侧双J管, 然后分别拔除盆腔引流管, 约3周后拔除导尿管。
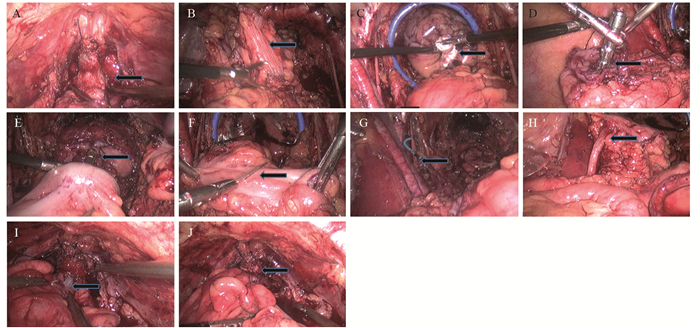
|
| A: preserved the tip of the prostate; B: interception of loops; C: removed specimens; D: fixed the anvil; E: intestine anastomosis; F: rupture of colonic band; G: inserted ureteral stent tube; H: the ureter and intestine were anastomosed; I: inserted a three-chamber catheter; J: anastomosis of neobladder and urethra 图 1 经自然腔道膀胱癌标本取出手术步骤 Figure 1 Procedure of natural orifice specimen extraction(NOSE) of bladder cancer for removal |
6例手术均顺利完成, 无中转开腹手术, 术后分期均为T2a~T3a, 清扫淋巴结10~22枚, 平均16枚, 手术时间为5~7.5 h, 平均6 h, 无手术死亡或再次手术者, 术中失血量200~500 ml, 平均300 ml。无肠梗阻、肠瘘及尿瘘, 无出血及伤口感染, 术后2周行膀胱造影提示新膀胱愈合良好后拔除双侧单J管, 盆腔引流管2周后可依次拔除, 术后3周拔除导尿管。拔除尿管后开始做凯格尔运动, 术后3月内均有不同程度的尿失禁, 经过凯格尔运动及有规律的定时排尿后达到完全的自控排尿。新膀胱容量300~500 ml, 平均400 ml, 残余尿量<50 ml。无肾盂积水及输尿管扩张, 术后检查所有患者血肌酐及尿素氮均正常, 无高氯血症出现, 2例患者出现勃起功能障碍。
3 讨论自20世纪90年代腹腔镜技术进入中国以来, 微创技术突飞猛进, 微创理念已经被越来越多医师和患者所接受。随着各大研究中心的大样本、大数据结果公布之后, 腹腔镜在一定程度上比开腹手术更具有优势, 特别是对于盆腔及腹腔深部的手术。腹腔镜的放大作用使血管和组织间隙暴露得更为清楚, 术后出现的并发症更少[2]。更重要的是腹腔镜手术带来更小的手术伤口, 很大程度地降低了伤口感染的风险[3]。
膀胱癌是泌尿系常见恶性肿瘤, 发病率高[4]。局限在T1期的膀胱癌可以通过经尿道膀胱肿瘤电切治疗, 但术后复发率高达70%以上[5]。对于肌层浸润性膀胱癌患者推荐行根治性全膀胱切除术, 切除膀胱后替代贮尿囊建立新膀胱的方法很多, 但原位可控性膀胱术被认为是尿流改道的最佳术式[6]。胃代膀胱是一种较理想的材料, 但是对患者创伤大, 术后恢复困难[7]; 回肠原位新膀胱术虽然术式相对简单, 但术后并发症较多, 特别是肠梗阻发生率高, 主要原因可能是小肠在腹腔相对游离, 易与新膀胱创面或盆腔创面粘连[8]。乙状结肠和膀胱神经支配平面相近, 其节律性的蠕动和压力与膀胱相近, 术后更易形成排尿反射[9]。乙状结肠更接近尿道膜部, 自然状态下可与尿道吻合, 且不干扰腹腔的肠管, 术后肠粘连及肠梗阻风险明显降低[10]。乙状结肠去除结肠带后储尿容量明显增大, 延展性较小肠好, 结肠肠管肌肉较发达, 排尿更有力[11]。乙状结肠无需进行U型或W型缝合, 贮尿囊的制备相对简单。因此, 乙状结肠新膀胱术受到推崇, 近几年, 国内外学者提出将结肠系膜两侧的结肠带间断破坏能明显增大新膀胱的容量, 降低肠壁张力[12]。我们的经验是尽量破坏系膜两侧结肠带, 不仅新膀胱容量会增加, 而且明显降低了肠道蠕动产生的肠壁张力, 确保新膀胱处于长期的低压状态, 减少尿液反流导致的泌尿系感染和肾积水发生。
传统的腹腔镜下根治性全膀胱切除术+乙状结肠原位新膀胱术均需要行长约6~8 cm的辅助小切口, 可增加患者术后疼痛及术后伤口感染的风险, 也可导致切口疝的发生, 极大地削弱了腹腔镜的优势。如何达到腹部无切口的微创手术始终困扰外科医生。近年来, 腔镜技术快速发展, Choi等首次将结直肠癌腹腔镜手术与经自然腔道取标本相结合, 并且取得了成功[13], 标志着结直肠癌手术已进入完全腹腔镜手术阶段。我院于2017年开始尝试行浸润性膀胱癌NOSE手术联合乙状结肠原位新膀胱术, 手术中遇到许多难点, 例如如何在腹腔镜下完成肠道的重建及新膀胱与输尿管的重建。腹腔镜下肠道的重建借助于结直肠癌NOSE手术经验。早在1994年英国学者Darzi就报道了完全腹腔镜下乙状结肠切除术, 并详细描述了标本如何从肛门取出、如何置入吻合器钉砧头、如何将钉砧头与肠管固定以及如何完成腔内吻合[14]。2007年印度外科医师Palanivelu等成功实施了腹腔镜下结直肠经自然腔道标本取出的手术方式, 并首次推荐将该术式命名为NOSE[15]。此后, 结直肠NOSE手术迅速发展, 手术方式不仅仅局限于标本从肛门取出, 还有报道标本经阴道取出术。现腹腔镜结直肠NOSE手术已被证实安全有效, 并且术后切口感染、切口疝及术后疼痛发生率明显低于传统的腹腔镜结直肠癌手术[16]。对于浸润性膀胱癌NOSE手术, 我们的体会是在完全腹腔镜下行肠管吻合时需要游离足够的肠管长度, 避免吻合时肠管张力过大导致术后吻合口瘘。尽可能保留更多结肠系膜, 保证肠管的血运畅通, 避免术后因肠管血运障碍导致肠管缺血, 引起吻合口瘘及盆腔感染。
目前为止, 完全腹腔镜下新膀胱与双侧输尿管吻合方式鲜有报道。我们的经验是输尿管需要在肠壁间潜行一小段距离, 可减少术后尿液反流。输尿管与乙状结肠吻合口尽量选择在结肠带上, 当尿液充盈时, 结肠带强有力的收缩压迫输尿管输出端, 造成输尿管吻合口暂时性关闭, 减少尿液反流。本研究6例患者术后均未见明显尿液反流, 且患者新膀胱容量300~500 ml, 未见电解质紊乱及高氯血症发生, 主要原因可能是乙状结肠主要是储存大便功能, 而吸收及分泌功能相对较弱。
本研究6例患者均顺利完成手术, 术后无一例出现肠梗阻、肠瘘及伤口感染, 术后无需给予镇痛治疗。6例患者在3月内均有不同程度的尿失禁, 但所有患者进行凯格尔训练3月后均可达到满意的控尿。总结经验教训, 离断前列腺尿道时, 在保证足够切缘的情况下尽可能保留前列腺尖部组织, 即使仅仅保留很少的前列腺尖部组织, 术后控尿仍较完全不保留前列腺尖部患者好。另外特别需要注意的是, 在取标本时一定要置入肛门保护套, 避免肿瘤种植转移。因所有操作均在腹腔完成, 术前3天必须口服肠道抗菌药物, 且进食无渣饮食, 确保乙状结肠相对无菌。在病例的选择上, 疾病分期早、病灶小, 且肿瘤远离膀胱颈为首选。
微创是外科医生对腹腔镜技术的升华, 虽然6例手术均顺利完成, 但是还有许多问题亟待解决。目前我院的小样本研究提示浸润性膀胱癌NOSE手术联合乙状结肠原位新膀胱术具美容、术后恢复快、并发症少、控尿及储尿功能良好的特点, 是一种理想的尿流改道方式。但是因病例数少, 患者远期的并发症及长期生存率需要进一步随访。
作者贡献
黄 雷:收集患者资料、参与临床试验、术后随访及撰写论文
魏少忠:临床试验、指导论文写作及修改
崔殿生、李有元、贾全安:临床试验
刘三河:收集患者资料
邓康俐:数据统计分析
| [1] | Franklin ME Jr, Ramos R, Rosenthal D, et al. Laparoscopic colonic procedures[J]. World J Surg, 1993, 17(1): 51–6. DOI:10.1007/BF01655705 |
| [2] | Di Furia M, Salvatorelli A, Della Penna A, et al. Advantage of laparoscopic resection for pelvic Schwannoma: Case report and review of the literature[J]. Int J Surg Case Rep, 2018, 45: 38–41. DOI:10.1016/j.ijscr.2018.03.006 |
| [3] | Park JS, Kang H, Park SY, et al. Long-term outcomes after Natural Orifice Specimen Extraction versus conventional laparoscopy-assisted surgery for rectal cancer: a matched case-control study[J]. Ann Surg Treat Res, 2018, 94(1): 26–35. DOI:10.4174/astr.2018.94.1.26 |
| [4] | Cumberbatch MGK, Jubber I, Black PC, et al. Epidemiology of Bladder Cancer: A Systematic Review and Contemporary Update of Risk Factors in 2018[J]. Eur Urol, 2018, 74(6): 784–95. DOI:10.1016/j.eururo.2018.09.001 |
| [5] | Yılmaz Y, Kahya MC, Dilek FH, et al. Can tumor recurrence be reduced with plasma-kinetic vaporization of the area around the tumor in nonmuscle invasive bladder cancer?[J]. Investig Clin Urol, 2018, 59(4): 223–31. DOI:10.4111/icu.2018.59.4.223 |
| [6] | Moeen AM, Safwat AS, Gadelmoula MM, et al. Health related quality of life after urinary diversion. Which technique is better?[J]. J Egypt Natl Canc Inst, 2018, 30(3): 93–7. DOI:10.1016/j.jnci.2018.08.001 |
| [7] | Shamsa A. Gastric pouch after simple or radical cystectomy for benign and malignant bladder disease[J]. Nephrourol Mon, 2014, 6(6): e17890. |
| [8] | Anderson CB, McKiernan JM. Surgical Complications of Urinary Diversion[J]. Urol Clin North Am, 2018, 45(1): 79–90. DOI:10.1016/j.ucl.2017.09.008 |
| [9] | Ranson RN, Saffrey MJ. Neurogenic mechanisms in bladder and bowel ageing[J]. Biogerontology, 2015, 16(2): 265–84. DOI:10.1007/s10522-015-9554-3 |
| [10] | Chen G, Liao L, Miao D. Electrical stimulation of somatic afferent nerves in the foot increases bladder capacity in neurogenic bladder patients after sigmoid cystoplasty[J]. BMC Urol, 2015, 15: 26. DOI:10.1186/s12894-015-0023-8 |
| [11] | Nicita G, Martini A, Filocamo MT. Use of sigmoid colon in orthotopic neobladder reconstruction: Long-term results[J]. Int J Urol, 2016, 23(12): 984–90. DOI:10.1111/iju.2016.23.issue-12 |
| [12] | Alcini E, D'Addessi A, Racioppi M, et al. Results of 4 years of experience with bladder replacement using an ileocecal segment with multiple transverse tenia myo tomies[J]. J Urol, 1993, 149(4): 735–8. DOI:10.1016/S0022-5347(17)36195-5 |
| [13] | Choi BJ, Lee SC, Kang WK. Single-port laparoscopic total mesorectal excision with transanal resection(transabdominal transanal resection) for low rectal cancer: Initial experience with 22 cases[J]. Int J Surg, 2013, 11(9): 858–63. DOI:10.1016/j.ijsu.2013.08.003 |
| [14] | Darzi A, Super P, Guillou PJ, et al. Laparoscopic sigmoid colectomy: total laparoscopic approach[J]. Dis Colon Rectum, 1994, 37(3): 268–71. DOI:10.1007/BF02048165 |
| [15] | Palanivelu C, Rangarajan M, Jategaonkar PA, et al. An innovative technique for colorectal specimen retrieval: a new era of natural orifice specimen extraction (N.O.S.E.)[J]. Dis Colon Rectum, 2008, 51(7): 1120–4. DOI:10.1007/s10350-008-9316-2 |
| [16] | Hiep PN, Thien HH, Vu PA. Natural orifice transluminal endoscopic surgery for colorectal cancer[J]. BJS Open, 2017, 1(1): 24–9. DOI:10.1002/bjs5.4 |
 2019, Vol. 46
2019, Vol. 46


