文章信息
- 食管鳞癌患者外周血及癌组织中浸润性NK细胞表面受体的表达
- Expression of Infiltrating NK Cell Surface Receptors in Peripheral Blood and Cancer Tissues of Patients with Esophageal Squamous Cell Carcinoma
- 肿瘤防治研究, 2019, 46(9): 796-801
- Cancer Research on Prevention and Treatment, 2019, 46(9): 796-801
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.19.0027
- 收稿日期: 2019-01-09
- 修回日期: 2019-05-07
我国是食管癌高发区[1],2016年癌症数据分析结果表明,食管癌在我国人群中总发病率居第3位,总死亡率居第4位[2]。食管癌病死率高且其5年生存率不到30%,预后不佳[3]。随着免疫治疗的进展,免疫因素在肿瘤发生发展中的作用越来越受到重视,但主要集中在基于T细胞的抗肿瘤治疗。自然杀伤(natural killer, NK)细胞是人体内非特异性免疫系统的主要组成部分,与T细胞不同,其无需预先致敏即可产生各种细胞因子和趋化因子,对肿瘤和靶细胞起到杀伤作用[4]。而NK细胞的杀伤能力与其表面受体的表达密切相关;其中,活化性受体自然细胞毒受体家族(NKp30、NKp44、NKp46)、NKG2D、与细胞毒作用紧密相关的CD16、与NK细胞成熟相关的抑制性受体NKG2A都是NK细胞表面重要的受体。
多种实体肿瘤的相关研究表明,NK细胞表面受体的表达失衡与肿瘤的发生机制有关[5]。目前针对NK细胞的研究主要集中在外周血NK细胞的数量。因此,本研究探讨食管鳞癌患者外周血及组织中NK细胞的表型、NK细胞的比例和表面受体表达,以期为探讨食管鳞癌免疫逃逸的机制和免疫治疗提供基础研究的依据。
1 资料与方法 1.1 研究对象收集2017年4月—2017年9月间于西南医科大学附属医院胸心外科确诊为食管鳞癌的患者52例;其中男48例、女4例,年龄42~80岁,平均(61.56±8.16)岁。所有患者术前均行胃镜检查明确诊断为食管鳞癌,且既往均未接受过手术、化疗、放疗或其他方式的治疗,无慢性感染性病变及其他免疫系统疾病,术后病理组织学再次证实为食管鳞癌,并依据国际抗癌联盟(Union for International Cancer Control, UICC)与美国癌症联合会(American Joint Committee on Cancer, AJCC)联合发布的第8版分期标准行食管癌TNM分期。52例食管鳞癌患者中Ⅰ期17例、Ⅱ期8例、Ⅲ期24例、Ⅳ期3例,35例健康者外周血作为正常对照组。
1.2 标本采集食管鳞癌患者术前用肝素抗凝管采集外周静脉血3 ml。同一患者在术中切除病变组织后,根据组织标本的特征分别取食管鳞癌组织、以距离癌边缘5 cm以远的非肿瘤正常食管组织各一块装入无菌标本袋中,用4℃冰盒在1 h内送回实验室。健康者血液标本同样用肝素抗凝管采集外周静脉血3 ml。
1.3 试剂和仪器试剂:荧光标记抗体(FITC-conjugated anti-human CD3,APC-conjugated anti-human CD56,PE-Cy7-conjugated anti-human CD16,PE-conjugated anti-human NKp30,PE-conjugated anti-human NKp44,PE-conjugated anti-human NKp46,PerCP-Cy5.5-conjugated anti-human NKG2A、PerCP-Cy5.5-conjugated anti-human NKG2D)(所有抗体均购自美国BD公司),人外周血淋巴细胞分离液(天津灏洋公司),PBS缓冲液(北京索莱宝公司)。
仪器:一次性多功能过滤器、高速离心机、15、50 ml离心管、流式细胞分析仪。
1.4 实验方法 1.4.1 外周血单个核细胞(peripheral blood mononuclear cell, PBMC)分离取3 ml淋巴细胞分离液加入15 ml离心管中;用吸管小心吸取健康者或食管鳞癌患者外周静脉血3 ml,缓慢加于分离液的液面上,650 g离心30 min;离心后,小心吸取第二层环状乳白色淋巴细胞层到另一15 ml离心管中,并加入10 ml无菌PBS,重悬细胞;再次4℃、250 g离心10 min,弃上清液后加入5 ml PBS重悬,洗涤2次(4℃、250 g 5 min),得到所需PBMC,用1 ml PBS重悬细胞备用。
1.4.2 组织单细胞悬液获取肿瘤组织和正常组织均采用机械网搓法,将具有200目滤网的一次性多功能过滤器放置于15 ml试管上。把剪碎的组织放在网上,用眼科镊子轻轻搓组织块,边搓边用PBS冲洗,直到将组织搓完,得到肿瘤组织及正常组织单细胞悬液。
1.4.3 组织单个核细胞(Tissue mononuclear cell, TMC)分离取5 ml淋巴细胞分离液加入15 ml离心管;将得到的单细胞悬液取5 ml缓慢加入淋巴细胞分离液的液面上,650 g 离心30 min;吸取云雾状中间层后加入10 ml无菌PBS混匀,在4℃恒温离心机中230 g离心10 min,弃上清液后加入5 ml PBS重悬洗涤1次(4℃、230 g 5 min)再用1 ml PBS重悬得到所需组织中单核细胞。
1.4.4 流式细胞术检测PBMC及TMC中NK细胞比例和表面受体的表达取PBMC(或TMC)10 μl加入流式检测管中,再加入190 μl PBS上机检测细胞数;取200 μl PBMC(或TMC)根据细胞计数结果,按试剂说明书加入相应剂量的细胞表面分子染色抗体,放入4℃冰箱避光孵育30 min;向每管中加入1 ml PBS进行重悬,室温、135 g离心5 min;向每孔加入200 μl PBS重悬后,流式细胞仪进行检测。
1.5 统计学方法采用GraphPad Prism 7软件进行统计学分析和制图。采用方差齐性检验判断两组间方差齐性,当两者间方差齐时,采用独立样本t检验比较两组间差异;方差不齐则采用t’检验;配对设计采用配对t检验;相关性分析采用Spearman相关性分析;P < 0.05为差异有统计学意义。
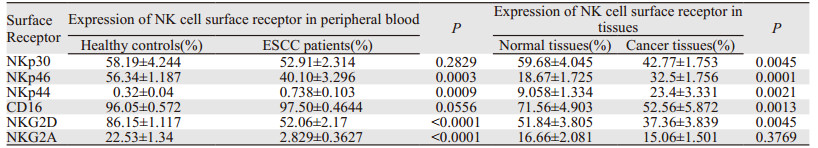
2 结果 2.1 食管鳞癌患者外周血和癌组织中NK细胞的分布食管鳞癌患者外周血中NK细胞比例与健康者之间比较差异无统计学意义((18.79±1.330)% vs.(16.47±1.100)%, P=0.1812),见图 1A;食管鳞癌组织中NK细胞比例明显高于正常组织((4.10±0.370)% vs.(2.48±0.430)%, P=0.0023),见图 1B。
|
| 图 1 NK细胞在食管鳞癌患者外周血(A)和组织(B)中的比例 Figure 1 Ratio of NK cells in peripheral blood(A) and cancer tissues(B) of ESCC patients |
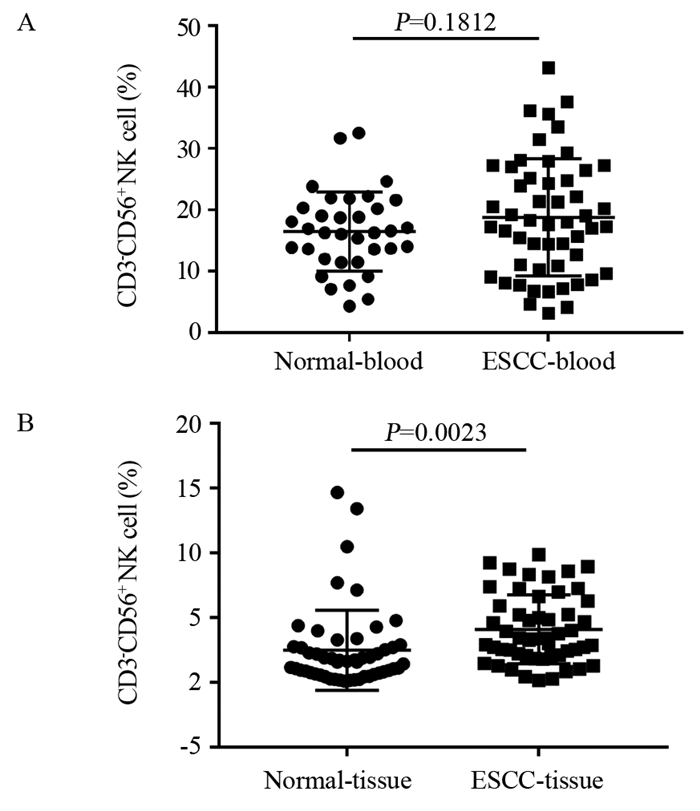
食管鳞癌患者外周血中NK细胞表面活化性受体NKp46、NKG2D的表达明显低于健康者,NKp44的表达明显高于健康者,NKp30、CD16的表达无明显差异;抑制性受体NKG2A的表达明显低于健康者,见表 1、图 2A。
|
| 图 2 食管鳞癌患者外周血(A)和组织(B)中NK细胞表面受体的表达 Figure 2 Expression of NK cells surface receptors in peripheral blood(A) and tissues(B) of ESCC patients |
活化性受体NKp30、CD16、NKG2D在食管鳞癌组织的表达明显低于正常组织;NKp44、NKp46在食管鳞癌组织中的表达明显高于正常组织。抑制性受体NKG2A在两者中的表达无明显差异,见表 1、图 2B。
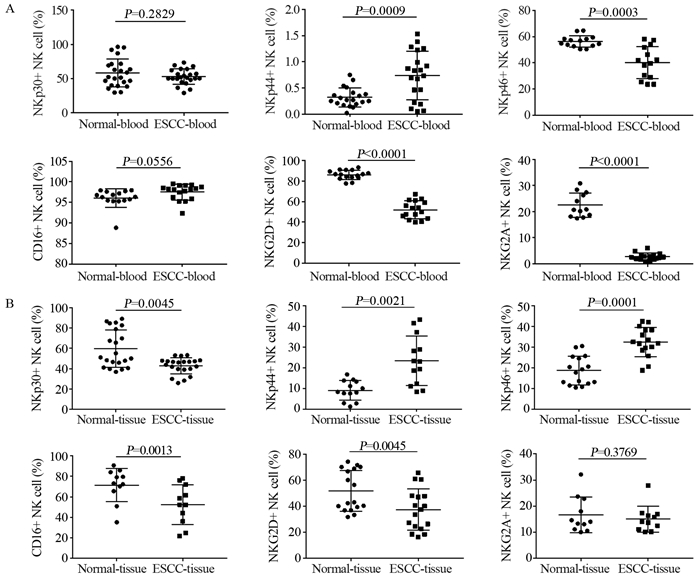
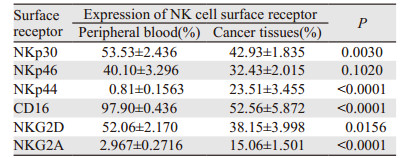
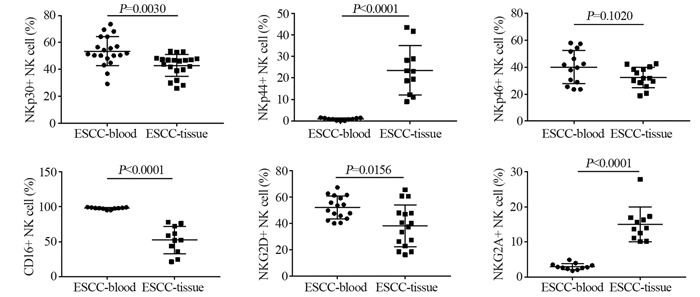
2.3 同一食管鳞癌患者外周血和癌组织中NK细胞表面受体分子表达情况分析同一患者外周血NK细胞和癌组织中浸润的NK细胞进行配对分析,比较两者表面受体表达差异。结果提示癌组织中的NK细胞活化性受体NKp44表达量较外周血明显升高(P < 0.0001),其他活化性受体NKp30、CD16、NKG2D在肿瘤组织中表达量均显著降低,差异有统计学意义(均P < 0.05),NKp46在肿瘤组织中表达量虽有下降,但差异无统计学意义(P=0.1020);抑制性受体NKG2A表达则明显升高,见表 2、图 3。
|
|
| 图 3 同一食管癌患者外周血和癌组织中NK细胞表面受体的表达 Figure 3 Expression of NK cells surface receptor in peripheral blood and cancer tissues of the same patient |
随着肿瘤进展,食管鳞癌患者外周血中NK细胞逐渐减少(r=-0.276; P=0.0476); 肿瘤侵袭程度越高癌组织中浸润的NK细胞越少(r=-0.2842; P=0.0412)。外周血与癌组织中浸润的NK细胞数与肿瘤进展成负相关,见图 4。

|
| 1: Stage Ⅰ; 2: Stage Ⅱ; 3:Stage Ⅲ; 4: Stage Ⅳ 图 4 食管鳞癌患者外周血和癌组织中NK细胞比例与TNM分期的相关性 Figure 4 Correlation between TNM staging and NK cell ratio in peripheral blood and cancer tissue of ESCC patients |
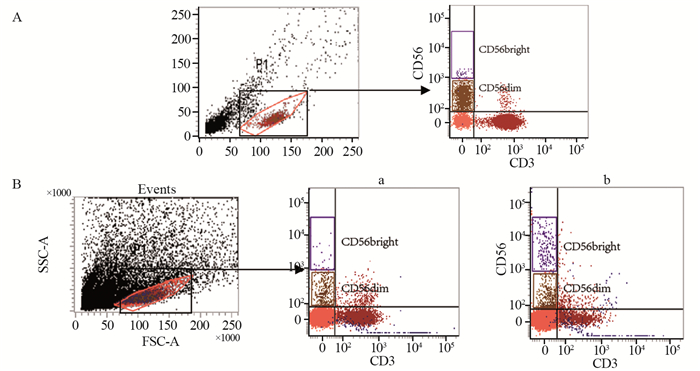
结果显示:食管鳞癌组织中NK细胞仍主要为CD56dim亚群细胞,见图 5。提示食管鳞癌组织中浸润的NK细胞与外周血中的NK细胞可能为同一亚群细胞。
|
| a: cancer tissues; b: normal tissues 图 5 食管鳞癌患者外周血(A)和组织(B)中NK细胞亚群分析 Figure 5 NK subsets in peripheral blood(A) and tissues(B) of ESCC patients |
肿瘤的发生、转移与肿瘤细胞逃避机体免疫监视密切相关[6]。NK细胞是天然免疫的重要组成部分,在机体免疫监视中起着重要的作用。相关研究结果显示:晚期小细胞肺癌患者外周血中NK细胞比例较健康者升高,提示细胞免疫已严重受损时,天然免疫可能成为晚期患者有力的补充[7]。汪茜茜[8]、刘启胜[9]等对食管癌患者外周血中NK细胞比例分析结果显示,食管癌患者外周血中NK细胞比例高于健康者。本研究结果与之一致,但可能因标本数量原因未能达到统计学差异。相关文献表明,NK细胞可通过细胞因子作用被募集到肿瘤微环境中,参与抗肿瘤作用[10]。由此推测食管鳞癌微环境可能从外周血中招募NK细胞到达肿瘤组织或可能刺激肿瘤微环境中NK细胞增殖,有待进一步研究。本研究结果提示食管鳞癌外周血及癌组织中浸润的NK细胞比例与肿瘤分期呈负相关,国内外学者研究结果发现外周血和食管癌组织中浸润的NK细胞比例均与肿瘤分期、良好的预后相关[11-12]。本研究结果与他们的报道相一致。
NK细胞的功能取决于其表面受体的表达情况[13]。NKp30、NKp44、NKp46组成了自然细胞毒受体家族(natural cytotoxicity receptors, NCR)是NK细胞表面重要的活化性受体,对NK细胞免疫功能起着重要的作用,其中NKp44仅表达于激活的NK细胞表面[14];CD16是NK细胞启动抗体依赖性细胞介导的细胞毒作用(ADCC)重要的活性受体[15];NKG2D同样作为NK细胞表面重要的活化性受体,相关文献报道肿瘤微环境中TGF-β对抑制该活性受体的表达有明显的下调作用[16]。NK细胞主要的抑制性受体NKG2A与NK细胞的成熟相关[17]。本研究结果表明:尽管食管鳞癌患者外周血中NKp44的表达明显高于健康者,但两者的表达量均不足1%,因为NKp44仅表达在激活的NK细胞表面,该结果提示食管鳞癌患者外周血中NK细胞可能并未被激活,而与NK细胞启动抗体依赖性细胞介导的细胞毒作用相关的、重要的活性受体CD16的表达两者并无差异,且均为高表达;提示食管鳞癌患者外周血中NK细胞未被激活且仍可能发挥正常的免疫功能。癌组织中检测结果表明:NKp44在食管鳞癌组织中的表达明显高于正常组织、CD16的表达量则明显低于正常组织;提示食管鳞癌组织中浸润的NK细胞被激活,但其细胞毒性作用可能减弱。
相关研究已经证实,人类外周血中NK细胞主要为CD56dim细胞,其CD16高表达,细胞毒活性强,以发挥杀伤功能为主;组织中NK细胞则主要为CD56bright细胞,其CD16低表达,以分泌细胞因子为主,两亚群细胞功能上存在差异[18]。本研究发现,食管鳞癌组织中NK细胞仍主要为CD56dim亚群细胞,提示食管鳞癌组织中浸润的NK细胞与外周血中的NK细胞可能为同一亚群细胞。外国学者[19]对肺癌患者NK细胞分析同样发现,外周血中NK细胞可被招募到肿瘤组织中,但肿瘤细胞可通过调解自身细胞因子的表达来降低被招募而来的NK细胞的细胞毒性。本研究通过对同一患者外周血及癌组织中NK细胞表面受体表达情况配对分析结果提示:当外周血中的NK细胞被招募到食管鳞癌组织中后被激活(NKp44的表达量从外周血中不足1%的表达,变为23%);但其CD16的表达量则被明显降低(在外周血中的表达为97.9%,在癌组织中则为52.56%),说明NK细胞的ADCC作用被削弱,同时其他活化性受体NKp30、NKp46、NKG2D在肿瘤组织中表达量也被降低,但抑制性受体NKG2A的表达则被增强。相关研究表明随着NK细胞的成熟,NKG2A在正常CD56dim亚群NK细胞中为低表达[20],说明癌组织中的NK细胞可能为不成熟的NK细胞或者肿瘤微环境可能逆转了NK细胞的成熟。因此推测,食管鳞癌患者外周血中NK细胞具有同健康者相同的免疫功能,当被招募到癌组织中后虽然能被激活,但其可能受到肿瘤微环境的影响表面受体表达失衡,其细胞毒性功能可能减弱,这可能介导食管鳞癌细胞发生肿瘤免疫逃逸。
综上,推测食管鳞癌组织中NK细胞表面受体表达失衡是导致其免疫功能减弱、介导食管鳞癌细胞发生免疫逃逸的原因之一,为进一步探讨食管鳞癌中NK细胞的免疫逃逸机制提供依据。
作者贡献
王超:标本收集、单细胞悬液研磨与采集、数据收集、整理、分析及论文书写
杨晓燕、高凤霞:标本收集与单细胞悬液研磨与采集
吴剑、戴天阳:指导课题、实验设计、论文书写指导
| [1] | Torre LA, Bray F, Siegel RL, et al. Global Cancer Statistics, 2012[J]. CA Cancer J Clin, 2015, 65(2): 87–108. DOI:10.3322/caac.21262 |
| [2] | Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115–132. DOI:10.3322/caac.21338 |
| [3] | Pasquali S, Yim G, Vohra RS, et al. Survival after neoadjuvant and adjuvant treatments compared to surgery alone for resectable esophageal carcinoma: a network meta-analysis[J]. Ann Surg, 2017, 265(3): 481–491. DOI:10.1097/SLA.0000000000001905 |
| [4] | Artis D, Spits H. The biology of innate lymphoid cells[J]. Nature, 2015, 517(7534): 293–301. DOI:10.1038/nature14189 |
| [5] | Lee HH, Kang H, Cho H. Natural killer cells and tumor metastasis[J]. Arch Pharm Res, 2017, 40(9): 1037–1049. DOI:10.1007/s12272-017-0951-9 |
| [6] | 刘方方, 谢军平. 肿瘤微环境中免疫细胞与肿瘤逃逸[J]. 医学分子生物学杂志, 2015(1): 21–25. [ Liu FF, Xie JP. Immune cells in tumor microenvironment and tumor immune escape[J]. Yi Xue Fen Zi Sheng Wu Xue Za Zhi, 2015(1): 21–25. DOI:10.3870/j.issn.1672-8009.2015.01.005 ] |
| [7] | 吴姗姗. 小细胞和非小细胞肺癌晚期患者NK细胞表达的差异[J]. 中国免疫学杂志, 2015, 31(2): 250–252. [ Wu SS. Different expression of NK cells in patients with advanced small cell lung cancer and non-small cell lung cancer[J]. Zhongguo Main Yi Xue Za Zhi, 2015, 31(2): 250–252. DOI:10.3969/j.issn.1000-484X.2015.02.025 ] |
| [8] | 汪茜茜, 毛朝明, 陈德玉. 食管鳞癌患者外周血NK细胞、γδ T细胞变化的临床意义[J]. 山东医药, 2011, 51(45): 39–40. [ Wang QQ, Mao CM, Chen DY. Clinical significance of NK cells and γ δ T cells changes in peripheral blood of patients with esophageal squamous cell carcinoma[J]. Shandong Yi Yao, 2011, 51(45): 39–40. DOI:10.3969/j.issn.1002-266X.2011.45.022 ] |
| [9] | 刘启胜, 杨志花, 卢学兵, 等. 食管癌患者NK细胞和T淋巴细胞免疫功能的检测及临床意义[J]. 现代消化及介入诊疗, 2016, 21(1): 1–3. [ Liu QS, Yang ZH, Lu XB, et al. Detection and clinical significance of NK cells and T lymphocytes immune function in the patients with esophageal cancer[J]. Xian Dai Xiao Hua Ji Jie Ru Zhen Liao, 2016, 21(1): 1–3. DOI:10.3969/j.issn.1672-2159.2016.01.001 ] |
| [10] | Cassetta L, Pollard JW. Cancer immunosurveillance: role of patrolling monocytes[J]. Cell Res, 2016, 26(1): 3–4. |
| [11] | 徐斌, 陈陆俊, 邓海峰, 等. CD57+自然杀伤细胞及CD68+巨噬细胞浸润密度对食管癌患者预后的影响[J]. 中华实验外科杂志, 2016, 33(4): 1117–1121. [ Xu B, Chen LJ, Deng HF, et al. Different density of CD57+ tumor-infiltrating natural killer cells and CD68+ tumor-infiltrating macrophages associated with the prognosis in patients with esophagus cancer[J]. Zhonghua Shi Yan Wai Ke Za Zhi, 2016, 33(4): 1117–1121. DOI:10.3760/cma.j.issn.1001-9030.2016.04.076 ] |
| [12] | Izawa S, Kono K, Mimura K, et al. H2O2 production within tumor microenvironment inversely correlated with infiltration of CD56dim NK cells in gastric and esophageal cancer: possible mechanisms of NK cell dysfunction[J]. Cancer Immunol Immunother, 2011, 60(12): 1801–1810. DOI:10.1007/s00262-011-1082-7 |
| [13] | Muntasell A, Ochoa MC, Cordeiro L, et al. Targeting NK-cell checkpoints for cancer immunotherapy[J]. Curr Opin Immunol, 2017, 45: 73–81. DOI:10.1016/j.coi.2017.01.003 |
| [14] | Pazina T, Shemesh A, Brusilovsky M, et al. Regulation of the functions of natural cytotoxicity receptors by interactions with diverse ligands and alterations in splice variant expression[J]. Front Immunol, 2017, 8: 369. |
| [15] | Schmohl JU, Felices M, Taras E, et al. Enhanced ADCC and NK Cell Activation of an Anticarcinoma Bispecific Antibody by Genetic Insertion of a Modified IL-15 Cross-linker[J]. Mol Ther, 2016, 24(7): 1312–1322. DOI:10.1038/mt.2016.88 |
| [16] | Lanier LL. NKG2D receptor and its ligands in host defense[J]. Cancer Immunol Res, 2015, 3(6): 575–582. DOI:10.1158/2326-6066.CIR-15-0098 |
| [17] | Kaur G, Trowsdale J, Fugger L. Natural killer cells and their receptors in multiple sclerosis[J]. Brain, 2013, 136(9): 2657–2676. DOI:10.1093/brain/aws159 |
| [18] | Melsen JE, Lugthart G, Lankester AC, et al. Human circulating and tissue-resident CD56(bright) natural killer cell populations[J]. Front Immunol, 2016(7): 262. |
| [19] | Carrega P, Bonaccorsi I, Di Carlo E, et al. CD56(bright)perforin(low) noncytotoxic human NK cells are abundant in both healthy and neoplastic solid tissues and recirculate to secondary lymphoid organs via afferent lymph[J]. J Immunol, 2014, 192(8): 3805–3815. DOI:10.4049/jimmunol.1301889 |
| [20] | Béziat V, Descours B, Parizot C, et al. NK cell terminal differentiation: correlated stepwise decrease of NKG2A and acquisition of KIRs[J]. PLoS One, 2010, 5(8): e11966. DOI:10.1371/journal.pone.0011966 |
 2019, Vol. 46
2019, Vol. 46