文章信息
- 外周血NLR、PLR对胃肠胰神经内分泌肿瘤的诊断价值
- Diagnostic Value of Peripheral Blood NLR and PLR in Gastrointestinal Pancreatic Neuroendocrine Neoplasm
- 肿瘤防治研究, 2019, 46(8): 724-728
- Cancer Research on Prevention and Treatment, 2019, 46(8): 724-728
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.19.0009
- 收稿日期: 2019-01-04
- 修回日期: 2019-06-19
2. 210009 南京,东南大学附属中大医院消化科
2. Department of Gastroenterology, The Affiliated Zhong Da Hospital of Southeast University, Nanjing 210009, China
神经内分泌肿瘤是起源于肽能神经元及神经内分泌细胞的一组少见异质性肿瘤,可发生于全身多处器官,其中以胃肠胰神经内分泌瘤最常见[1]。由于消化内镜技术进展及对该疾病认识加深,美国一项基于全国人群数据的回顾性研究显示截至2012年胃肠胰神经内分泌肿瘤患者(gastrointestinal pancreatic neuroendocrine neoplasm, GEP-NENs)发病率(6.98/10万)较1973年(1.09/10万)已增加了6.4倍[2]。近年来,国内对GEP-NENs报道逐渐增多,一项单中心对成都地区流行病学调查数据显示,GEP-NENs发病率呈逐渐上升趋势[3]。由于GEP-NENs的症状和体征不典型,临床表现多样,且内镜下缺乏典型的诊断特征,主要通过组织病理学和免疫组织化学明确诊断[4],但由于此方法检测成本高,且对实验室技术要求严格,因此近年来多项研究旨在探寻更简便易行的诊断方法。全身炎性反应及免疫应答与肿瘤发展密切相关,外周血中性粒细胞与淋巴细胞比值(neutrophil-to-lymphocyte ratio, NLR)及血小板与淋巴细胞比值(platelet-to-lymphocyte ratio, PLR)作为重要的炎性反应指标,已被多次报道与胃肠道及妇科肿瘤诊断及预后相关。本研究通过测定95例GEP-NENs患者外周血NLR、PLR水平,探讨其在GEP-NENs患者中的诊断价值。
1 资料与方法 1.1 一般资料选取2013年3月—2018年9月就诊于东南大学附属中大医院经病理及免疫组织化学证实为GEP-NENs患者共95例,排除合并血液系统疾病、感染、近期使用促白细胞及血小板药物及其他肿瘤病史。其中男53例、女42例,年龄22~80岁,平均(55.81±13.88)岁。选取慢性浅表性胃炎患者97例,其中男54例、女43例,年龄22~89岁,平均(57.24±14.15)岁,另外选取健康体检者106例为正常对照组,其中男62例、女44例,年龄32~74岁,平均(56±11.22)岁。三组性别、年龄比较,差异无统计学意义(P=0.900、0.711)。
1.2 主要仪器及试剂采集受试者清晨空腹静脉血2 ml于EDTA-K2抗凝管中混匀,4 h内使用日本SYSMEX公司生产的XE-2100血细胞分析仪及其配套试剂检测血细胞参数,采用EXCEL表格分别计算NLR及PLR。
1.3 判断标准ROC曲线下面积(AUC)≤0.5表示试验无诊断价值;0.5 < AUC≤0.7表示诊断准确性较低;0.7 < AUC≤0.9表示诊断准确性中等;0.9 < AUC≤1.0表示诊断具有较高的准确性。以最大约登(Youden)指数对应的NLR/PLR检测值作为cut-off值,Youden指数=敏感度+特异性-1。采用美国癌症协会(AJCC)提出的TNM分期(2010年第7版)方法对GEP-NENs进行分期[5]。采用2010年WHO消化系统肿瘤分类方法将NENs分为3级[6]:G1级,核分裂相数 < 2/10高倍视野和(或)Ki67指数≤2%;G2级,核分裂相数2~20/10高倍视野和(或)Ki67指数3%~20%;G3级,核分裂相数 > 20/10高倍视野和(或)Ki67指数 > 20%。GEP-NENs按发病部位分为前肠、中肠及后肠,前肠指肿瘤发生于食管、胃、十二指肠及胰腺;中肠指肿瘤发生于阑尾、空/回肠、盲肠及升结肠;后肠指肿瘤发生于远端大肠及直肠。
1.4 统计学方法所有数据经SPSS20.0统计软件分析处理,计量资料以(x±s)表示,组间比较采用独立样本t检验、方差分析及Kruskal-Wallis检验,率的比较采用Fisher精确检验及χ2检验。采用ROC曲线评价NLR及PLR对GEP-NENs的诊断价值。NLR、PLR与肿瘤分级相关性分析采用Spearman检验。P < 0.05为差异有统计学意义。
2 结果 2.1 各组间外周血NLR及PLR比较GEP-NENs组、慢性胃炎组及健康对照组的NLR分别为(2.51±1.32)、(2.47±1.28)、(1.75±0.59);三组的PLR分别为(148.25±72.99)、(140.11±47.8)、(112.65±39.4)。GEP-NENs组NLR和PLR均高于慢性胃炎组及健康对照组,差异有统计学意义(H=27.08、26.31, P < 0.01),见图 1。此外,慢性胃炎组NLR和PLR也明显高于健康对照组(t=5.14、4.48, P < 0.01)。
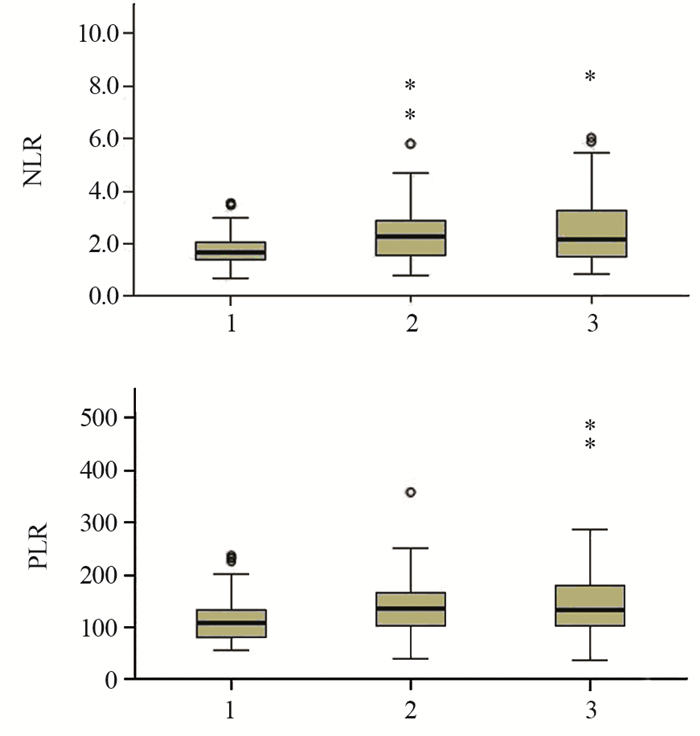
|
| 1: Healthy physical examination group; 2: Chronic gastritis group; 3: GEP-NENs group; GEP-NENs: gastrointestinal pancreatic neuroendocrine neoplasm; NLR: neutrophil-to-lymphocyte ratio; PLR: platelet-to-lymphocyte ratio; 。: the outlier between 1.5 and 3 times of quartile range; *: the extrema greater than 3 times of quartile range; NLR: neutrophil-to-lymphocyte ratio; PLR: platelet-to-lymphocyte ratio 图 1 三组外周血中性粒细胞与淋巴细胞比值和血小板与淋巴细胞比值比较 Figure 1 Comparison of peripheral blood NLR and PLR among three groups |
NLR的曲线下面积(AUC)为0.674,95%CI: 0.598~0.750,诊断界值为2.24,Youden指数为0.34,敏感度为48%,特异性为86%;PLR的AUC为0.671,95%CI: 0.596~0.747,诊断界值为156.85,Youden指数为0.30,敏感度为41%,特异性为89%。见图 2。
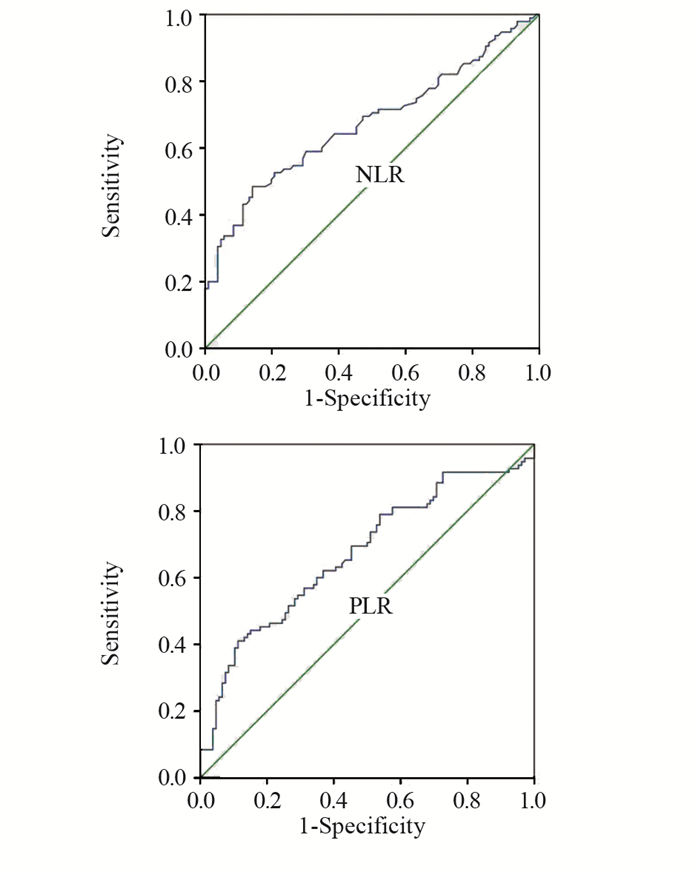
|
| 图 2 外周血NLR、PLR诊断胃肠胰神经内分泌肿瘤的ROC曲线图 Figure 2 ROC curves of peripheral blood NLR and PLR in diagnosis of gastrointestinal pancreatic neuroendocrine neoplasm |
根据2010年WHO消化系统肿瘤分类方法将NENs分为3级,其中G1级61例,外周血NLR水平为(2.44±85.42),PLR水平为(141.99±69.38);G2级14例,外周血NLR水平为(2.15±1.23),PLR水平为(132.29±52.34);G3级20例,外周血NLR水平为(2.99±1.4),PLR水平为(178.55±89.46)。经Spearman相关性分析显示,GEP-NENs患者外周血NLR、PLR与肿瘤分级无明显相关性(P=0.287, r=0.110; P=0.136, r=0.154),见图 3。以NLR及PLR诊断GEP-NENs界值2.24及156.85为依据,将GEP-NENs患者分为高值组和低值组,高NLR值及低NLR值组分别为46及49例,高PLR值及低PLR值组分别为39及56例。经卡方检验结果显示,NLR及PLR与GEP-NENs各临床病理参数无明显相关性(P > 0.05),见表 1。

|
| 图 3 NLR、PLR与GEP-NENs患者病理分级的相关性 Figure 3 Correlation between NLR, PLR and pathological grade of GEP-NENs patients |
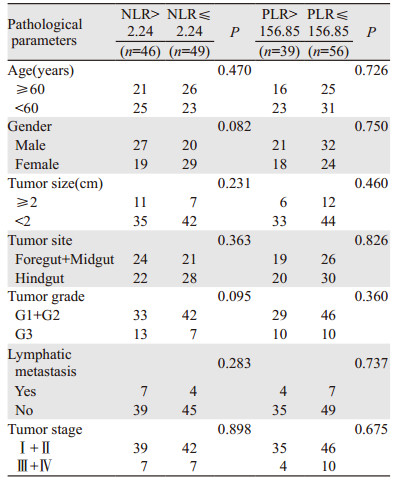
|
NLR及PLR作为炎性反应系统的标志物,近年来已被证实在肿瘤的发生、发展以及淋巴结转移中扮演着重要的角色,可作为肿瘤患者预后的因素。NLR及PLR值升高往往与人类多种肿瘤的晚期及预后不良相关[7-9]。炎性反应时通过炎性细胞释放炎性介质、上调各种细胞因子、改善肿瘤微环境,进而促进肿瘤细胞增殖、抑制凋亡以及诱导肿瘤细胞侵袭和转移。此外,机体在炎性反应时可通过未成熟的骨髓源性抑制细胞释放一系列抑制性的免疫介质[10],导致机体免疫功能紊乱及肿瘤免疫逃逸,影响造血系统功能,这一系列改变可体现在肿瘤患者外周血NLR、PLR值变化上。
肿瘤组织产生的趋化因子可将血液循环中的中性粒细胞吸引到肿瘤组织内,这些浸润的中性粒细胞被称为肿瘤相关中性粒细胞(tumor-associated neutrophils, TAN)[11],TAN可合成并分泌IL-1、IL-8、IL-12及TNF-α参与调控肿瘤发生发展[12]。肿瘤的免疫清除、免疫自稳、免疫逃逸理论,提示机体免疫可能在肿瘤病理过程中发挥着重要的作用。淋巴细胞是机体的重要免疫细胞之一,主要介导细胞免疫。肿瘤浸润淋巴细胞(tumor infiltrating lymphocyte, TIL)是参与肿瘤局部免疫反应的主要细胞之一,通过CD4+及CD8+发挥抗肿瘤作用。此外,机体通过增加血小板数量和活性在恶性肿瘤的形成、转移过程中发挥作用。近年来研究表明血小板可促进肿瘤细胞生长、提高肿瘤细胞侵袭潜力、促进癌细胞在血管中黏附滞留及转移、协助肿瘤细胞免疫逃逸、促进肿瘤血管生成并稳定血管[13]。NLR、PLR作为全身炎性反应的观察指标,可用于检测体内抗肿瘤和促肿瘤的免疫动态平衡。
本研究结果显示,GEP-NENs组NLR及PLR均高于慢性胃炎组及健康对照组(P < 0.01),而且慢性胃炎组NLR及PLR也明显高于健康对照组(P < 0.01),提示外周血NLR及PLR变化趋势与机体良恶性病变程度相关。ROC曲线分析显示,NLR的AUC为0.674,敏感度为48%,PLR的AUC为0.671,敏感度为41%,提示外周血NLR及PLR对GEP-NENs诊断准确性及阳性率均较低。此外,本研究中NLR及PLR与GEP-NENs患者肿瘤大小、分期、分级、淋巴结转移等病理参数无相关性,与马欣俐[14]等报道外周血NLR及PLR与GEP-NENs病理分型无关一致,提示NLR及PLR与GEP-NENs的病情严重程度及恶性进展无关。Zhou等[8]报道的荟萃分析显示NLR值升高提示GEP-NENs预后较差(OS: P < 0.01, 95%CI: 1.96~4.76; RFS: P < 0.01, 95%CI: 2.04~5.32),而本研究显示NLR及PLR与肿瘤患者病理分期及分级均无明显联系,故未行进一步预后分析;且Zhou报道的荟萃分析纳入患者多为胰腺神经内分泌肿瘤(pNENs),而本研究中胰腺神经内分泌肿瘤患者仅占11.58%(11/95),如进一步论证NLR及PLR与GEP-NENs患者预后相关性,需进一步扩大样本量及采用前瞻性匹配的研究设计。
肿瘤可促进机体产生一系列非特异性炎性反应,导致炎性反应及抗炎反应间失去平衡,使炎性反应向着促进肿瘤方向发展。外周血NLR及PLR是一类非特异性炎性反应,只需采集患者外周血进行血常规参数分析即可获得,简单便捷且不增加患者痛苦。既往多项研究表明外周血NLR及PLR水平升高与胃肠道肿瘤预后不佳具有相关性,因此推荐将NLR及PLR应用于肿瘤患者临床诊疗及病情评估,甚至提出通过抑制血小板对肿瘤细胞进行靶向治疗。本研究回顾性分析外周血NLR及PLR检测在GEP-NENs中的诊断价值,结果提示NLR及PLR对GEP-NENs诊断的准确性及敏感度均较低,且对肿瘤分期及分级无明显预测性,通过检测血常规计算NLR及PLR诊断GEP-NENs无明显参考价值。期待未来更大样本量、多中心、前瞻性研究进一步探索术前外周血NLR及PLR在GEP-NENs中应用价值。
作者贡献
赵冉:收集临床资料及撰写论文
施瑞华:修订及写作审核
| [1] | Ellis L, Shale MJ, Coleman MP. Carcinoid tumors of the gastrointestinal tract: trends in incidence in England since 1971[J]. Am J Gastroenterol, 2010, 105(12): 2563–2569. DOI:10.1038/ajg.2010.341 |
| [2] | Dasari A, Shen C, Halperin D, et al. Trends in the Incidence, Prevalence, and Survival Outcomes in Patients With Neuroendocrine Tumors in the United States[J]. JAMA Oncol, 2017, 3(10): 1335–1342. DOI:10.1001/jamaoncol.2017.0589 |
| [3] | Guo LJ, Wang CH, Tang CW. Epidemiological features of gastroenteropancreatic neuroendocrine tumors in Chengdu city with a population of 14 million based on data from a single institution[J]. Asia Pac J Clin Oncol, 2016, 12(3): 284–288. DOI:10.1111/ajco.12498 |
| [4] | 罗文浩, 吴小冉, 历周. 胃肠胰神经内分泌肿瘤的最新共识[J]. 肿瘤防治研究, 2018, 45(1): 41–46. [ Luo WH, Wu XR, Li Z. Research progress of gastroenteropancreatic neuroendocrine neoplasm[J]. Zhong Liu Fang Zhi Yan Jiu, 2018, 45(1): 41–46. DOI:10.3971/j.issn.1000-8578.2018.17.0491 ] |
| [5] | Edge SB, Compton CC. The American Joint Committee on Cancer: the 7th edition of the AJCC cancer staging manual and the future of TNM[J]. Ann Surg Oncol, 2010, 17(6): 1471–1474. DOI:10.1245/s10434-010-0985-4 |
| [6] | Bosman F, Carneiro F, Hruban R, et al. WHO Classification of Tumors of the Digestive System[M]. Lyon, France: IARC Press, 2010. |
| [7] | Azab B, Mohammad F, Shah N, et al. The value of the pretreatment neutrophil lymphocyte ratio vs. Platelet lymphocyte ratio in predicting the long-term survival in eolorectal cancer[J]. Cancer Biomark, 2014, 14(5): 303–312. DOI:10.3233/CBM-140416 |
| [8] | Zhou Y, Li D, Lin Y, et al. Pretreatment hematologic markers as prognostic predictors of Gastroenteropancreatic neuroendocrine tumors: a systematic review and meta-analysis[J]. Onco Targets Ther, 2018, 11: 2489–2496. DOI:10.2147/OTT.S152657 |
| [9] | Azab B, Bhatt VR, Phookan J, et al. Usefulness of the neutrophil-to-lymphocyte ratio in predicting short-and long-term mortality in breast cancer patients[J]. Ann Surg Oncol, 2012, 19(1): 217–224. DOI:10.1245/s10434-011-1814-0 |
| [10] | Baniyash M, Sade-Feldman M, Kanterman J. Chronic inflammation and cancer: suppressing the suppressors[J]. Cancer Immunol Immunother, 2014, 63(1): 11–20. |
| [11] | Shen M, Hu P, Donskov F, et al. Tumor-associated neutrophils as a new prognostic factor in cancer:a systematic review and meta-analysis[J]. PLoS One, 2014, 9(6): e98259. DOI:10.1371/journal.pone.0098259 |
| [12] | Sionov RV, Assis S, Gershkovitz M, et al. Isolation and characterization of neutrophils with anti-tumor properties[J]. J Vis Exp, 2015, 19(100): e52933. |
| [13] | 王爱云, 曹玉珠, 韦忠红, 等. 血小板促进肿瘤生长与转移机制研究进展[J]. 中国药理学通报, 2018, 34(8): 1045–1049. [ Wang AY, Cao YZ, Wei ZH, et al. Platelets promoting tumor growth and metastasis[J]. Zhongguo Yao Li Xue Tong Bao, 2018, 34(8): 1045–1049. DOI:10.3969/j.issn.1001-1978.2018.08.003 ] |
| [14] | 马欣俐, 赵文毅, 庄淳, 等. 119例胃肠道神经内分泌肿瘤的病理分型及预后危险因素分析[J]. 中华胃肠外科杂志, 2017, 20(9): 997–1001. [ Ma XL, Zhao WY, Zhuang C, et al. Clinicopathological classification and prognostic factors of gastrointestinal neuroendocrine neoplasms: an analysis of 119 cases[J]. Zhonghua Wei Chang Wai Ke Za Zhi, 2017, 20(9): 997–1001. DOI:10.3760/cma.j.issn.1671-0274.2017.09.009 ] |
 2019, Vol. 46
2019, Vol. 46


