文章信息
- 尼妥珠单抗联合PF方案诱导治疗局部晚期鼻咽癌的多中心临床研究
- Multi-center Clinical Study of Nimotuzumab Combined with PF Regimen in Induction Treatment of Locally Advanced Nasopharyngeal Carcinoma
- 肿瘤防治研究, 2019, 46(4): 358-362
- Cancer Research on Prevention and Treatment, 2019, 46(4): 358-362
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.18.2031
- 收稿日期: 2018-12-29
- 修回日期: 2019-01-30
2. 546002 梧州, 梧州市红十字会医院放疗科;
3. 545001 柳州, 柳州市人民医院放疗科;
4. 530021 南宁, 广西医科大学第一附属医院放疗科;
5. 530037 南宁, 广西医科大学第二附属医院放疗科;
6. 530031 南宁, 南宁市第二人民医院放疗科;
7. 545001 柳州, 柳州市中医医院肿瘤科;
8. 541001 桂林, 桂林医学院附属医院放疗科
2. Radiotherapy Department, Wuzhou Red Cross Hospital, Wuzhou 546002, China;
3. Radiotherapy Department, Liuzhou People's Hospital, Liuzhou 545001, China;
4. Radiotherapy Department, The First Affiliated Hospital of Guangxi Medical University, Nanning 530021, China;
5. Radiotherapy Department, The Second Affiliated Hospital of Guangxi Medical University, Nanning 530037, China;
6. Radiotherapy Department, The Second Nanning People's Hospital, Nanning 530031, China;
7. Oncology Department, Liuzhou Traditional Chinese Medical Hospital, Liuzhou 545001, China;
8. Radiotherapy Department, The Affiliated Hospital of Guilin Medical University, Guilin 541001, China
鼻咽癌是中国南方地区常见恶性肿瘤之一,具有较好的放化疗敏感度。以放疗为基础的放化疗综合治疗是局部晚期鼻咽癌的推荐治疗。诱导化疗可以为局部晚期鼻咽癌患者创造更好的放射治疗条件,可以降低微瘤转移风险,常应用于临床。但是,最佳的诱导治疗方案尚不确定。与PF方案(顺铂+氟尿嘧啶)比较,TPF方案(多西他赛+顺铂+氟尿嘧啶)尽管有较高的缓解率,但因其有更高的治疗相关毒性,影响了其在临床的应用。本研究在诱导治疗阶段引入低毒、有效的抗表皮生长因子受体(epidermal growth factor receptor, EGFR)单抗组成联合治疗方案,通过多中心随机对照研究,与TPF比较,探讨尼妥珠单抗联合PF方案的诱导治疗在临床应用中的可行性及价值。
1 资料与方法 1.1 病例选择广西医科大学第四附属医院、梧州市红十字会医院、柳州市人民医院、广西医科大学第一附属医院、广西医科大学第二附属医院、南宁市第二人民医院、柳州市中医医院、桂林医学院附属医院就诊的初治鼻咽癌患者。入选标准:(1)年龄18~70岁;(2)经原发灶活检,首次病理诊断为未分化型鼻咽非角化癌;(3)临床分期Ⅲ~Ⅳa期(2008年中国分期);(4)KPS评分≥70;(5)血清血红蛋白10 mg/dL,血小板100 000/μl,中性粒细胞绝对计数1500/μl;(6)血清肌酐≤1.5倍UNL或肌酐清除率≥60 ml/min;(7)血清胆红素≤1.5倍UNL,AST(SGOT)和ALT(SGPT)≤1.5倍UNL;(8)预计总生存期 > 6月;(9)签署知情同意书。排除标准:(1)既往诊断为恶性肿瘤;(2)既往接受过放射治疗或化疗、靶向治疗;(3)存在放射治疗、化疗禁忌证;(4)对方案中任意药物存在过敏。
经广西医科大学第四附属医院伦理委员讨论通过(PJK2015201);中国临床试验注册(注册号ChiCTR-OIC-16008201)。
1.2 治疗方法符合入选标准的鼻咽癌患者采用随机数表分为两组:NPF组,接受尼妥珠单抗联合PF方案诱导治疗(尼妥珠单抗200毫克/(次·周), 静脉滴注;顺铂75 g/m2,静脉滴注,d1;氟脲嘧啶750 mg/(m2·d),持续泵注,d1~5;每3周重复);TPF组,接受TPF方案诱导化疗(多西他赛75 g/m2,静脉滴注,d1;顺铂75 g/m2,静脉滴注,d1;氟脲嘧啶750 mg/(m2·d),持续泵注,d1~5;每3周重复);诱导治疗2周期后,进行顺铂(顺铂80 g/m2,静脉滴注,d1;每3周重复,共3周期)同期的调强放射治疗(IMRT)。首程诱导治疗或同期化疗前不预防性给予G-CSF治疗;对于已经出现4级中性粒细胞下降的患者,后续周期治疗时,预防性应用G-CSF升白细胞治疗;仍不能耐受的患者,根据化疗药物减量原则调整方案。所有化疗周期常规给予止吐治疗,并根据胃肠道反应情况调整后续周期止吐方案。
所有患者的IMRT治疗,根据磁共振(MR)确定肿瘤范围,增强CT上勾画靶区、计划设计。按各中心实际情况,各靶区外扩3~5 mm形成的PTV给予处方剂量:鼻咽肿瘤体积(GTVnx)和颈部淋巴结体积(GTVnd)69.69~70.06 Gy和64.17~70.06 Gy,原发灶高危区(CTV1)66.03 Gy,原发灶低危区和颈部淋巴结引流区(CTV2)50.4~54.25 Gy;分割次数31~33次,每周治疗5次。根据放射治疗协作组(RTOG)0615和RTOG 0225的要求进行危及器官限制剂量和计划评估。
1.3 评价标准按实体瘤疗效评价标准(RECIST 1.1版)进行疗效评价,参照RTOG急性、晚期放射反应评分标准进行放疗急性、晚期不良反应评价;按照NCI-CTC AE3.0常见药物不良反应分级标准进行化疗相关不良反应评价。
1.4 统计学方法根据非劣效研究,采用α=0.05,β=0.20,10%的脱落率进行样本量计算。采用SPSS19.0软件进行统计分析,描述性分析计数资料,统计学分析方法计量资料采用t检验,计数资料的比较采用χ2检验,组间比率采用χ2检验,P < 0.05为差异有统计学意义。
2 结果 2.1 临床资料2015年5月—2017年11月共纳入118例患者进行研究分析。所有患者平均年龄44岁(22~68岁);男98例,女20例,男:女=4.9:1;Ⅲ期66例,Ⅳa期52例。其中,NPF组58例,TPF组60例,两组患者的年龄、性别、临床分期等基线特征差异无统计学意义(P > 0.05),见表 1。
|
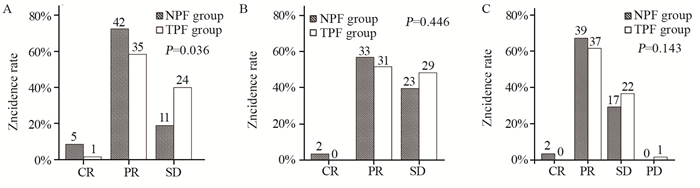
至2018年5月,所有患者均完成诱导治疗及治疗后疗效评价。诱导治疗阶段:与TPF比较,NPF的诱导治疗对于颈部淋巴结有更显著的疗效(P=0.036),缓解率(CR+PR)更高(81% vs. 60%);而鼻咽原发病灶及总体(鼻咽原发病灶+颈部淋巴结)疗效差异无统计学意义(P=0.446, P=0.143),见图 1。TPF组诱导化疗后有1例出现肺转移,退出研究。117例患者完成顺铂同期IMRT治疗,NPF组58例,TPF组59例。全程治疗(诱导治疗+同期放化疗)结束的即刻疗效评价:NPF组CR 39例(67.2%),PR 19例(32.8%);TPF组CR 38例(64.4%),PR 21例(35.6%);两组疗效比较差异无统计学意义(P=0.449)。
|
| 图 1 两组局部晚期鼻咽癌患者诱导治疗后疗效评价比较 Figure 1 Comparison of curative effects between two groups of locally advanced nasopharyngeal carcinoma patients after induction therapy |
诱导治疗阶段,两组不良反应均主要表现为1~2级中性粒细胞下降及胃肠道反应。与TPF组比较,NPF组的中性粒细胞减少、胃肠道反应显著改善,差异有统计学意义(P=0.028; P=0.049);皮疹仅出现在NPF组(P=0.012),但均为1级,尼妥珠单抗治疗结束后可自行消退;血红蛋白下降、血小板减少、肝肾功能损害及口腔黏膜炎方面,差异均无统计学意义(P > 0.05)。同期放化疗阶段,NPF组显示了更好的治疗耐受性,胃肠道反应、口腔黏膜炎、放射性皮炎较TPF组改善,差异有统计学意义(P=0.038; P=0.041; P=0.035),白细胞下降、血小板减少、肝肾功能损害程度更轻,但差异均无统计学意义(P > 0.05),见表 2。两组均无因不良反应调整治疗方案的患者。
|
以放疗为基础的放化疗综合治疗是局部晚期鼻咽癌的推荐治疗方法。诱导化疗可以有效为局部晚期鼻咽癌,尤其是巨大病灶患者创造更好的放射治疗条件,提高治疗反应率,同时可能降低局部复发和远处转移率。因此,诱导化疗联合同期放化疗成为中国专家共识对于局部晚期鼻咽癌的ⅡB类治疗推荐方案[1]。但是,最佳的诱导治疗方案尚未明确。
由多西他赛、顺铂和5-氟脲嘧啶组成的TPF方案与PF方案比较,有较好的临床缓解率,是NCCN头颈鳞癌诊疗指南中的Ⅰ类推荐,被沿用于鼻咽癌的诱导治疗,但一直存在争议。近期相关研究进一步探讨了TPF诱导化疗在鼻咽癌中的作用[2-5]。Sun等[2]多中心随机对照研究显示:虽然与同期放化疗比较,TPF诱导化疗联合同期放化疗的无局部复发生存率(LRFS)、放疗结束4月后的总反应(RR)率和完全缓解(CR)率,差异无统计学意义(P > 0.05);但可以有效地提高Ⅲ~ⅣB期局部晚期鼻咽癌患者的3年总生存(OS)率(92% vs. 86%, P=0.029)、无瘤生存(DFS)率(80% vs. 72%, P=0.034)、无远处转移生存(DMFS)率(90% vs. 83%, P=0.031)。Kong等[3]研究同样显示:同期放化疗基础上,TPF方案的诱导化疗可以提高局部晚期鼻咽癌的疗效;但TPF方案在取得更高缓解率同时毒性反应发生率显著增加,特别是3~4级中性粒细胞的下降,影响了TPF在临床上的应用。而马雄辉等[4]则认为:尽管TPF诱导化疗的缓解率高于PF(91.3% vs. 65.5%, P=0.001),但5年OS率无显著差异(87.6% vs. 85.34%, P=0.274),且3~4级不良反应明显增加,不建议在鼻咽癌治疗中推广。
随着分子生物机制研究的不断深入,分子靶向治疗成为肿瘤治疗研究热点。EGFR在鼻咽癌中的表达率为68%~89%,远高于其他实体肿瘤[6],与鼻咽癌患者的预后密切相关[7-8]。Peng等[9]回顾性配对分析提示:对于后续接受IMRT治疗的局部晚期鼻咽癌,联合抗EGFR受体治疗的诱导化疗可能是一种更有效的策略。尼妥珠单抗为人源化单克隆抗体,能够竞争性抑制内源性配体与EGFR的结合,阻断由EGFR介导的下游信号转导通路,从而抑制肿瘤细胞增殖、促进肿瘤细胞凋亡、抑制血管生成以及增加放化疗敏感度;由于人源化、高选择性等特点,与西妥昔单抗相比,尼妥珠单抗不良反应更小,皮疹发生率更低。全国多中心Ⅱ期临床研究[10]显示:与单纯放射治疗比较,尼妥珠单抗联合放射治疗显著提高局部晚期鼻咽癌患者的3年OS(77.61% vs. 84.3%, P < 0.05)。因此,2009年4月尼妥珠单抗进入NCCN头颈部肿瘤指南中国版。Kong等[11]2016年美国临床肿瘤学会(American Society of Clinical Oncology, ASCO)年会报道了Ⅲ~Ⅳb期鼻咽癌诱导化疗后,尼妥珠单抗联合IMRT与顺铂联合IMRT治疗的Ⅲ期前瞻性临床研究的中期分析:尼妥珠单抗联合IMRT治疗的3~4级胃肠道反应、2级以上血液毒性的发生率显著低于顺铂联合IMRT治疗(4.2% vs. 33.7%; 9.7% vs. 49.0%),而3年的DFS和OS相近(93.5% vs. 94.8%; 79.8% vs. 83.5%)。Wang等[12]回顾性分析显示:尼妥珠单抗联合诱导化疗后序贯同期放化疗在局部晚期鼻咽癌的治疗中有效且耐受性良好,诱导阶段3~4级的中性粒细胞下降的发生率为11.4%,2.9%的患者出现了轻微的肝功能损害。但缺乏尼妥珠单抗在诱导治疗阶段的前瞻性应用研究数据。本项多中心前瞻研究中,尼妥珠单抗与PF方案的联合诱导治疗,在局部晚期鼻咽癌的诱导阶段获得了较好的治疗反应率。尽管与TPF的诱导化疗比较,NPF方案诱导治疗在总体的缓解率及原发灶的缓解率方面未能显示显著优势;但对于颈部淋巴结却有更好的疗效优势(P=0.036)及更高的缓解率(81% vs. 60%)。由于降低了化疗强度,NPF方案诱导治疗也有效降低了化疗相关的血液毒性及胃肠道反应,与Wang等[12]研究结果一致。此外,NPF方案诱导治疗的不良反应显著减轻的优势,还进一步提高了后续同期放化疗阶段的耐受性,增加了患者的治疗依从性,可能有益于后续远期生存。
综上,对于后续接受同期放化疗的局部晚期鼻咽癌,与TPF诱导化疗比较,尼妥珠单抗联合PF方案的诱导治疗具有更好的淋巴结缓解率,且不良反应更轻微;患者在后续的同期放化疗中耐受性更好。但由于随访期较短,远期生存获益需要进一步随访观察。
作者贡献
陆颖: 研究设计、项目实施及质量控制、数据整理及论文书写
陈达桂: 项目实施、数据收集整理
梁锦辉、高健全、罗展雄、王仁生、刘文其、黄昌杰、宁雪坚、刘美莲: 各个分中心研究实施和质量控制、数据收集
黄海欣: 研究设计及质量控制、数据及论文审核
| [1] | Lang J, Gao L, Guo Y, et al. Comprehensive treatment of squamous cell cancer of head and neck: hinese expert consensus 2013[J]. Future Oncol, 2014, 10(9): 1635–48. DOI:10.2217/fon.14.44 |
| [2] | Sun Y, Li WF, Chen NY, et al. Induction chemotherapy plus concurrent chemoradiotherapy versus concurrent chemoradiotherapy alone in locoregionally advanced nasopharyngeal carcinoma: a phase 3, multicentre, randomised controlled trial[J]. Lancet Oncol, 2016, 17(11): 1509–20. DOI:10.1016/S1470-2045(16)30410-7 |
| [3] | Kong L, Zhang Y, Hu C, et al. Effects of Induction Docetaxel, Platinum, and Fluorouracil Chemotherapy in Patients With Stage Ⅲ or ⅣA/B Nasopharyngeal Cancer Treated With Concurrent Chemoradiation Therapy: Final Results of 2 Parallel Phase 2 Clinical Trials[J]. Cancer, 2017, 123(12): 2258–67. DOI:10.1002/cncr.v123.12 |
| [4] | 马雄辉, 梁彩霞, 江丹贤, 等. TPF诱导化疗或PF诱导化疗联合同期放化疗治疗局部晚期鼻咽癌的临床观察[J]. 中国癌症杂志, 2016, 26(12): 1018–24. [ Ma XH, Liang CX, Jiang DX, et al. Clinical observation of TPF induction chemotherapy versus PF induction chemotherapy combined with concurrent chemoradiotherapy for the treatment of locoregionally advanced nasopharyngeal carcinoma[J]. Zhongguo Ai Zheng Za Zhi, 2016, 26(12): 1018–24. ] |
| [5] | 杨佑琦, 区晓敏, 周鑫, 等. GP、PF及TPF方案化疗联合调强适形放疗治疗鼻咽癌的临床疗效[J]. 中国癌症杂志, 2018, 28(8): 602–8. [ Yang YQ, Ou XM, Zhou X, et al. Clinical efficacy of GP, PF and TPF chemotherapy combined with intensity-modulated radiotherapy for nasopharyngeal carcinoma[J]. Zhongguo Ai Zheng Za Zhi, 2018, 28(8): 602–8. ] |
| [6] | Herbst RS, Shin DM. Monoclonal antibodies to target epidermal growth factor receptor-positive tumors: a new paradigm for cancer therapy[J]. Cancer, 2002, 94(5): 1593–611. DOI:10.1002/(ISSN)1097-0142 |
| [7] | Sun W, Long G, Wang J, et al. Prognostic role of epidermal growth factor receptor in nasopharyngeal carcinoma: a meta-analysis[J]. Head Neck, 2014, 36(10): 1508–16. |
| [8] | Ma X, Huang J, Wu X, et al. Epidermal growth factor receptor could play a prognostic role to predict the outcome ofnasopharyngeal carcinoma: A meta-analysis[J]. Cancer Biomark, 2014, 14(4): 267–77. DOI:10.3233/CBM-140401 |
| [9] | Peng H, Tang LL, Liu X, et al. Anti-epidermal growth factor receptor therapy concurrently withinduction chemotherapy in locoregionally advancednasopharyngeal carcinoma[J]. Cancer Sci, 2018, 109(5): 1609–16. DOI:10.1111/cas.2018.109.issue-5 |
| [10] | 黄晓东, 易俊林, 高黎, 等. 抗表皮生长因子受体单克隆抗体h-R3联合放疗治疗晚期鼻咽癌的Ⅱ期临床研究[J]. 中华肿瘤杂志, 2007, 29(3): 197–201. [ Huang XD, Yi JL, Gao L, et al. Multi-center phase Ⅱ clinical trial of humanized anti-epidermal factor receptor monoclonal antibody h-R3 combined with radiotherapy for locoregionally advanced nasopharyngeal carcinoma[J]. Zhonghua Zhong Liu Za Zhi, 2007, 29(3): 197–201. DOI:10.3760/j.issn:0253-3766.2007.03.009 ] |
| [11] | Kong L, Lin Q, Lu JJ, et al. Radiation plus concurrent nimotuzumab versrs CDDP in locally advanced nasopharyngeal cancer: resuls of 3 randomised trial[C]. 2016, ASCO Abstract No: 6002. |
| [12] | Wang F, Jiang C, Ye Z, et al. Efficacy and safety of nimotuzumab with neoadjuvantchemotherapy followed by concurrent chemoradiotherapy forlocoregionally advanced nasopharyngeal carcinoma[J]. Oncotarget, 2017, 8(43): 75544–56. |
 2019, Vol. 46
2019, Vol. 46


