文章信息
- 子宫内膜癌微环境中间质细胞相关信号通路的研究进展
- Progress on Stromal Cell-related Signaling Pathways in Endometrial Carcinoma Microenvironment
- 肿瘤防治研究, 2019, 46(8): 733-736
- Cancer Research on Prevention and Treatment, 2019, 46(8): 733-736
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.18.2028
- 收稿日期: 2018-12-29
- 修回日期: 2019-03-18
2. 200065 上海,同济大学附属同济医院药剂科;
3. 200011 上海,复旦大学附属红房子医院病理科
2. Department of Pharmacy, Tongji Hospital, Tongji University, Shanghai 200065, China;
3. Department of Pathology, Obstetrics and Gynecology Hospital, Fudan University, Shanghai 200011, China
在世界范围内,子宫内膜癌是最常见的妇科恶性肿瘤。子宫内膜癌是美国第四大常见恶性肿瘤,仅次于乳腺、肺和肠癌,2015年新发病例数就有54 870例[1]。子宫内膜癌的发生和发展与激素和代谢因素密切相关,但相关机制尚未完全明确[2]。以前的研究多关注在上皮性肿瘤细胞本身,而对肿瘤细胞生存所处的肿瘤微环境未给予足够的重视。
肿瘤微环境主要是指由肿瘤细胞、基质细胞及细胞外基质(extracellular matrix, ECM)共同构成的促进肿瘤发生、发展、浸润和转移的局部内环境。子宫内膜癌的基质细胞包括子宫内膜间质细胞(endometrial stromal cell, ESC)、血管内皮细胞、血管周细胞、脂肪细胞、血管平滑肌细胞、免疫和炎性细胞。ECM中含有多种生长因子,细胞因子和结构蛋白等非细胞成分,为细胞提供营养和结构支撑,这些非细胞成分是上皮细胞和基质细胞相互作用的共同结果[3]。肿瘤微环境中的各种成分构成一个巨大的网络,推动子宫内膜上皮细胞的恶性转化和演进。
间质细胞作为肿瘤微环境中的主要细胞,在雌激素和内膜腺上皮细胞间发挥着重要的“媒介”作用,其相关分子信号在惰性肿瘤的恶性进展中发挥着重要作用[4]。本文拟对间质细胞参与子宫内膜癌发生、发展的相关信号通路的研究进行综述。
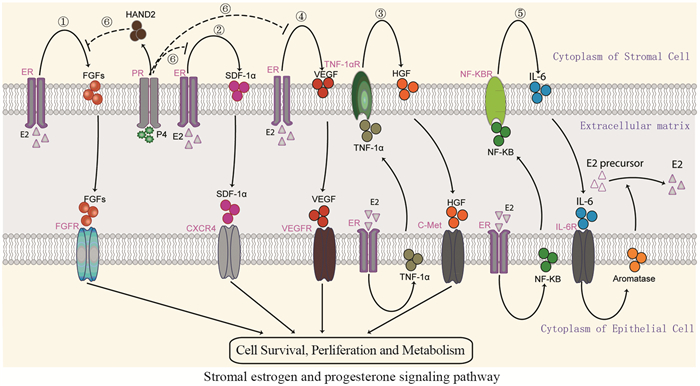
1 间质细胞雌、孕激素相关信号通路目前,已知雌孕激素的失衡-无孕激素拮抗的过量雌激素对子宫内膜上皮细胞的过度刺激是Ⅰ型子宫内膜癌发病的重要机制。与上皮细胞相同,子宫内膜间质细胞也表达雌激素受体,同样受到雌激素的调控。同时,子宫内膜组织中的血管成分和上皮细胞并不直接接触,血液内的雌激素弥散到组织间隙后首先和子宫内膜间质细胞接触。间质细胞分泌的成纤维细胞生长因子(fibroblast growth factor, FGF)、间质细胞衍生因子-1α(stromal cell-derived factor, SDF-1α)、肝细胞生长因子(hepatocyte growth factor, HGF)、血管内皮生长因子(vascular endothelial growth factor, VEGF)、芳香化酶(aromatase, CYP19)和心脏和神经脊衍生物表达转录因子2(heart and neural crest derivatives expressed 2, HAND)等细胞因子均涉及雌、孕激素对上皮细胞增殖、侵袭和转移等生物学行为的间接调控。子宫内膜癌中雌激素-间质细胞的具体信号通路(信号通路①到⑤),见图 1。
|
| 图 1 子宫内膜癌微环境中间质细胞雌、孕激素信号通路 Figure 1 Stromal estrogen and progesterone signaling pathway in microenvironment of endometrial carcinoma |
FGF家族有23个家族成员,包括18个配体(FGF1-18)和5个受体(FGFR1-5)。FGF1-18是强有力的细胞分裂促进因子。FGFR1-4是高度保守的跨膜酪氨酸激酶受体,FGFR5也称为FGFRL1,可以与FGFs结合,但不具有酪氨酸激酶结构域,起负性调控的抑癌作用[5]。FGF/FGFR是重要信号通路之一,调控多种生理功能,参与胚胎发育、伤口愈合和血管形成,并涉及肝、结肠和子宫内膜癌等恶性肿瘤的发病机制。
雌激素能诱导子宫内膜间质细胞旁分泌FGF10蛋白表达增高,FGF10可通过激活MAPK信号通路ERK1/2蛋白的磷酸化而促进内膜细胞的增殖[6]。另外,雌激素抑制剂Bazedoxifene能抑制间质细胞FGF18的表达,间接提示雌激素和间质细胞FGF18有一定的相关性[7]。FGF10和FGF18的受体主要是FGFR2,激活后通过RAS-MAPK、PI3K、PLCγ和JAK-STAT等信号通路调节细胞生存、增殖、迁移和血管生成等生物学行为。约10%子宫内膜癌伴有受体络氨酸激酶FGFR2突变,且和较短的无进展及肿瘤特异性生存期相关[8]。突变后的FGFR2无需和配体结合,便可直接激活下游信号通路。因此,FGF/FGFR信号通路在肿瘤上皮-间质细胞的相互作用中发挥重要角色[9]。
1.2 雌激素-间质细胞SDF-1α信号通路SDF-1α是一类具有趋化活性的细胞因子,因其氨基酸序列含有两个半胱氨酸,故将其归为CXC亚家族,并命名为CXCL12。SDF-1α受体CXCR4为编码352个氨基酸且高度保守的G蛋白耦联7次跨膜受体,其胞外区(N端区域)与配体结合,胞内区(C端)与G蛋白偶联磷酸化后参与信号转导。SDF-1α与CXCR4结合后可启动下游信号通路,在胃癌、肠癌等肿瘤的发生发展及转移中起着十分重要的作用[10-11]。
雌激素能诱导子宫内膜间质细胞分泌SDF-1α,与肿瘤细胞CXCR4结合后可促进其增殖活性。SDF-1α表达和子宫内膜癌的临床分期、淋巴结转移、远处转移、深肌层浸润、宫颈累及和双附件累及之间存在相关性,且内膜癌组织高表达SDF-1α和CXCR4与肿瘤复发密切相关[12]。特异性抑制剂Kisspeptin-10能抑制SDF-1α诱导子宫内膜癌细胞的侵袭能力[13]。
1.3 雌激素-间质细胞HGF信号通路HGF是一种多功能细胞因子,可通过旁分泌或自分泌机制,在肿瘤的发病机制中发挥重要作用。HGF的单一受体C-Met是一跨膜蛋白,由原癌基因C-Met编码。HGF和受体C-Met结合后,导致RAS/MAPK、PI3K/AKT等信号通路的级联激活,产生一系列生物学效应,如细胞侵袭、浸润、运动、迁移以及最终转移等。
雌激素促进肿瘤细胞分泌肿瘤坏死因子(tumor necrosis factor-α, TNF-α),TNF-α能诱导子宫内膜间质细胞分泌HGF。HGF和肿瘤细胞表面的C-Met受体结合,从而促进肿瘤细胞的增殖和浸润[14]。同时,子宫内膜癌中C-Met和酪氨酸激酶受体RON(recepteur d'origine nantais)基因的共同表达提示预后较差,并且是独立的预后标志物[15]。
1.4 雌激素-间质细胞VEGF信号通路VEGF是一种高度特异性的促血管内皮细胞生长的因子,具有促进血管内皮细胞增殖、迁移和血管形成等作用。子宫内膜癌组织中VEGF蛋白和mRNA表达与不典型增生及增殖期子宫内膜组织相比,均明显增高,差异有统计学意义[16]。
雌激素能刺激间质细胞分泌VEGF和血管内皮生长因子受体-1(vascular endothelial growth factor receptor-1, VEGFR-1),在子宫内膜癌肿瘤微环境中血管形成中起重要作用[17]。MiR-199a能下调低氧状态下子宫内膜间质细胞VEGF的表达而抑制血管的形成[18]。
1.5 雌激素-间质细胞芳香化酶信号通路Aromatase是细胞色素P450酶系中的一种, 可以催化雄烯二酮、睾酮脱去19位碳并使A环芳构化, 分别形成雌二醇和雌酮, 它是雄激素生物合成的限速酶。雌激素能通过内膜癌细胞ERα激活NF-κB信号通路并诱导白介素-6表达增高,内膜癌细胞释放白介素-6可刺激间质细胞芳香化酶的表达增高,芳香化酶可将间质细胞周围的雄激素前体和非活化的雌激素转化为具有代谢活性的E2,从而完成雌激素对上皮细胞的间接调控[19]。临床标本的免疫组织化学分析显示子宫内膜癌间质细胞芳香化酶的表达和患者的生存率呈正相关。另外,芳香化酶抑制剂的使用可能会降低女性患子宫内膜癌的风险[20]。
1.6 孕激素-间质细胞相关信号通路孕激素对间质细胞的作用主要是拮抗雌激素的作用,并抵消雌激素通过间质细胞对内膜上皮细胞的各项生理功能。孕激素能诱导间质细胞分泌HAND2,拮抗雌激素通过间质细胞分泌FGFs的促上皮增殖作用;同时,缺乏HAND2表达的间质细胞转染FGF后能促进上皮细胞的增殖[21]。免疫组织化学分析显示HAND2在良性子宫内膜病变的间质细胞中表达充分,而在不典型增生或内膜癌的间质细胞中表达会有减少或丢失[22]。因此,HAND2在子宫内膜癌的发病机制中可能起重要作用。
同时,孕激素也能通过抑制间质细胞分泌SDF-1α和VEGF而对肿瘤微环境中的血管形成进行负性调控[23](信号通路⑥),见图 1。
2 间质细胞抑癌基因相关信号通路癌的发生,常伴有原癌基因的激活和抑癌基因的失活。上皮细胞的第10号染色体同源丢失性磷酸酶-张力蛋白基因(phosphatase and tension homology deleted on chromosome ten, PTEN)、P16、P53和P27等抑癌基因作用于上皮细胞而在子宫内膜癌发病机制中发挥重要作用。近年来对子宫内膜癌间质细胞抑癌基因信号通路的研究也取得一定的进展,主要有PTEN、APC、LKB1和P16等信号通路。
2.1 PTEN信号通路PTEN是具有磷脂酶活性的抑癌基因,该基因缺失是子宫内膜癌癌前病变的早期分子事件。PTEN作用于PI3K-AKT信号转导通路,调节细胞生长并发挥肿瘤抑制作用。PTEN主要使细胞周期阻断在G期或促使细胞凋亡,对细胞的生长起负调控作用。当PTEN基因发生体细胞突变或丢失而失活时,可致细胞无限增殖形成肿瘤。
研究表明子宫内膜间质细胞PTEN基因在内膜癌发病机制中也起重要作用。间质细胞PTEN基因通过转化生长因子-β(transforming growth factor-β, TGF-β)信号通路激活下游效应分子SMAD2/3,从而抑制不典型增生的子宫内膜上皮细胞向内膜癌上皮细胞的转变[24]。
2.2 APC信号通路结肠腺瘤样息肉(adenomatous polyposis coli, APC)基因可诱导细胞凋亡而抑制细胞的增殖,APC基因失活会导致细胞的持续增殖。APC基因突变是结直肠肿瘤发生过程中的早期事件。子宫内膜癌中存在异常的APC-β-catenin信号通路。子宫内膜间质细胞APC基因突变后,诱导正常腺上皮细胞转化变为复杂不典型增生过长,进而进展为伴肌层浸润的内膜癌;同时伴有间质细胞VEGF和SDF1α表达增强,TGFβ表达减弱,ERα和PR的表达消失[25]。
2.3 LKB1信号通路肝激酶B1(liver kinase b1, LKB1),又称为丝氨酸、苏氨酸激酶11(STK11)基因,是和P-J息肉发病机制密切相关的抑癌基因,涉及输卵管、卵巢和宫颈肿瘤的发病机制。子宫内膜间质细胞LKB1信号通路失活,通过激活哺乳动物雷帕霉素靶点复合物1(mammalian rapamycin target complex 1, mTORC1)诱导子宫内膜癌的发生[26]。
2.4 P16信号通路P16基因为多重肿瘤抑制基因,表达产物P16蛋白对细胞周期起负调控作用,抑制细胞的过度增生和恶性转化。子宫内膜癌间质细胞突变P16的表达较正常内膜组织增高,且与肿瘤侵袭性的生物学行为相关,提示间质细胞P16表达涉及子宫内膜癌的发展和演进[27]。
3 其他肿瘤周围间质细胞对肿瘤细胞的调控可为促进或抑制作用,是由肿瘤细胞的分期、分级和类型决定,同时也由间质细胞的类型决定。不同类型的间质细胞会影响雌激素对上皮的间接调节作用,导致内膜癌细胞株Ishikawa的异位移植瘤增殖的不同[28]。此外,从子宫内膜癌间质成分中分离出来的腹膜脂肪源性间质细胞也使内膜癌细胞的侵袭性和异质性增强,发生上皮间质转化,表现为上皮细胞E-cadherin表达降低和Vimentin表达增高[29]。
4 总结和展望微环境中的肿瘤和非肿瘤细胞通过分子信号通路相互沟通,达成共识,产生有利于内膜细胞癌变的微环境。虽然肿瘤微环境成为“促肿瘤”的介质为人所知,但肿瘤细胞和基质细胞为形成有利环境而进行沟通的确切机制仍不清楚。肿瘤微环境是一个尚未充分研究的领域,相关细胞信号通路的研究有助于解释为何高级别或转移性子宫内膜癌预后较差。肿瘤细胞单一损伤(基因突变)并不能引发疾病,第二次打击(微环境衍生的信号)可能是驱动肿瘤进展的关键步骤[30]。子宫内膜癌肿瘤微环境间质细胞的研究,能更好地帮助我们了解涉及子宫内膜癌发病机制的信号通路,找到新的肿瘤标志物,并为子宫内膜癌的诊断、预防和治疗提供新的方法。展望未来,子宫内膜癌的治疗策略必将兼顾肿瘤细胞和肿瘤微环境两个方面展开。
作者贡献
伍健:对相关素材进行归纳整理、综合分析、论文撰写与修改
张虹:论文指导
陶祥:论文的审核与修改
| [1] | American Cancer Society. Cancer facts & figures 2015[M]. Atlanta: American Cancer Society, 2015: 4. |
| [2] | Huang Y, Ye Y, Long P, et al. Silencing of CXCR4 and CXCR7 expression by RNA interference suppresses human endometrial carcinoma growth in vivo[J]. Am J Transl Res, 2017, 9(4): 1896–1904. |
| [3] | Miles FL, Sikes RA. Insidious changes in stromal matrix fuel cancer progression[J]. Mol Cancer Res, 2014, 12(3): 297–312. DOI:10.1158/1541-7786.MCR-13-0535 |
| [4] | Bonnans C, Chou J, Werb Z. Remodelling the extracellular matrix in development and disease[J]. Nat Rev Mol Cell Biol, 2014, 15(12): 786–801. |
| [5] | Zhuang L, Steinberg F, Trueb B. Receptor FGFRL1 acts as a tumor suppressor in nude mice when overexpressed in HEK 293 Tet-On cells[J]. Oncol Lett, 2016, 12(6): 4524–4530. DOI:10.3892/ol.2016.5245 |
| [6] | Chung D, Gao F, Jegga AG, et al. Estrogen mediated epithelial proliferation in the uterus is directed by stromal Fgf10 and Bmp8a[J]. Mol Cell Endocrinol, 2015, 400: 48–60. |
| [7] | Flannery CA, Fleming AG, Choe GH, et al. Endometrial cancer-associated fgf18 expression is reduced by bazedoxifene in human endometrial stromal cells in vitro and in murine endometrium[J]. Endocrinology, 2016, 157(10): 3699–3708. DOI:10.1210/en.2016-1233 |
| [8] | Packer LM, Stehbens SJ, Bonazzi VF, et al. Bcl-2 inhibitors enhance FGFR inhibitor-induced mitochondrial-dependent cell death in FGFR2-mutant endometrial cancer[J]. Mol Oncol, 2019, 13(4): 738–756. |
| [9] | Giacomini A, Chiodelli P, Matarazzo S, et al. Blocking the FGF/FGFR system as a "two-compartment" antiangiogenic/antitumor approach in cancer therapy[J]. Pharmacol Res, 2016, 107: 172–185. DOI:10.1016/j.phrs.2016.03.024 |
| [10] | Takahashi K, Tanaka M, Yashiro M, et al. Protection of stromal cell-derived factor 2 by heat shock protein 72 prevents oxaliplatin-induced cell death in oxaliplatin-resistant human gastric cancer cells[J]. Cancer Lett, 2016, 378(1): 8–15. DOI:10.1016/j.canlet.2016.05.002 |
| [11] | Amara S, Chaar I, Khiari M, et al. Stromal cell derived factor-1 and CXCR4 expression in colorectal cancer promote liver metastasis[J]. Cancer Biomark, 2015, 15(6): 869–879. |
| [12] | Walentowicz-Sadlecka M, Sadlecki P, Bodnar M, et al. Stromal derived factor-1 (SDF-1) and its receptors CXCR4 and CXCR7 in endometrial cancer patients[J]. PLoS One, 2014, 9(1): e84629. DOI:10.1371/journal.pone.0084629 |
| [13] | Schmidt E, Haase M, Ziegler E, et al. Kisspeptin-10 inhibits stromal-derived factor 1-induced invasion of human endometrial cancer cells[J]. Int J Gynecol Cancer, 2014, 24(2): 210–217. DOI:10.1097/IGC.0000000000000050 |
| [14] | Li M, Xin X, Wu T, et al. Stromal cells of endometrial carcinoma promotes proliferation of epithelial cells through the HGF/c-Met/Akt signaling pathway[J]. Tumour Biol, 2015, 36(8): 6239–6248. DOI:10.1007/s13277-015-3309-2 |
| [15] | Zhuang XP, Jin WW, Teng XD, et al. c-Met and RON expression levels in endometrial adenocarcinoma tissue and their relationship with prognosis[J]. Eur J Gynaecol Oncol, 2015, 36(3): 255–259. |
| [16] | Xu H, Sun X, Sun WJ. Expression and clinical correlation of NGAL and VEGF in endometrial carcinoma[J]. Eur Rev Med Pharmacol Sci, 2018, 22(3): 632–636. |
| [17] | Okada H, Tsutsumi A, Imai M, et al. Estrogen and selective estrogen receptor modulators regulate vascular endothelial growth factor and soluble vascular endothelial growth factor receptor 1 in human endometrial stromal cells[J]. Fertil Steril, 2010, 93(8): 2680–2686. DOI:10.1016/j.fertnstert.2009.08.056 |
| [18] | Dai L, Lou W, Zhu J, et al. MiR-199a inhibits the angiogenic potential of endometrial stromal cells under hypoxia by targeting HIF-1α/VEGF pathway[J]. Int J Clin Exp Pathol, 2015, 8(5): 4735–4744. |
| [19] | Che Q, Liu BY, Liao Y, et al. Activation of a positive feedback loop involving IL-6 and aromatase promotes intratumoral 17β-estradiol biosynthesis in endometrial carcinoma microenvironment[J]. Int J Cancer, 2014, 135(2): 282–294. DOI:10.1002/ijc.28679 |
| [20] | Brower V. Aromatase inhibitors may reduce endometrial cancer risk[J]. Lancet Oncol, 2015, 16(4): e164. |
| [21] | Li Q, Kannan A, DeMayo FJ, et al. The antiproliferative action of progesterone in uterine epithelium is mediated by Hand2[J]. Science, 2011, 331(6019): 912–916. |
| [22] | Buell-Gutbrod R, Cavallo A, Lee N, et al. Heart and neural crest derivatives expressed transcript 2 (hand2): a novel biomarker for the identification of atypical hyperplasia and type Ⅰ endometrial carcinoma[J]. Int J Gynecol Pathol, 2015, 34(1): 65–73. DOI:10.1097/PGP.0000000000000106 |
| [23] | Okada H, Okamoto R, Tsuzuki T, et al. Progestins inhibit estradiol-induced vascular endothelial growth factor and stromal cell-derived factor 1 in human endometrial stromal cells[J]. Fertil Steril, 2011, 96(3): 786–791. DOI:10.1016/j.fertnstert.2011.06.048 |
| [24] | Liang X, Daikoku T, Terakawa J, et al. The uterine epithelial loss of Pten is inefficient to induce endometrial cancer with intact stromal Pten[J]. PLoS Genet, 2018, 14(8): e1007630. DOI:10.1371/journal.pgen.1007630 |
| [25] | Tanwar PS, Zhang L, Roberts DJ, et al. Stromal deletion of the APC tumor suppressor in mice triggers development of endometrial cancer[J]. Cancer Res, 2011, 71(5): 1584–1596. DOI:10.1158/0008-5472.CAN-10-3166 |
| [26] | Tanwar PS, Kaneko-Tarui T, Zhang L, et al. Stromal liver kinase B1[STK11] signaling loss induces oviductal adenomas and endometrial cancer by activating mammalian Target of Rapamycin Complex 1[J]. PLoS Genet, 2012, 8(8): e1002906. DOI:10.1371/journal.pgen.1002906 |
| [27] | Yoon G, Koh CW, Yoon N, et al. Stromal p16 expression is significantly increased in endometrial carcinoma[J]. Oncotarget, 2017, 8(3): 4826–4836. |
| [28] | Pineda MJ, Lu Z, Cao D, et al. Influence of Cancer-Associated Endometrial Stromal Cells on Hormone-Driven Endometrial Tumor Growth[J]. Horm Cancer, 2015, 6(4): 131–141. |
| [29] | Li M, Li X, Zhao L, et al. Spontaneous formation of tumorigenic hybrids between human omental adipose-derived stromal cells and endometrial cancer cells increased motility and heterogeneity of cancer cells[J]. Cell Cycle, 2019, 18(3): 320–332. |
| [30] | Sahoo SS, Zhang XD, Hondermarck H, et al. The Emerging Role of the Microenvironment in Endometrial Cancer[J]. Cancers (Basel), 2018, 10(11): pii: E408. DOI:10.3390/cancers10110408 |
 2019, Vol. 46
2019, Vol. 46


