文章信息
- 选择性增加PTV单次剂量对食管癌患者预后的影响
- Effect of Selective Increase of Single Dose of PTV on Prognosis of Patients with Esophageal Cancer
- 肿瘤防治研究, 2019, 46(5): 463-469
- Cancer Research on Prevention and Treatment, 2019, 46(5): 463-469
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.18.2007
- 收稿日期: 2018-12-26
- 修回日期: 2019-02-11
2. 050011 石家庄,河北省中医院肿瘤科
2. Department of Oncology, Hebei Hospital of Traditional Chinese Medicine, Shijiazhuang 050011, China
由于食管癌临床发病的隐匿性,多数患者在就诊时已失去手术机会,自RTOG85-01和RTOG94-05实验[1-2]结果发表以来,同步放化疗成为非手术治疗的食管癌患者的标准治疗模式。然而,即使是在放疗技术发展的今天,局部复发仍是食管癌患者治疗失败的主要原因之一[3],怎样降低食管癌患者的复发率一直是临床讨论的热点问题,理论上认为增加实体肿瘤局部的放疗剂量可能会增加肿瘤的局部控制率[4-6]。在MD安德森癌症中心进行的一项针对于食管癌的研究表明,增加食管癌靶体积单次剂量可提高患者的局部控制率和生存率,并减少邻近正常组织、器官的受量[7]。另有实验结果亦证实了提高食管肿瘤局部单次剂量的安全和可行性[8-9]。为进一步明确选择性增加食管癌肿瘤靶区的单次剂量是否能为接受根治性放(化)疗的局部晚期食管癌患者的生存带来益处的同时而不增加患者的不良反应,我们对在河北医科大学第四医院放疗科接受基于调强技术的同步整合加量调强放射治疗(simultaneous integrated boost intensity-modulated radiation therapy, SIB-IMRT)和后程缩野加量调强放疗(late course boost intensity-modulated radiation therapy, LCB-IMRT)的302例患者进行了回顾性分析。
1 资料与方法 1.1 入组及排除标准在河北医科大学第四医院放疗科接受根治性放(化)的食管癌患者;经病理学或细胞学证实为食管鳞状细胞癌;KPS评分≥80;采用我国2009年非手术治疗食管癌临床分期草案进行分期,且患者均为T1~4N0~1M0期患者;所有患者此次治疗均为首程治疗,未接受过新辅助化疗;所有患者随访资料完整。
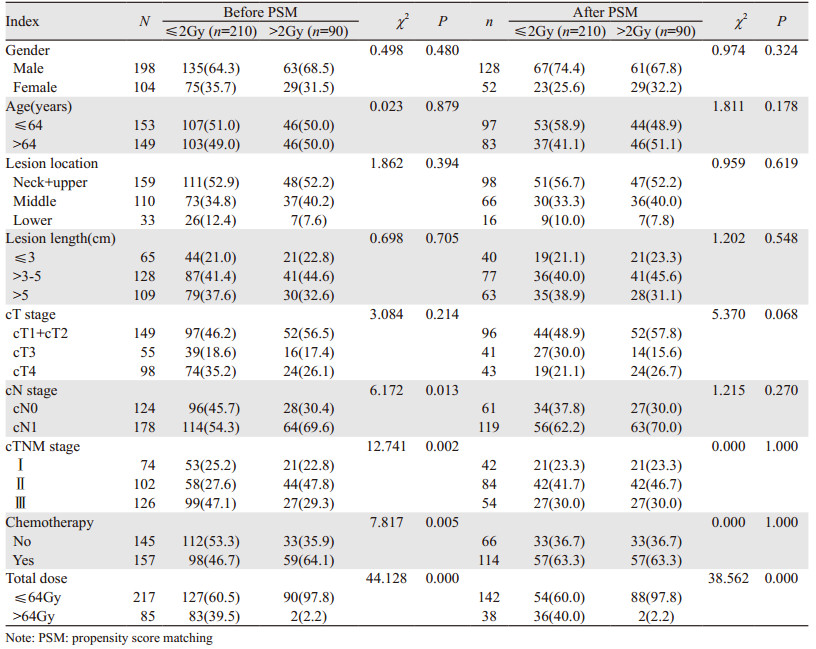
1.2 一般资料从2007年1月至2014年12月在我院放疗科接受治疗的食管癌患者中符合入组条件者302例,其中男198例,女104例;年龄41~85岁,中位年龄64岁;病变位于颈段、胸上段、胸中段和胸下段分别为17、142、110和33例;食管造影显示病变长度为1.5~17.0 cm,中位4.9 cm;依据我国2009年非手术治疗食管癌临床分期草案进行分期[8];接受SIB-IMRT患者为132例,接受LCB-IMRT患者为170例;145例患者未接受化疗,157例患者接受了化疗,见表 1。
|
所有患者均接受选择性淋巴结照射,患者仰卧位,头垫枕,热塑膜固定体位,CT模拟机下定位,扫描层厚3 mm,扫描范围为颈2椎体至膈肌水平,下段食管癌患者下界则包括肾下缘。扫描图像经局域网传输到治疗计划系统,勾画靶区大体肿瘤体积(GTV)、临床靶体积(CTV)、计划靶体积(PTV)和危及器官。其中GTV包括食管大体肿瘤(GTV-t)和肿大淋巴结(GTV-n);CTV为GTV上下外扩1.5~3.0 cm、前后左右外扩0.5~0.8 cm和肿大淋巴结累及区,并根据解剖结构适当修正;PTV为CTV上下外扩0.5~1.0 cm,前后左右外扩0.3~0.5 cm;依据美国胸科协会对胸部淋巴结的分组,进行淋巴结引流区的勾画,勾画的淋巴结引流区定义为CTV-n,在CTV-n的基础上前后左右方向各外放0.3~0.5 cm,上下方向各外放1.0~1.5 cm为PTV-n。勾画脊髓、肺、心脏、肝脏等危及器官。
SIB-IMRT放疗计划:95%PTV-n剂量48.6~57.6 Gy/27~32次(单次分割1.7~1.8 Gy),95%PTV剂量为58~66 Gy/27~32次(单次分割2.0~2.2 Gy),1次/天,5次/周,全程放疗时间为5.5~6周。行SIB-IMRT患者中95%PTV接受的单次剂量为2.0 Gy的为40例;其余92例患者的单次剂量均 > 2.0 Gy,范围为204~220 cGy,中位210 cGy,该92例患者95%PTV接受的BED为72.04~78.20 Gy,中位BED为76.23 Gy。
LCB-IMRT放疗计划:前程95%PTV-n剂量40~54 Gy/20~28次(单次分割1.8~2.0 Gy),95%PTV剂量为8~24 Gy/6~12次(单次分割1.8~2.0 Gy),1次/天,5次/周,全程放疗时间为6~7周。该组患者95%PTV累计剂量为60~64 Gy。
危及器官限量:脊髓最大受照剂量≤45 Gy;双肺V5≤60%,V20≤30%,V30≤20%;心脏V25≤50%,V40≤30%;下段食管癌限制胃V30≤40%、肝脏V30≤30%。
1.4 化疗全组302例患者中,接受化疗157例,其中同期放化疗79例,序贯放化疗78例。化疗疗程为2~6周期,化疗方案以顺铂为基础,主要有LFP(第1~5天,亚叶酸钙每次200 mg,替加氟每次1 g,顺铂每次20 mg)和TP(紫杉醇每次240 mg,第1天,顺铂每次20 mg,第1~5天)。
1.5 随访通过门诊复查、电话、短信和户籍查询等方式进行随访。第1年每3~6月复查一次,随后每6~12月复查一次。总体生存时间定义为行手术之日至死亡或末次随访时间,随访截至2017年12月31日或死亡日期。
1.6 统计学方法采用SPSS19.0软件进行分析,用卡方检验进行构成比比较,用Kaplan-Meier法计算无病生存率(disease-free survival, DFS)和总生存率(overall survival, OS),时间计算从放疗之日开始;多因素分析采用Cox比例风险模型,并用向前Wald筛选法评估独立的预后因素。多因素分析P < 0.05的变量在两组间采用倾向得分匹配(propensity score matching, PSM)法1:1配对。P < 0.05为差异有统计学意义。
2 结果 2.1 全组患者生存情况及预后影响因素分析结果全组患者1、3、5年OS为79.1%、44.1%和26.8%,中位生存时间为30.0月(HR: 3.319, 95%CI: 23.495~36.505),1、3、5年DFS为66.1%、34.9%和20.8%,中位时间为21.3月(HR: 1.838, 95%CI: 7.698~24.902)。
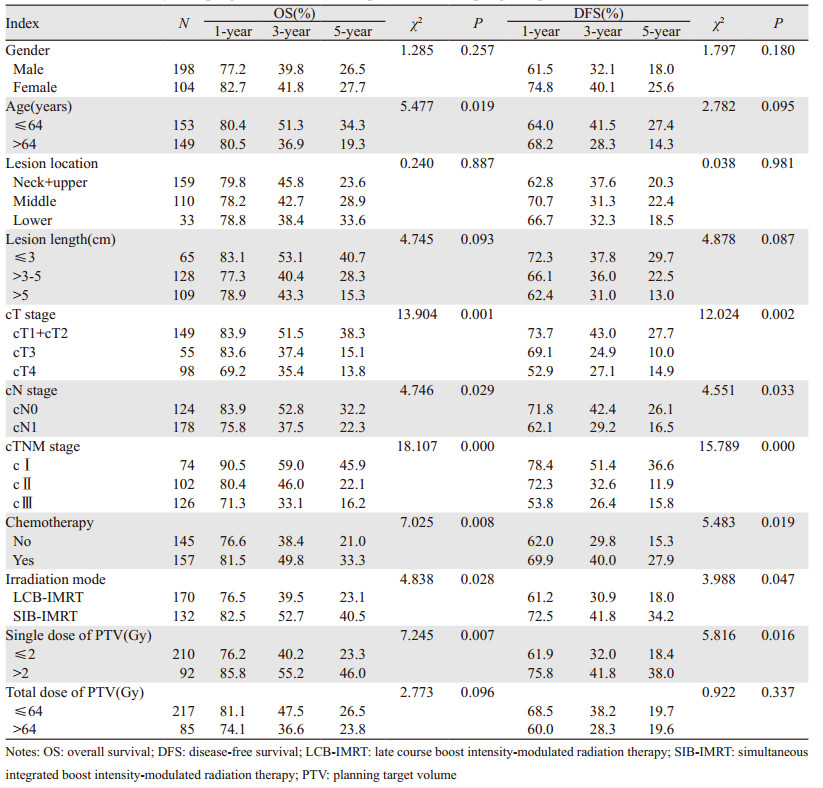
单因素分析结果显示患者年龄、cT分期、cN分期、cTNM分期、化疗、照射方式和PTV接受的单次剂量为影响患者OS的因素(χ2=5.477、13.904、4.746、18.107、7.025、4.838、7.245,P=0.019、0.001、0.029、0.000、0.008、0.028、0.007);cT分期、cN分期、cTNM分期、化疗、照射方式和PTV接受的单次剂量为影响患者DFS的因素(χ2=12.024、4.551、15.789、5.483、3.988、5.816,P=0.002、0.033、0.000、0.019、0.047、0.016),见表 2。
|
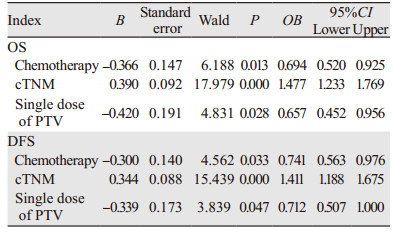
多因素分析结果显示化疗、cTNM分期和PTV接受的单次剂量为OS(P=0.013、0.000、0.028)和DFS(P=0.033、0.000、0.047)的独立性预后影响因素,见表 3。
|
从上结果可知接受PTV单次剂量 > 2 Gy预后显著优于单次剂量≤2 Gy的患者,为了进一步明确其临床意义,并排除其他可能的干扰因素,我们将302例患者依据PTV单次剂量的大小分为≤2 Gy和 > 2 Gy两组,一般临床资料的构成比分析结果显示:两组患者在cN分期、cTNM分期、化疗和PTV总处方剂量上差异有统计学意义(χ2=6.172、12.741、7.817、44.128,P=0.013、0.002、0.005、0.000)。依据全组患者的多因素分析结果,将患者的化疗和cTNM分期作为配比因子进行1:1配比,经PMS后全组患者为180例,每组90例。配比后两组患者仅在PTV总处方剂量上差异有统计学意义(χ2=38.562, P=0.000),见表 1。
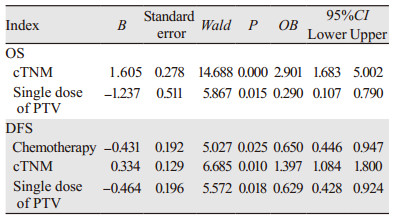
2.3 PSM后的180例患者的预后和不良反应分析对经PSM后的180例患者进行多因素分析,结果显示cTNM分期和PTV单次剂量为患者OS独立性预后影响因素(P=0.000、0.015);化疗、cTNM分期和PTV单次剂量为患者DFS独立性预后影响因素(P=0.025、0.010、0.018),见表 4。
|
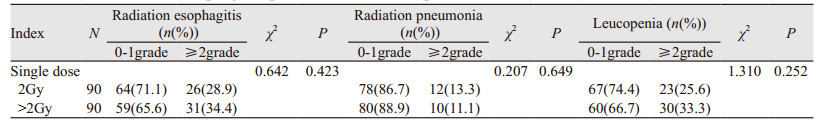
全组患者出现0、1、2、3级急性放射性食管炎分别为38、85、47和10例;出现0、1、2、3级急性放射性肺炎分别为141、17、18和4例;出现0、1、2、3级急性白细胞下降分别为95、32、41和12例。两组患者≥2级急性不良反应发生率差异均无统计学意义(χ2=0.642、0.207、1.310, P=0.423、0.649、0.252),见表 5。
|
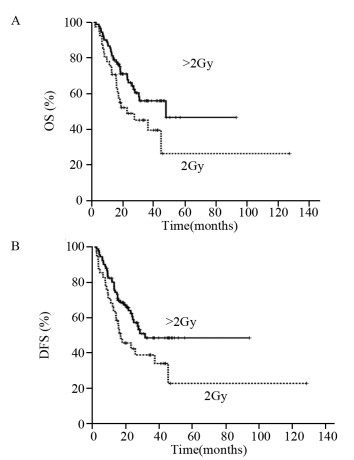
将132例接受SIB-IMRT的患者依据PTV单次剂量的不同分为2 Gy(40例)组和 > 2 Gy(92例)组,依据Kaplan-Meier法分析预后,2 Gy组和 > 2 Gy组患者的1、3、5年OS为75.6%、45.1、26.3和85.7%、56.0%、46.6%,两组比较差异有统计学意义(χ2=4.004,P=0.045);两组患者的1、3、5年DFS分别为63.4%、38.8%、22.6%和76.65%、48.4%、40.4%,两组比较差异有统计学意义(χ2=4.397, P=0.036),见图 1。
|
| 图 1 两组食管癌患者的OS(A)和DFS(B)曲线 Figure 1 OS(A) and DFS(B) curves of two groups of esophageal squamous cell carcinoma patients |
根治性放(化)疗为局部晚期不可切除食管癌患者的主要治疗手段已得到临床实践的证实,但即使接受了根治性的放(化)疗,食管癌患者预后仍不能令人满意,主要失败模式为局部区域复发或(和)远处脏器转移,因此怎样降低或延缓此类失败率,从而延长患者的生存率,一直以来都是临床医生研究的热点。有研究表明[10]相较于三维适形放疗,调强适形放射治疗更能为食管癌患者带来生存和局部控制的获益。也有一些研究认为,常规剂量的放疗不足以使食管癌患者有理想的预后,食管癌患者可能存在放疗剂量与局部控制率之间的正相关[6, 11],而食管癌的局部失败可能与肿瘤局部剂量不足有关[8]。因此,临床进行了多种治疗模式的尝试,其中基于调强的同步加量技术即SIB-IMRT,成为目前临床较为常用的放疗技术,而且越来越多的临床研究证明了其可行性。研究表明SIB-IMRT可改善食管癌患者的局部区域控制和整体存活率,同时不增加患者不良反应[12-13]。但有临床研究并不认为SIB-IMRT的应用可以改善食管癌患者生存率[14]。本研究中全组患者在未进行配比前的单因素分析结果显示LCB-IMRT组患者的OS和DFS均显著差于SIB-IMRT组患者,多因素分析中并未显示其独立性预后的影响优势,但不同PTV单次剂量为影响患者预后的独立因素,因此我们进行了亚组分析,即将SIB-IMRT组患者依据PTV单次剂量的不同分为常规2 Gy组和 > 2 Gy组,结果显示两组患者的OS和DFS差异均有显著性,单次剂量 > 2 Gy组优势明显。另外,我们为了排除患者本身因素造成结果偏差,依据不同PTV接受的单次剂量为标准进行PSM配比,结果仍然显示PTV单次剂量为影响患者预后的独立因素,因此有理由认为基于SIB-IMRT技术进行选择性增加肿瘤局部剂量对食管癌患者的预后有益。
研究认为通过单次照射大于常规治疗的单次剂量的放疗方式,不仅将肿瘤细胞再增殖概率降到最低,提高肿瘤控制率,而且能够缩短放疗疗程、降低治疗成本[15]。单次大剂量和常规放疗两种放疗模式在控制肿瘤和引起正常组织损伤的机制相同,不同之处在于由于常规放疗的单次剂量小、分次次数多和治疗疗程长等原因,会提高分次间细胞的修复、细胞周期的再分布和增殖,这不利于肿瘤的控制但可以减少正常组织的损伤;而单次大剂量放疗由于剂量大、分次次数少和治疗疗程短的原因,治疗中会减少细胞的修复、细胞周期再分布和增殖,这有利于肿瘤的控制但同时有可能增加了正常组织的损伤[16]。Yu等[8]对SIB-IMRT治疗食管癌的Ⅱ期研究结果进行了报道,其研究共入组了45名患者,其中27例患者接受了同步放化疗,另18例患者接受单纯放疗,放射治疗计划为肿瘤局部处以63 Gy/28次,每次2.25 Gy的剂量照射,亚临床病灶处以50.4 Gy/28次,每次1.8 Gy的剂量照射,结果显示患者3年OS、PFS和局控率分别为42.2%、40.7%和67.5%,中位总生存时间为21月,他们认为SIB-IMRT是食管癌患者可行的治疗方法,并提供了令人鼓舞的局部控制,同时具有低毒性。Chen等[12]进行了一项通过SIB-IMRT联合化疗治疗食管癌的放射剂量增加的Ⅱ期研究,分析了60名食管癌患者使用SIB-IMRT联合化疗治疗的放射剂量递增的可行性、安全性和有效性,放射治疗计划为肿瘤局部处以66 Gy/30次,每次2.2 Gy的剂量照射,亚临床病灶处以54 Gy/30次,每次1.8 Gy的剂量照射,结果98.3%的患者完成了治疗,患者1年和2年局部区域控制、无远处转移生存、无病生存率和总生存率分别为87.6%和78.6%,86.0%和80.5%,75.6%和64.4%,86.7%和72.7%,且不良反应可以耐受,他们由此得出SIB-IMRT联合化疗治疗使患者局部区域控制和总体生存率显着改善。以上研究结果与本研究结果相似。
本研究的不足之处是虽初步得出了PTV单次剂量 > 2 Gy组患者的预后好于常规分割组患者,但 > 2 Gy组患者的剂量不统一,为204~220 cGy,中位210 cGy,这样可能会降低其在临床实际工作中的指导意义。目前可以提高患者的生存、不增加正常组织的损伤等具体剂量还没有统一的认识,Yu等[17]进行了由18FDG-PET/CT引导的基于SIB-IMRT对食管癌原发性肿瘤的剂量递增安全性的一项研究,从2012年4月到2014年2月共25例患者接受了实验,研究证实了肿瘤局部剂量在70 Gy/25次,单次2.8 Gy条件下仍是安全有效的。Zhang等[18]同样认为与三维适形放疗和常规分割的调强适形放疗相比,SIB-IMRT技术可使肿瘤局部增加6 Gy的剂量而不增加周边正常组织的不良反应。对于接受新辅助治疗的食管癌患者,SIB-IMRT技术同样显示出了优越性[13]。有研究认为肿瘤局部剂量是患者疗效的保障[19],但也有研究[20]认为肿瘤局部接受单次分割220 cGy较215 cGy的局部控制和总生存率并未提高,但增加了不良反应。因此,我们认为肿瘤局部的最佳剂量仍有待于进一步的研究发现。
综上所述,选择性增加肿瘤局部剂量可以提高接受根治性放(化)疗食管癌患者的生存情况,而不增加患者的不良反应。
作者贡献
沈文斌:临床试验的设计、观察病例、收集数据、统计分析、论文撰写与修改
郭娜:指导临床试验的设计、审核数据及统计分析结果
祝淑钗:审核数据及统计分析结果、论文修改
曹彦坤:观察病例、物理计划审核
李曙光、许金蕊:许金蕊:观察病例、收集数据
| [1] | Cooper JS, Guo MD, Herskovic A, et al. Chemoradiotherapy of locally advanced esophageal cancer: long-term follow-up of a prospective randomized trial (RTOG 85-01)[J]. JAMA, 1999, 281(17): 1623–7. |
| [2] | Minsky BD, Pajak TF, Ginsberg RJ, et al. INT 0123 (Radiation Therapy Oncology Group 94-05) phase Ⅲ trial of combined-modality therapy for esophageal cancer: high-dose versus standard-dose radiation therapy[J]. J Clin Oncol, 2002, 20(5): 1167–74. DOI:10.1200/JCO.2002.20.5.1167 |
| [3] | 沈文斌, 祝淑钗. 食管癌术后患者放化疗临床应用研究进展[J]. 肿瘤防治研究, 2015, 42(6): 535–40. [ Shen WB, Zhu SC. Progress of clinical application of radiochemotherapy after esophagectomy[J]. Zhong Liu Fang Zhi Yan Jiu, 2015, 42(6): 535–40. ] |
| [4] | Shukovsky LJ, Fletcher GH. Time-dose and tumor volume relationships in the irradiation of squamous cell carcinoma of the tonsillar fossa[J]. Radiology, 1973, 107(3): 621–6. DOI:10.1148/107.3.621 |
| [5] | Lin SH, Wang L, Myles B, et al. Propensity score-based comparison of long-term outcomes with 3-dimensional conformal radiotherapy vs. intensity-modulated radiotherapy for esophageal cancer[J]. Int J Radiat Oncol Biol Phys, 2012, 84(5): 1078–85. DOI:10.1016/j.ijrobp.2012.02.015 |
| [6] | Zhang Z, Liao Z, Jin J, et al. Dose-response relationship in locoregional control for patients with stage Ⅱ-Ⅲ esophageal cancer treated with concurrent chemotherapy and radiotherapy[J]. Int J Radiat Oncol Biol Phys, 2005, 61(3): 656–64. DOI:10.1016/j.ijrobp.2004.06.022 |
| [7] | Welsh J, Palmer MB, Ajani JA, et al. Esophageal cancer dose escalation using a simultaneous integrated boost technique[J]. Int J Radiat Oncol Biol Phys, 2012, 82(1): 468–74. DOI:10.1016/j.ijrobp.2010.10.023 |
| [8] | Yu WW, Zhu ZF, Fu XL, et al. Simultaneous integrated boost intensity-modulated radiotherapy in esophageal carcinoma Early results of a phase Ⅱ study[J]. Strahlenther Onkol, 2014, 190(11): 979–86. DOI:10.1007/s00066-014-0636-y |
| [9] | Fu WH, Wang LH, Zhou ZM, et al. Comparison of conformal and intensity-modulated techniques for simultaneous integrated boost radiotherapy of upper esophageal carcinoma[J]. World J Gastroenterol, 2004, 10(8): 1098–102. DOI:10.3748/wjg.v10.i8.1098 |
| [10] | Geh JI, Bond SJ, Bentzen SM, et al. Systematic overview of preoperative (neoadjuvant) chemoradiotherapy trials in oesophageal cancer: evidence of a radiation and chemotherapy dose response[J]. Radiother Oncol, 2006, 78(3): 236–44. DOI:10.1016/j.radonc.2006.01.009 |
| [11] | Bednarek C, Crehange G, Quivrin M, et al. Mapping of failures after radiochemotherapy in patients with non-metastatic esophageal cancer; a posteriori analysis of the dose distribution in the sites of loco-regional relapse[J]. Radiother Oncol, 2015, 116(2): 252–6. DOI:10.1016/j.radonc.2015.07.019 |
| [12] | Chen JZ, Guo H, Zhai T, et al. Radiation dose escalation by simultaneous modulated accelerated radiotherapy combined with chemotherapy for esophageal cancer: a phaseⅡstudy[J]. Oncotarget, 2016, 7(16): 22711–9. |
| [13] | Zeng M, Aguila FN, Patel T, et al. Intensity modulated radiation therapy with simultaneous integrated boost based dose escalation on neoadjuvant chemoradiation therapy for locally advanced distal esophageal adenocarcinoma[J]. World J Gastrointest Oncol, 2016, 8(5): 474–80. DOI:10.4251/wjgo.v8.i5.474 |
| [14] | 白文文, 付丽媛, 李静, 等. 食管癌同期推量调强放疗和后程缩野加量调强放疗的临床对比研究[J]. 中华放射医学与防护杂志, 2018, 38(4): 258–64. [ Bai WW, Fu LY, Li J, et al. Comparison of simultaneous integrated boost and late course boost intensity-modulated radiation therapy in the treatment of esophageal carcinoma[J]. Zhonghua Fang She Yi Xue Yu Fang Hu Za Zhi, 2018, 38(4): 258–64. DOI:10.3760/cma.j.issn.0254-5098.2018.04.004 ] |
| [15] | Fowler JF. Rapid repopulation in radiotherapy: a debate on mechanism. The phantom of tumortreatment-continually rapid proliferation unmasked[J]. Radiother Oncol, 1991, 22(3): 156–8. DOI:10.1016/0167-8140(91)90017-B |
| [16] | 朱健, 岳晨曦, 尹勇, 等. 针对单次大剂量放疗的LQ及BED模型研究进展[J]. 中华放射肿瘤学杂志, 2018, 27(9): 859–63. [ Zhu J, Yue CX, Yin Y, et al. Research progress on linear quardratic and biological equivalent dose models for hig-dose-per-fractionradiotherapy[J]. Zhonghua Fang She Zhong Liu Xue Za Zhi, 2018, 27(9): 859–63. DOI:10.3760/cma.j.issn.1004-4221.2018.09.015 ] |
| [17] | Yu W, Cai XW, Liu Q, et al. Safety of dose escalation by simultaneous integrated boosting radiation dose within the primary tumor guided by (18)FDG-PET/CT for esophageal cancer[J]. Radiother Oncol, 2015, 114(2): 195–200. DOI:10.1016/j.radonc.2014.12.007 |
| [18] | Zhang WZ, Chen JZ, Li DR, et al. Simultaneous modulated accelerated radiation therapy for esophageal cancer: a feasibility study[J]. World J Gastroenterol, 2014, 20(38): 13973–80. DOI:10.3748/wjg.v20.i38.13973 |
| [19] | 任雪姣, 刘丽虹, 王澜, 等. 548例食管癌3DRT的GTV受量分析与预后[J]. 中华放射肿瘤学杂志, 2016, 25(11): 1172–6. [ Ren XJ, Liu LH, Wang L, et al. Gross tumor volume dosimetry and prognosis of esophageal carcinoma treatwith three-dimensional radiotherapy: a study of 548 patients[J]. Zhonghua Fang She Zhong Liu Xue Za Zhi, 2016, 25(11): 1172–6. DOI:10.3760/cma.j.issn.1004-4221.2016.11.006 ] |
| [20] | 白文文, 宋玉芝, 乔永志, 等. 食管鳞癌SIB-IMRT疗效及预后因素分析[J]. 中华放射肿瘤学杂志, 2018, 27(6): 570–5. [ Bai WW, Song YZ, Qiao YZ, et al. Clinical efficacy and probnosis factors of simultaneous integrated boost intensity-modulated radiation therapr for esophageal sequamous cell carcinoma[J]. Zhonghua Fang She Zhong Liu Xue Za Zhi, 2018, 27(6): 570–5. DOI:10.3760/cma.j.issn.1004-4221.2018.06.007 ] |
 2019, Vol. 46
2019, Vol. 46


