文章信息
- 新型NGR靶向载shRNA脂质微球抑制胶质瘤的生长
- New NGR-targeted shRNA-loaded Liposome Suppresses Glioma Growth
- 肿瘤防治研究, 2019, 46(8): 677-682
- Cancer Research on Prevention and Treatment, 2019, 46(8): 677-682
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.18.1990
- 收稿日期: 2018-12-25
- 修回日期: 2019-06-03
2. 400010 重庆,重庆医科大学附属第二医院超声影像研究所
2. Institute of Ultrasound Imaging, The Second Affiliated Hospital of Chongqing Medical University, Chongqing 400010, China
胶质瘤是目前最常见的神经系统肿瘤,其年发病率为6/105[1],尽管目前大多采用手术切除、术后放疗及化疗的标准化治疗方案[2],但胶质瘤治疗预后仍不佳[3],5年生存率仅稍高于胰腺癌和肺癌,世界卫生组织已将其定为最难治疗的恶性肿瘤之一[4],故目前迫切需要治疗胶质瘤的新方法。RNAi技术因其高度的特异性和安全性有望成为根治肿瘤的有效方式[5]。在中枢神经系统(central nerves system, CNS)中,血脑屏障(blood brain barrier, BBB)阻止了约98%的小分子物质和几乎100%的生物大分子物质进入CNS,对维持神经细胞内环境的稳定起了重要作用,但同时也阻止了对CNS疾病起治疗作用的药物或者基因进入其中[6],如何实现靶基因shRNA跨过BBB转移到肿瘤细胞并抑制癌基因的表达是RNAi技术治疗胶质瘤的关键。脂质体作为一种细胞组成成分能通过内吞作用进入细胞,同时也能有效保护质粒不被降解而成为一种理想的基因载体[7]。但传统脂质体由于粒径大、携带负电荷及缺乏识别BBB的特异蛋白等原因,不能透过BBB将基因递送至CNS内,其在胶质瘤治疗中的使用也受到限制。
NGR是一种由天冬酰胺、甘氨酸、精氨酸人工合成的三肽(Asn-Gly-Arg),其靶向配体为表达于细胞表面的CD13。CD13是一种膜结合的金属肽酶,是新血管生成的重要调节因子。在胶质瘤细胞及新生血管内皮细胞上CD13的表达较正常细胞及组织明显增高,且这种高表达的CD13受体能够特异性识别NGR,而表达于正常细胞和组织中的CD13没有该功能[8]。我们拟通过碳二亚胺法将NGR连接到脂质体上,利用NGR与CD13的结合促进脂质体跨过BBB或血瘤屏障(blood tumor barrier, BTB),从而使其携带的shRNA进入靶细胞中。Birc5作为凋亡抑制因子中的一员,具有抑制凋亡、促进血管生成以及与化疗药物耐药相关等作用[9]。Birc5只在恶性肿瘤中表达而不表达于正常组织的特性使其成为绝佳的靶向基因[10]。所以,我们拟构建一个含有Birc5 shRNA(shBirc5)的质粒,使用lipo-NGR将其递送至靶细胞内发挥RNAi效应,以达到治疗肿瘤的目的,从而为胶质瘤提供一种新的治疗方式。
1 材料与方法 1.1 试剂与仪器二棕榈酰磷脂酰胆碱(DPPC)、聚乙二醇二硬脂酰磷脂酰乙胺-羟基聚合物(DSPE-PEG2K-COOH)、3β-[N-(N’, N’-二甲基胺乙基)甲酰基]胆固醇(DC-chol)、1-(3-二甲氨基丙基)-3乙基碳二亚胺盐(EDC)、N-羟基丁二酰亚胺(NHS)、天冬酰胺-甘氨酸-精氨酸多肽(NGR),均购自美国Avanti公司。高纯度质粒大提试剂盒质粒pRNAT-U6.1/Neo被用来构建Birc5的shRNA,购自广州锐博生物技术公司。FA2004电子天平(上海精密仪器科学有限公司),VCX-130型声振仪(美国Sonic公司),激光粒度分析仪(Zetasizer Nano ZS90),RE-52A旋转蒸发仪(上海亚荣生化器械公司),脂质体挤出仪(美国Avanti公司)。shBric5-F序列为5'-GATCCCGCCGGATGACAACCCTAT-AGTTGATATCCGC-TATAG-GGTTGTCATCCGGTTTTTT-3',shBirc5-R序列为5'-AGCTTTTGGAAAAAAACCGGATGACAACCCTATAGCGGATATCAACTATAGGGT TGTCATCCGGCGG-3',未添加shRNA序列的pRNAT-U6.1/Neo作为对照shControl。
1.2 微球的制备使用电子天平精确称取DPPC、DSPE-PEG2K-COOH、DC-chol分别为5、2、1 mg于圆底烧瓶中。向圆底烧瓶中加入40 ml CDl3溶解混匀各脂质体,将烧瓶安装至旋转蒸发仪上,50℃水浴5 min,持续水浴并旋转蒸发40 min成膜。成膜成功后,向烧瓶中加入50℃水浴30 min的PBS缓冲液2 ml,使用声振仪振荡2 min。将所得到的脂质体混悬液依次通过挤出仪上孔径为800、400、200和100 nm的滤过膜即得到含有PBS的脂质体微球(lipo)[11]。
1.3 NGR靶向载shBirc5脂质体的制备将上述制备的lipo用低温离心机10 000 r/min离心8 min,使用pH=6.0的MES缓冲液重悬lipo,按摩尔比COOH:EDC:NHS=1:10:30向混悬液中加入NGR溶液(1 mg/ml)。将混悬液冰浴置于振荡仪上80 r/min振荡6 h,10 000 r/min离心8 min,重复3次后即得到lipo-NGR。向lipo-NGR中加入1.8 mg量shBirc5,利用正负电荷的吸引力使lipo-NGR与shBirc5连接,10 000 r/min离心5 min后即得到shBirc5-lipo-NGR[12]。光学显微镜下观察脂质体的形态,激光粒度分析仪测定各脂质体的粒径及电位。
1.4 建立SD大鼠原位C6细胞肿瘤模型细胞的准备:取对数生长期的C6细胞,制成浓度为1×108/ml的细胞悬液,冰浴备用。常规术前准备、麻醉、备皮、固定及消毒。在头皮正中沿身体长轴切开长约5 mm的切口,找到前囟点,于bregma点右侧3 mm、前方1 mm处,使用电动磨钻钻一小孔,微量注射器吸取C6细胞悬液10 μl,并固定到立体定向仪上,针尖对准颅骨上的小孔并与硬脑膜接触。扭动定向仪上的旋钮缓慢进针,控制速度为1 mm/min,进针5.5 mm后停留1 min,再向后退1 mm,缓慢将微量注射器内的C6细胞注入SD大鼠脑组织中,速度约为1 μl/min,推注完毕后留针10 min。缓慢退针(1 mm/min),骨蜡涂抹颅骨进针小孔后全层缝合手术切口。在种瘤后7、22天时行MRI T2加权像检查肿瘤的形成情况(层厚0.8 mm),选取成瘤佳的大鼠进行后续实验。
1.5 实验分组及观察将28只成瘤大鼠随机分成4组。第1组(对照组):尾静脉注射2 ml 0.9%氯化钠溶液;第2组(shBirc5-lipo组):经尾静脉注入2 ml shBirc5-lipo;第3组(shControl-lipo-NGR组):经尾静脉注入2 ml shControl-lipo-NGR;第4组(shBirc5-lipo-NGR组):经尾静脉注射2 ml shBirc5-lipo-NGR。每组随机抽取2只大鼠,处理后第10天,2 ml的1%戊巴比妥处死所有SD大鼠,灌洗后取出脑组织,切片后使用免疫组织化学法观察肿瘤细胞Birc5蛋白表达情况。剩下的20只大鼠每隔5天行MRI T2加权像检测,并按公式V肿瘤=[长(最大层面)×宽(最大层面])×层数×0.8/2计算肿瘤大小。按公式V=V目前/V第7天得到肿瘤的生长速度。观察大鼠的生存时间,在大鼠出现意识障碍、不能进食时用2 ml 1%戊巴比妥处死大鼠,记录当天为大鼠经治疗后的生存时间。
1.6 统计学方法采用SPSS22.0统计软件进行分析,计量资料以均数±标准差(x±s)表示,两组间比较采用独立样本t检验,P < 0.05为差异有统计学意义。
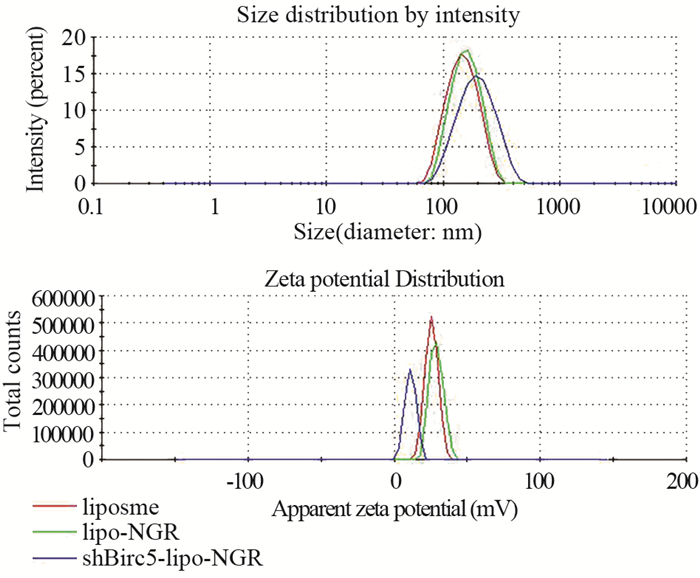
2 结果 2.1 shBirc5-lipo-NGR的制备及检测制得的lipo浓度为(5.02±0.23)×1011/ml,为粒径均一的圆球形,见图 1,其粒径和电位分别为(158.6±46.2)nm和(25.5±4.38)mV。lipo-NGR的平均粒径为(165.6±46.59)nm,较lipo有所增加,但两者间的差异无统计学意义(P=0.901),lipo-NGR的表面电位为(28.9±4.68)mV,两者间差异有统计学意义(P=0.04)。说明NGR对lipo的粒径影响小,而对其电位有明显的增加作用。制得的lipo-NGR与过量的shBirc5充分反应后,测得的粒径为(186.2±74.07)nm,电位为(10.9±3.76)mV,见图 2。

|
| 图 1 白光下显微镜显示shBirc5-lipo-NGR的形态和大小 Figure 1 Shape and size of shBirc5-lipo-NGR observed by bright-field microscopy |
|
| 图 2 Zetasizer Nano ZS90测量lipo、lipo-NGR和shBirc5- lipo-NGR的粒径和电位 Figure 2 Zeta potential and particle size of lipo, lipo-NGR and shBirc5-lipo-NGR measured by Zetasizer Nano ZS90 |
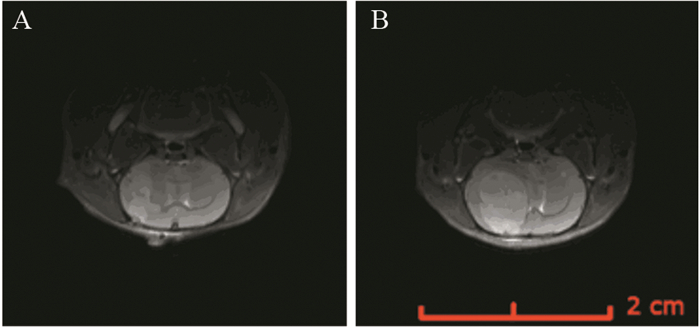
通过MRI T2加权像显像技术,发现肿瘤在成瘤后第7天时生长于大鼠右侧大脑的基底节区,平均大小为(12.21±2.42)mm3,见图 3A。而成瘤后第22天,肿瘤几乎占据了大鼠的整个右侧大脑,正常的脑组织受压严重,甚至对侧脑组织也有轻微受压偏移。其平均肿瘤大小为(273.42±36.37)mm3,证明SD大鼠原位C6细胞肿瘤模型构建成功,见图 3B。
|
| 图 3 MRI T2像显示种植C6细胞后原位肿瘤在第7天(A)和第22天(B)时的形成情况 Figure 3 Orthotopic tumor formation at 7(A) and 22 days (B) after implantation of C6 cells illustrated by T2-weighted MRI |
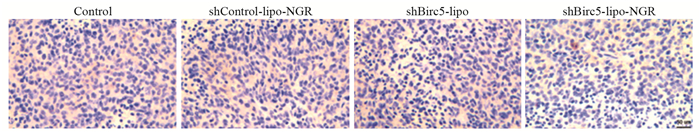
免疫组织化学结果显示,shBirc5-lipo-NGR组Birc5蛋白较对照、shBirc5-lipo、shControl-lipo-NGR组明显减少。说明shBirc5-lipo-NGR在大鼠体内能跨过BBB或者血瘤屏障(blood tumor barrier, BTB)进入胶质瘤细胞,并使其携带的shBirc5产生RNAi效应,进而抑制Birc5蛋白的表达,而shBirc5-lipo、shControl-lipo-NGR与Control组比较,Birc5无明显减少,证实了NGR对新生血管内皮细胞和胶质瘤细胞的靶向性,并且能对Birc5蛋白的表达发挥RNAi效应,见图 4。
|
| 图 4 免疫组织化学法检测各组Birc5蛋白表达情况 Figure 4 Expression of Birc5 protein in each group showed by immunohistochemistry |
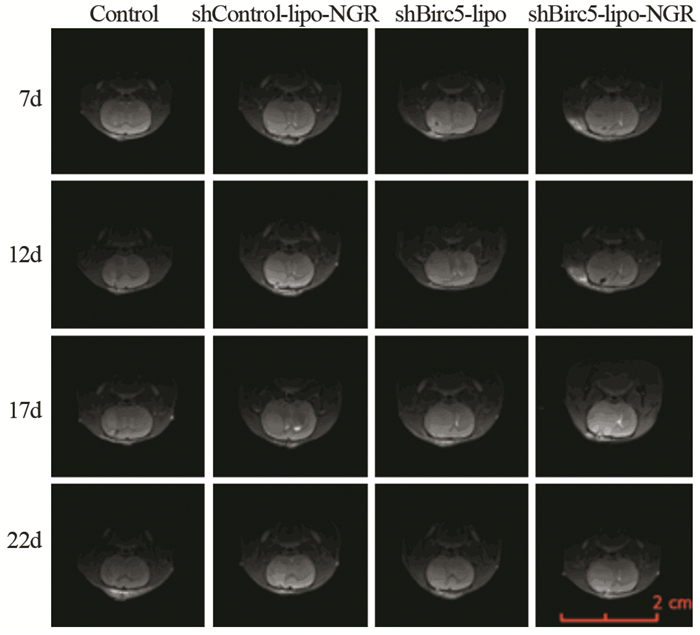
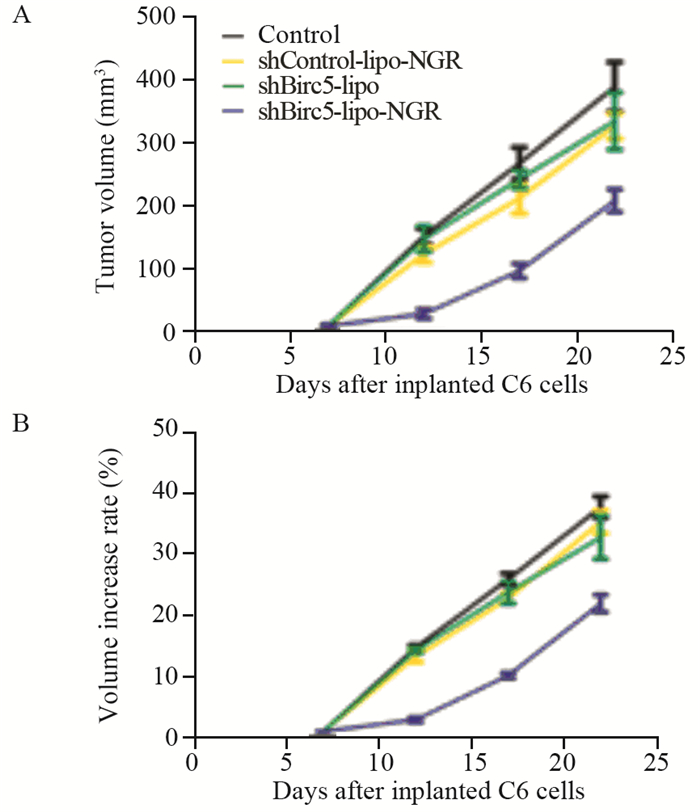
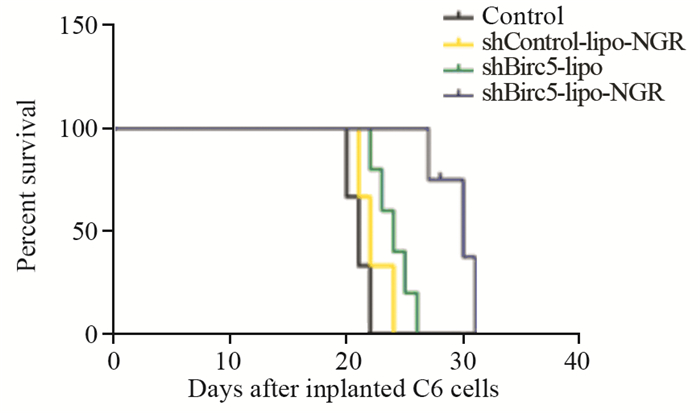
在成瘤后的第12、17和22天时,对照组肿瘤的平均体积是shBirc5-lipo-NGR组的4.7倍左右,说明shBirc5-lipo-NGR能够抑制肿瘤的生长(P < 0.001)。而对照组分别与shBirc5-lipo和shControl-lipo-NGR组中肿瘤体积对比,差异无统计学意义(P=0.459, P=0.468),见图 5、图 6A。对比肿瘤生长的速度也得出了相似的结果,见图 6B。对照、shBirc5-lipo、shControl-lipo-NGR和shBirc5-lipo-NGR组的中位生存期分别为21、22、24和30天,见图 7。分别与对照、shBirc5-lipo和shControl-lipo-NGR组比较,shBirc5-lipo-NGR组的中位生存时间明显延长,且差异有统计学意义(P=0.010、0.010、0.005),证实了shBirc5-lipo-NGR能延长SD大鼠原位C6胶质瘤生存期,且这种抑制作用是通过shBirc5介导的。
|
| 图 5 MRI T2相监测大鼠植入C6细胞后肿瘤在7、12、17和22天时的生长情况 Figure 5 Tumors growth at 7, 12, 17 and 22 days after C6 cells implantation longitudinally monitored by T2-weighted MRI |
|
| 图 6 基于MRI T2相分析肿瘤大小(A)和生长速率(B) Figure 6 Tumor volume(A) and its increase rate(B) analyzed by longitudinal T2-weighted MRI |
|
| 图 7 不同处理组荷瘤大鼠生存曲线 Figure 7 Survival curves (Kaplan-Meier plot) of gliomabearing rats in different groups |
RNAi技术因其能特异性的沉默靶基因mRNA抑制其蛋白的表达而成为近年基因编辑的研究热点,其高度的特异性和安全性有望成为根治肿瘤的有效方式。RNAi技术主要包括siRNA、shRNA、dsRNA等几种形式,相比于其他形式,shRNA具有性质稳定、能自我复制、抑制率高等特点而被广泛使用[13]。
在CNS疾病中,药物或基因能够透过BBB是其对疾病达到治疗目的的前提,药物或基因对BBB的通透性是由它的粒径、电位、脂溶性及是否有受体介导决定的[14]。如何实现靶基因shRNA跨过BBB转移到肿瘤细胞并抑制癌基因的表达是RNAi技术治疗胶质瘤的关键。本实验最终制得的shBirc5-lipo-NGR,其粒径为(186.2±74.07)nm,为基因载体在肿瘤部位产生保留(enhanced permeability and retention, EPR)效应[15]提供条件。为了提高转染效率,用于基因转染的纳米粒带少量正电荷或者不带电荷[16]。本实验中制得的lipo-NGR经激光粒度分析仪测得的电位为(28.9±4.68)mV,在与shBirc5充分结合后其电位降为(10.9±3.76)mV,利用电荷吸引能很好地与血管内皮细胞及胶质瘤细胞结合,并为最终由NGR-CD13介导shBirc5-lipo-NGR跨过BBB或者BTB提供条件[17]。
NGR作为靶向因子,能特异性识别高表达CD13的新生血管内皮细胞和胶质瘤细胞,通过其与靶蛋白CD13结合介导靶细胞对shBirc5-lipo-NGR的内吞作用,进而发挥RNAi效应,同时达到了跨BBB和BTB的目的,为治疗SD大鼠原位胶质瘤提供条件[18]。
在体内实验中,为了证实shBirc5-lipo-NGR能对胶质瘤发挥治疗作用,我们使用MRI T2动态监测肿瘤的大小,并同时记录了每只SD大鼠的生存时长。结果显示shBirc5-lipo-NGR能明显抑制肿瘤的生长和延长荷瘤大鼠的生存时长。而使用shBirc5-lipo或shControl-lipo-NGR均未对肿瘤的生长和生存期发挥明显作用。相较于使用微泡开放BBB后应用载体向胶质瘤细胞递送基因,shBirc5-lipo-NGR具有以下优点:(1)更简洁的操作流程:使用shBirc5-lipo-NGR只需注射一次药物,而使用微泡需至少注射两次,并且需借助超声来开放BBB;(2)更高的安全性:在超声联合微泡开放BBB的过程中,微泡量过多或者超声强度过大,极易引起脑出血、肺栓塞等致死性并发症,而使用大量shBirc5-lipo-NGR也不会出现这类并发症。本研究中也存在一些不足,使用本新型靶向shBirc5脂质载体并未达到治愈肿瘤的目的,这可能是因为胶质瘤细胞及新生血管内皮细胞上CD13受体量有限,相应地限制了由其介导的细胞内吞作用,从而使RNAi效应发挥不完全。这是由细胞本身的特性决定的。另一方面,由于基因的异质性,Birc5蛋白在肿瘤的生长过程中发挥的作用有限,还有许多其他的蛋白(比如TEM7、S100 A8和S100 A9蛋白等)具有促进肿瘤生长的作用[19-20]。这种不足可以通过使用几种在胶质瘤生长过程中发挥关键作用的蛋白shRNA来加以克服[21]。
在本研究中,我们成功制备了靶向载shBirc5脂质微球shBirc5-lipo-NGR,并将其应用于SD大鼠原位胶质瘤模型,应用免疫组织化学、MRI T2显像等技术及手段证实了shBirc5-lipo-NGR对胶质瘤的靶向性及抑制作用。靶向载基因脂质微球因其能跨过BBB/BTB,有望作为胶质瘤治疗的一种新方法,但要将其成功应用于临床仍有大量工作需要完成。
作者贡献
赵贯建:shBirc5-lipo-NGR的制作及表征、参与部分动物实验、论文撰写
张翔:共同完成shBirc5-lipo-NGR的制作及表征
程远:指导大鼠活体实验部分及论文撰写
王志刚:指导shBirc5-lipo-NGR的制作及表征
黄琴:共同完成动物实验部分及指导论文撰写
| [1] | Ricard D, Idbaih A, Ducray F, et al. Primary brain tumours in adults[J]. Lancet, 2012, 379(9830): 1984–1996. DOI:10.1016/S0140-6736(11)61346-9 |
| [2] | Bush NA, Chang SM, Berger MS. Current and future strategies for treatment of glioma[J]. Neurosurg Rev, 2017, 40(1): 1–14. DOI:10.1007/s10143-016-0709-8 |
| [3] | Urhie O, Tuener R, Lucke-Wold B, et al. Glioblastoma Survival Outcomes at a Tertiary Hospital in Appalachia: Factors Impacting the Survival of Patients Following Implementation of the Stupp Protocol[J]. World Neurosurg, 2018, 115: e59–e66. DOI:10.1016/j.wneu.2018.03.163 |
| [4] | Wang T, Niu X, Cao T, et al. Prognostic Factors for Survival Outcome of High-Grade Multicentric Glioma[J]. World Neurosurg, 2018, 112: e269–e277. DOI:10.1016/j.wneu.2018.01.035 |
| [5] | Gavrilov K, Saltzman WM. Therapeutic siRNA: principles, challenges, and strategies[J]. Yale J Biol Med, 2012, 85(2): 187–200. |
| [6] | Aryal M, Vykhodtseva N, Zhang YZ, et al. Multiple treatments with liposomal doxorubicin and ultrasound-induced disruption of blood-tumor and blood-brain barriers improve outcomes in a rat glioma model[J]. J Control Release, 2013, 169(1-2): 103–111. DOI:10.1016/j.jconrel.2013.04.007 |
| [7] | Ozpolat B, Sood AK, Lopez-Berestein G. Liposomal siRNA nanocarriers for cancer therapy[J]. Adv Drug Deliv Rev, 2014, 66: 110–116. DOI:10.1016/j.addr.2013.12.008 |
| [8] | Huang N, Cheng S, Zhang X, et al. Efficacy of NGR peptide-modified PEGylated quantum dots for crossing the blood-brain barrier and targeted fluorescence imaging of glioma and tumor vasculature[J]. Nanomedicine, 2017, 13(1): 83–93. |
| [9] | Mita AC, Mita MM, Nawrocki ST, et al. Survivin: key regulator of mitosis and apoptosis and novel target for cancer therapeutics[J]. Clin Cancer Res, 2008, 14(16): 5000–5005. DOI:10.1158/1078-0432.CCR-08-0746 |
| [10] | Carrasco RA, Stamm NB, Marcusson E, et al. Antisense inhibition of survivin expression as a cancer therapeutic[J]. Mol Cancer Ther, 2011, 10(2): 221–232. DOI:10.1158/1535-7163.MCT-10-0756 |
| [11] | Yoon YI, Kwon YS, Cho HS, et al. Ultrasound-Mediated Gene and Drug Delivery Using a Microbubble-Liposome Particle System[J]. Theranostics, 2014, 4(11): 1133–1144. DOI:10.7150/thno.9945 |
| [12] | Chen S, Zhang J, Chen Y, et al. Application of Phenol/Amine Copolymerized Film Modified Magnesium Alloys: Anticorrosion And Surface Biofunctionalization[J]. ACS Appl Mater Interfaces, 2015, 7(44): 24510–24522. DOI:10.1021/acsami.5b05851 |
| [13] | Buduru S, Zimta AA, Ciocan C, et al. RNA interference: new mechanistic and biochemical insights with application in oral cancer therapy[J]. Int J Nanomedicine, 2018, 13: 3397–3409. DOI:10.2147/IJN.S167383 |
| [14] | Saunders NR, Dreifuss JJ, Dziegielewska KM, et al. The rights and wrongs of blood-brain barrier permeability studies: a walk through 100 years of history[J]. Front Neurosci, 2014, 8: 404. |
| [15] | Lin F, de Gooijer MC, Hanekamp D, et al. Targeting core (mutated) pathways of high-grade gliomas: challenges of intrinsic resistance and drug efflux[J]. CNS Oncol, 2013, 2(3): 271–288. |
| [16] | Chakraborty A, Dhar P. A Review on Potential of Proteins as an Excipient for Developing a Nano-Carrier Delivery System[J]. Crit Rev Ther Drug Carrier Syst, 2017, 34(5): 453–488. DOI:10.1615/CritRevTherDrugCarrierSyst.2017018612 |
| [17] | Seidi K, Jahanban-Esfahlan R, Monhemi H, et al. NGR(Asn-Gly-Arg)-targeted delivery of coagulase to tumor vasculature arrests cancer cell growth[J]. Oncogene, 2018, 37(29): 3967–3980. DOI:10.1038/s41388-018-0213-4 |
| [18] | Kessler T, Baumeier A, Brand C, et al. Aminopeptidase N(CD13):Expression, Prognostic Impact, and Use as Therapeutic Target for Tissue Factor Induced Tumor Vascular Infarction in Soft Tissue Sarcoma[J]. Transl Oncol, 2018, 11(6): 1271–1282. DOI:10.1016/j.tranon.2018.08.004 |
| [19] | Carpenter RL, Paw I, Zhu H, et al. The gain-of-function GLI1 enhances expression of VEGF-C and TEM7 to promote glioblastoma angiogenesis[J]. Oncotarget, 2015, 6(26): 22653–22665. |
| [20] | Arora A, Patil V, Kundu P, et al. Serum biomarkers identification by iTRAQ and verification by MRM: S100A8/S100A9 levels predict tumor-stroma involvement and prognosis in Glioblastoma[J]. Sci Rep, 2019, 9(1): 2749. |
| [21] | Sun J, Wang L, Dong MM, et al. Construction and identification of multiple genes Co silence of plasmid shRNA[J]. Int J Clin Exp Med, 2015, 8(12): 22053–22062. |
 2019, Vol. 46
2019, Vol. 46


