文章信息
- 茯苓多糖对人宫颈癌HeLa细胞增殖、迁移、促凋亡的影响及其机制
- Effects of Pachymaran on Proliferation, Migration and Pro-apoptosis of Human Cervical Carcinoma HeLa Cells and Its Mechanism
- 肿瘤防治研究, 2019, 46(8): 707-713
- Cancer Research on Prevention and Treatment, 2019, 46(8): 707-713
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.18.1960
- 收稿日期: 2018-12-18
- 修回日期: 2019-05-21
茯苓又称茯菟,是具有利水渗湿、健脾胃、宁心安神作用的多孔菌科真菌茯苓的干燥菌核[1]。茯苓多糖是茯苓的主要化学成分之一,其他主要化学成分还有三萜、脂肪酸、甾醇等。临床及现代药理学研究表明茯苓多糖具有抗病毒、抗肿瘤活性、减轻放化疗不良反应、调节免疫功能、抗炎、抗衰老等药理作用[2-3]。研究表明,茯苓多糖能够抑制胃癌[4]、卵巢癌[5]、肺癌[6]等多种肿瘤细胞的增殖。但针对宫颈癌细胞这方面的研究较少见,且其促凋亡作用机制的相关研究也不十分清楚。本文研究了其促凋亡作用与ERK信号通路的关系,证实茯苓多糖是通过下调p-ERK1/2表达,抑制ERK信号通路发挥促凋亡作用的。除此之外,本文还对其是否有促进迁移方面的影响做了相关研究。希望通过研究茯苓多糖对HeLa细胞的增殖、凋亡、迁移的影响,探究其发挥抗肿瘤机制的关键节点,以期为茯苓多糖的临床治疗和临床用药范围提供有利的实验依据。
1 材料与方法 1.1 材料茯苓多糖粉末购于南通飞宇生物科技有限公司,以无菌水充分溶解后,制成母液浓度,0.22 μm滤膜无菌过滤除菌,用培养基稀释至目的浓度;人宫颈癌HeLa细胞由锦州医科大学附属第一医院实验室友情提供;高糖DMEM培养基、青-链霉素、二甲基亚砜(DMSO)均购于沈阳科硕商贸公司;胎牛血清购于上海宾智生物科技有限公司;MTT购于厦门研科生物技术有限公司;Hoechst33342染色液购于北京碧云天生物科技有限公司;Annexin V/PI细胞凋亡检测试剂盒、细胞周期检测试剂盒购于上海翊圣生物科技有限公司;Cleaved Caspase 3、Cleaved Caspase 8、Cleaved Caspase 9、Bcl-2、Bax、MMP-9、VEGFA、p-ERK1/2、ERK1/2抗体均购于沈阳万类生物科技有限公司。
1.2 方法 1.2.1 细胞培养人宫颈癌HeLa细胞培养于含10%胎牛血清、1%青-链霉素的高糖DMEM完全培养基中,置于37℃、5%CO2、饱和湿度的培养箱内。每2天更换1次完全培养基。待细胞铺满皿底后按1:3传代。取对数生长期细胞进行相关实验。
1.2.2 MTT法检测细胞增殖率取对数生长期的HeLa细胞,调整细胞浓度为1×105个/毫升,100 μl每孔接种于96孔板。贴壁后加入不同浓度的茯苓多糖,于不含血清的培养基中培养24 h。培养结束前4 h加入MTT和DMSO,室温振荡10 min,酶标仪检测吸光度值(OD值),计算细胞存活率。并筛选出适宜的低、中、高浓度用于后续实验。
1.2.3 倒置相差显微镜观察细胞形态学变化取对数生长期的HeLa细胞,调整细胞浓度为5 000个/孔接种于6孔板。细胞培养贴壁后加入不同浓度的茯苓多糖,药物作用24 h后,于倒置相差显微镜下观察不同浓度药物对HeLa细胞形态、数量、生长速度的影响并拍照。
1.2.4 Hoechst33342染色法荧光显微镜下观察细胞核变化细胞处理同1.2.3,药物作用24 h后,Hoechst33342染料避光染色并置于培养箱作用30 min,PBS避光洗涤3次,于荧光显微镜下观察分析细胞核形态变化并拍照。
1.2.5 平板克隆实验检测细胞克隆形成能力取对数生长期的HeLa细胞,细胞浓度为500个/孔,接种于6孔板,培养于含不同浓度药物的完全培养基中,至出现细胞集落时终止培养。4%多聚甲醛固定20 min,0.1%结晶紫染色,漂洗干净后常温晾干,计数各组细胞的细胞克隆数量并拍照。
1.2.6 划痕实验观察细胞迁移率细胞处理同1.2.3,细胞培养贴壁后,用100 μl枪头于每个孔做“十字形”划痕,于含不同药物浓度的无血清培养基中培养。显微镜下观察未加药、加药12 h、加药24 h和加药36 h的细胞生长密度、形态及划痕面积等变化情况并拍照。Image J软件进行划痕面积分析。
1.2.7 Annexin V-FITC/PI法检测细胞凋亡率取对数生长期HeLa细胞,接种于6孔板内,贴壁后分别加入不同浓度的茯苓多糖,药物作用24 h后,胰酶(不含EDTA)室温消化,完全培养基终止反应,预冷的PBS漂洗细胞并进行细胞计数,1200 r/min、4℃离心5 min,收集2×105个细胞。依次加入100 μl 1×Binding Buffer、5 μl Annexin V-FITC、10 μl PI混匀,室温避光孵育15 min。再加入400 μl 1×Binding Buffer,彻底混匀后置于冰上,1 h内用流式细胞仪检测分析细胞凋亡率。
1.2.8 流式细胞仪检测细胞周期细胞处理同1.2.7,并调整细胞浓度为1×106个/毫升。70%冷乙醇固定过夜。染色前用预冷PBS洗去固定液,加入100 μl RNase A,37℃水浴30 min,再加入500 μl PI,混匀后4℃避光30 min。流式细胞仪检测分析细胞周期。
1.2.9 Western blot法检测增殖、凋亡、迁移、ERK通路相关蛋白的表达取对数生长期的HeLa细胞,贴壁后分别加入不同浓度的茯苓多糖,药物作用24 h后,用预冷的PBS洗涤2次,于冰上加入裂解液,-20℃裂解过夜后,12 000 r/min、4℃离心25 min,收集总蛋白,BCA法测定相应蛋白浓度并分别稀释至相同的终浓度。取等量蛋白进行SDS-PAGE电泳,电转至PVDF膜上,封闭1 h,加入相应抗体,β-actin作为内参,4℃孵化过夜。TBST洗膜3次,加入相应二抗室温下孵育1 h,TBST洗膜3次,加入ECL发光液显色,自动电泳凝胶成像分析仪采集图像。Image J软件进行灰度分析,以目的蛋白与内参的吸光度比值表示相对蛋白含量。
1.3 统计学方法用SPSS 16.0统计软件进行分析。数据均采用均数±标准差(x±s)表示,组间两两比较采用t检验,以P < 0.05为差异有统计学意义。
2 结果 2.1 茯苓多糖对HeLa细胞增殖率的影响当药物浓度大于30 mg/ml时,与对照组相比,有明显的增殖抑制作用,并随药物浓度增加,其增殖抑制作用越明显(P < 0.05)。当药物浓度大于60 mg/ml时,可使细胞活力下降接近或超过50%的效应。为防高浓度可能会直接杀死细胞,导致后续实验取材时所获细胞数引起偏差而造成实验较大误差,取30、40、50 mg/ml茯苓多糖作为低、中、高浓度进行后续实验,见图 1、表 1。
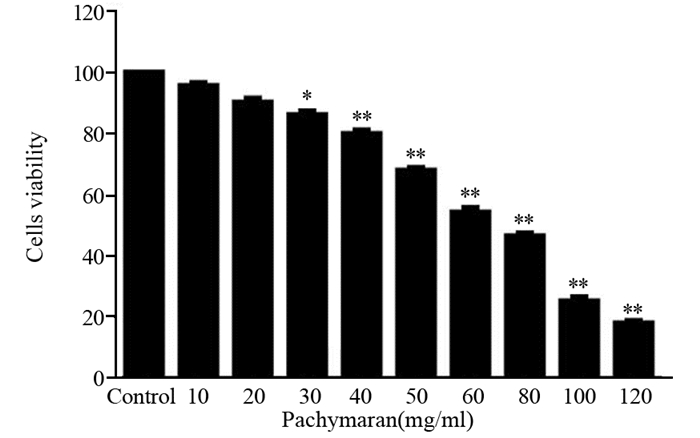
|
| 图 1 茯苓多糖对HeLa细胞存活率的影响 Figure 1 Pachymaran inhibited viability of HeLa cells |
|
对照组的细胞呈不规则的多边形,生长密集,细胞间连接紧密,细胞轮廓清晰。药物处理24 h后,细胞间连接疏松或脱壁,细胞形态变圆或有逐渐向梭形变化的趋势,数量减少,培养基上清中漂浮着较多透亮的死细胞和细胞碎片,胞质、胞核可见较多颗粒,且上述改变随药物浓度增加更加显著,见图 2。

|
| 图 2 茯苓多糖对HeLa细胞形态的影响(×200) Figure 2 Morphology of HeLa cells after pachymaran treatment (×200) |
茯苓多糖作用24 h后,与对照组细胞相比,中、高浓度组可见明显的核膜皱缩,呈碎块状、新月形,致密浓染,细胞核大小不均匀,轮廓不清,颜色明显发白。且随着药物浓度增加,细胞形态变化更显著。对照组细胞呈均匀的蓝色,核膜完整,细胞大小较匀称,见图 3。

|
| 图 3 茯苓多糖对HeLa细胞核形态的影响(×200) Figure 3 Nuclear morphology of HeLa cells after pachymaran treatment (×200) |
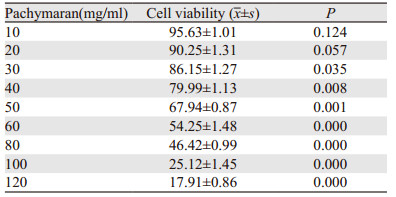
与对照组相比,药物组的细胞克隆形成能力明显减弱,并随着药物浓度的增加其抑制克隆形成能力越明显,见图 4。
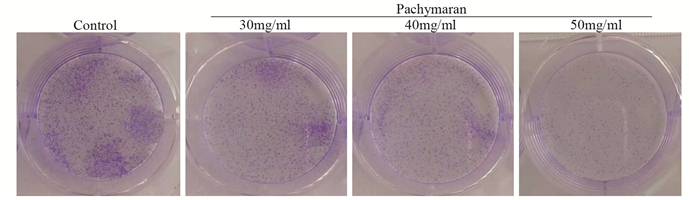
|
| 图 4 茯苓多糖对HeLa细胞克隆形成能力的影响 Figure 4 Effects of pachymaran on cloning ability of HeLa cells |
以不同浓度药物作用不同时间后的细胞迁移能力较对照组都受到明显抑制(12 h, 30 mg/ml: t=7.752, P < 0.01; 40 mg/ml: t=3.989, P < 0.01; 50 mg/ml: t=4.734, P < 0.05; 24 h, 30 mg/ml: t=2.315, P < 0.01; 40 mg/ml: t=3.989, P < 0.01; 50 mg/ml: t=4.734, P < 0.01; 36 h, 30 mg/ml: t=2.315, P < 0.01; 40 mg/ml: t=3.989, P < 0.01; 50 mg/ml: t=4.734, P < 0.01),且随着药物浓度和作用时间延长,其对细胞迁移的抑制作用越明显,见图 5。

|
| P < 0.05, Pachymaran groups vs. Control group(0h) 图 5 茯苓多糖对HeLa细胞迁移率的影响 Figure 5 Migration rate of HeLa cells after pachymaran treatment |
茯苓多糖作用24 h后,与对照组相比,HeLa细胞凋亡率显著增加,且呈剂量相关性(30 mg/ml: t=9.525, P < 0.01; 40 mg/ml: t=13.109, P < 0.01; 50 mg/ml: t=15.233, P < 0.01)。其中,晚期凋亡和坏死细胞的比例较早期凋亡细胞明显增加,见图 6。
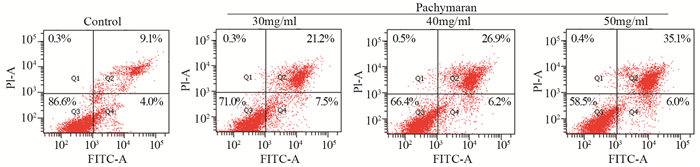
|
| P < 0.01, Pachymaran groups vs. Control group 图 6 茯苓多糖对HeLa细胞凋亡率的影响 Figure 6 Effect of pachymaran on apoptosis of HeLa cells |
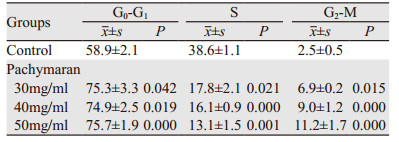
茯苓多糖作用24 h后,与对照组相比,S期细胞比例明显减少,而G2/M期细胞比例增加(P < 0.01),提示茯苓多糖能使HeLa细胞周期阻滞在G2/M期,从而抑制细胞增殖,并呈剂量相关性,见图 7、表 2。
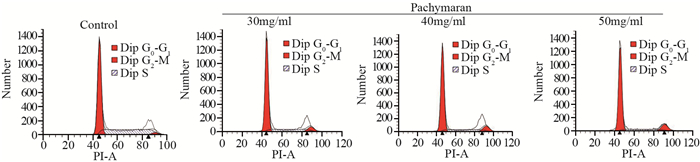
|
| P < 0.05, Pachymaran groups vs. Control group 图 7 茯苓多糖对HeLa细胞周期的影响 Figure 7 Cell cycle of HeLa cells after pachymaran treatment |
|
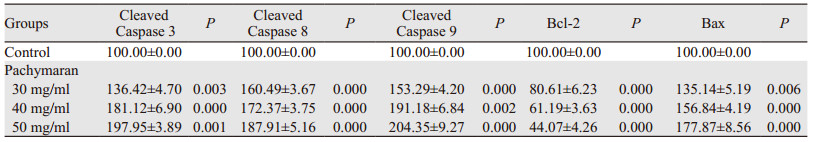
作用24 h后,与对照组相比,低、中、高浓度的茯苓多糖都能使Cleaved Caspase 3、Cleaved Caspase 8、Cleaved Caspase 9和Bax的表达明显增加,Bcl-2的表达明显减少,且呈剂量相关性,差异有统计学意义(P < 0.01),见图 8、表 3。
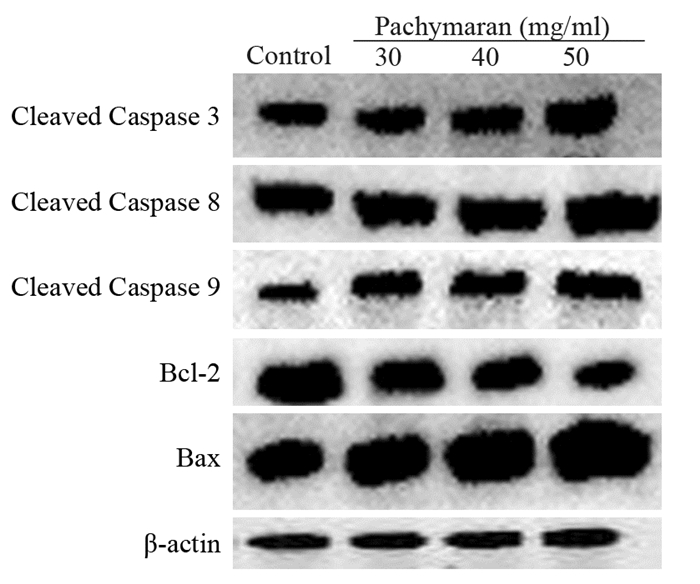
|
| 图 8 茯苓多糖对凋亡相关蛋白表达的影响 Figure 8 Effect of pachymaran on expression of apoptosis-related proteins |
|
作用24 h后,与对照组(100.00±0.00)相比,低、中、高浓度的茯苓多糖都能使MMP-9(30 mg/ml:(92.43±6.01)、P=0.000, 40 mg/ml:(78.26±4.33)、P=0.000和50 mg/ml:(61.92±2.57)、P=0.001)和VEGFA(30 mg/ml:(87.59±5.43)、P=0.000, 40 mg/ml:(80.72±4.29)、P=0.000和50 mg/ml:(64.18±2.58)、P=0.000)的表达逐渐减少,且呈剂量相关性,见图 9。
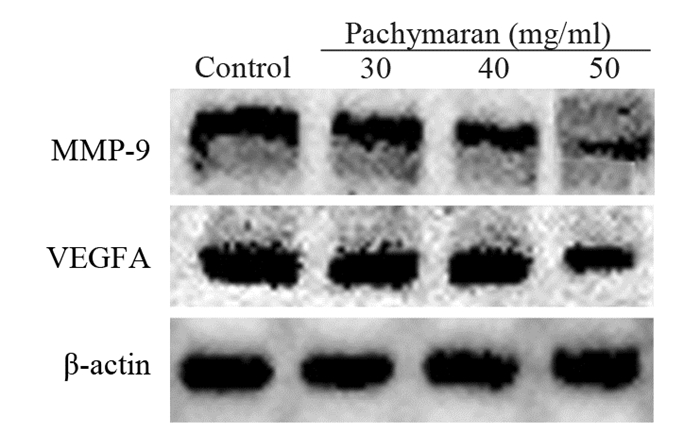
|
| 图 9 茯苓多糖对迁移相关蛋白表达的影响 Figure 9 Effect of pachymaran on expression of migration-related proteins |
作用24 h后,与对照组相比,低、中、高浓度的茯苓多糖都能明显抑制p-ERK1/2的表达,且呈剂量相关性,但与ERK1/2的表达无明显趋势。提示茯苓多糖可能是通过抑制ERK通路的活化下调p-ERK1/2的表达而发挥其促凋亡的作用,见图 10、表 4。
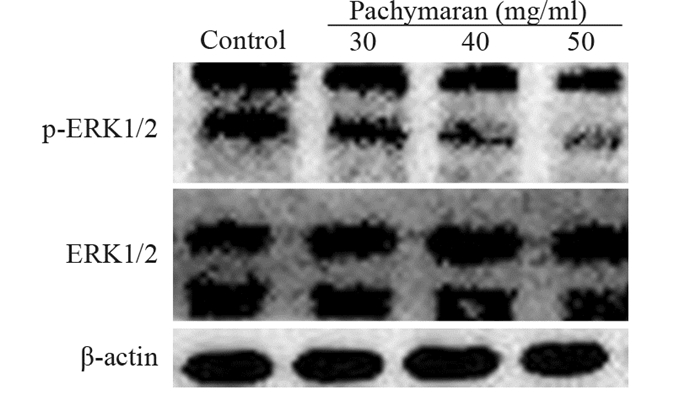
|
| 图 10 茯苓多糖对ERK通路相关蛋白表达的影响 Figure 10 Effect of pachymaran on expression of ERK pathway-related proteins |
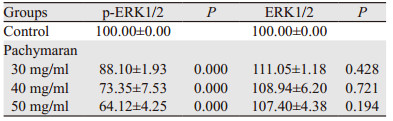
|
宫颈癌是最常见的女性生殖系统恶性肿瘤之一,近年来其发病率呈逐年上升且有年轻化趋势[7]。传统治疗方法主要包括手术和放化疗,但临床研究证实不同患者对放化疗敏感度的差异较大,且患者往往不能耐受为改善疗效而增加放化疗药物剂量所带来的不良反应[8]。天然药物因其具有多靶点、来源丰富等特点,故寻找一种高效的天然药物治疗宫颈癌已成为妇科肿瘤的研究方向之一。
本实验旨在探究茯苓多糖诱导人宫颈癌HeLa细胞增殖、迁移、促凋亡的作用及其机制,寻找发挥抗肿瘤作用的关键位点,为制定宫颈癌治疗方案提供新思路。通过对细胞形态学的观察、MTT、平板克隆实验等证实了茯苓多糖能有效降低HeLa细胞增殖率、诱导细胞出现核固缩、核破碎、染色质凝集等凋亡形态学改变。流式检测细胞凋亡率、细胞周期以及Weatern blot检测凋亡相关蛋白的表达同样也证实了茯苓多糖的促凋亡作用。
我们研究认为茯苓多糖的促凋亡机制之一可能是通过线粒体途径实现的。Weatern blot结果表明,随着药物浓度增加,抗凋亡蛋白Bcl-2的表达减少,促凋亡蛋白Bax的表达增加,Bcl-2/Bax比值下降,从而引起线粒体膜的通透性发生改变,使得细胞色素C的含量增加,与半胱氨酸蛋白酶结合形成的凋亡体的含量也增加,最终Caspase家族被激活,凋亡通路上游蛋白Caspase 8、Caspase 9合成增加,随后激活Caspase 3形成Cleaved Caspase 3,则凋亡不可逆转[9-10]。
肿瘤细胞的浸润性和转移性是其不可被治愈的重要原因,也是影响预后的主要原因。有研究表明,基质类金属蛋白酶家族调控着肿瘤细胞的迁移、侵袭和转移[11]。基质金属蛋白酶-9(MMP-9)可通过降解细胞外基质、破坏基底膜屏障、促进新生血管形成等途径促使细胞生长和迁移,为肿瘤细胞的迁移、浸润和转移提供有利条件。研究显示,MMP-9在肿瘤相关巨噬细胞刺激的宫颈癌细胞中高表达[12]。血管内皮因子A(VEGFA)可直接促进肿瘤细胞的新生血管形成,参与肿瘤细胞的增殖和营养物质的运输。本实验结果显示,随着药物浓度增加,MMP-9和VEGFA表达减少,且呈剂量相关性。提示茯苓多糖具有抑制HeLa迁移的能力。
ERK信号通路是丝裂原活化蛋白激酶(MAPKs)的主要成员之一。细胞外调节蛋白激酶(ERK)包括ERK1和ERK2,是将信号从表面受体转导至细胞核的关键,正常定位于胞质,激活后转位至胞核,磷酸化激活的ERK1/2由胞质转位到核内,进而介导多种转录调节因子活化,参与细胞的存活、细胞增殖与分化、细胞凋亡和细胞的癌变等多种生物学反应[13]。本实验结果显示,随着药物浓度增加,p-ERK1/2的表达明显减少,且呈剂量相关性。但ERK1/2的表达无明显变化,说明茯苓多糖能明显下调ERK1/2磷酸化水平,从而阻断ERK信号通路。
综上所述,茯苓多糖具有抑制HeLa细胞增殖、促凋亡作用。其机制可能与通过下调p-ERK1/2表达,抑制ERK信号通路磷酸化有关。另外,线粒体途径也是茯苓多糖实现细胞凋亡的重要方式之一。除此之外,茯苓多糖对于抑制HeLa细胞迁移也有明显的作用,具体机制有待于进一步研究。
作者贡献
唐恩红:实验基础操作、数据整理分析及论文撰写
蔡旺:提供实验思路、设计实验路线、指导论文撰写
| [1] | 曹颖. 茯苓多糖药理作用的研究[J]. 中国现代药物应用, 2013, 7(13): 217–218. [ Cao Y. Study on pharmacological action of poria cocos polysaccharide[J]. Zhongguo Xian Dai Yao Wu Ying Yong, 2013, 7(13): 217–218. DOI:10.3969/j.issn.1673-9523.2013.13.183 ] |
| [2] | 彭志清, 唱晓飞. 茯苓多糖治疗宫颈癌的临床疗效[J]. 世界临床医学, 2016, 10(17): 127–128. [ Peng ZQ, Chang XF. Clinical efficacy of poria cocos polysaccharide in the treatment of cervical cancer[J]. Shi Jie Lin Chuang Yi Xue, 2016, 10(17): 127–128. ] |
| [3] | 侯玮婷, 罗佳波. 复方茯苓多糖口服液抗肿瘤作用和免疫调节功能的初步研究[J]. 中药药理与临床, 2017, 33(2): 78–81. [ Hou WT, Luo JB. The study of the compound poria polysaccharide oral liquid on the antitumor activity and immune regulation function[J]. Zhong Yao Yao Li Yu Lin Chuang, 2017, 33(2): 78–81. ] |
| [4] | 郭晨旭, 钱军. 茯苓对胃癌细胞株SGC-7901的侧群细胞增殖的影响[J]. 中国临床药理学与治疗学, 2014, 19(11): 1222–1226. [ Guo CX, Qian J. Effects of poria cocos on the proliferation of side group cells of gastric cancer cell line SGC-7901[J]. Zhongguo Lin Chuang Yao Li Xue Yu Zhi Liao Xue, 2014, 19(11): 1222–1226. ] |
| [5] | 许云霞, 刘晓健, 屈飞. 中药多糖与过继免疫联合治疗卵巢癌[J]. 中国实验方剂学杂志, 2011, 17(21): 231–234. [ Xu YX, Liu XJ, Qu F. Treatment of ovarian cancer with chinese herbal polysaccharide combined with adoptive immunization[J]. Zhongguo Shi Yan Fang Ji Xue Za Zhi, 2011, 17(21): 231–234. DOI:10.3969/j.issn.1005-9903.2011.21.064 ] |
| [6] | 张密霞, 李怡文, 张德生, 等. 茯苓多糖对Lewis肺癌小鼠自发肺转移的抑制作用及其机制研究[J]. 现代药物与临床, 2013, 28(6): 842–846. [ Zhang MX, Li YW, Zhang DS, et al. Inhibition of pachymaran on spontaneous lung metastasis in Lewis lung cancer of mice and its mechanism[J]. Xian Dai Yao Wu Yu Lin Chuang, 2013, 28(6): 842–846. ] |
| [7] | Li X, Zheng R, Li X, et al. Trends of incidence rate and age at diagnosis for cervical cancer in China, from 2000 to 2014[J]. Chin J Cancer Res, 2017, 29(6): 477–486. DOI:10.21147/j.issn.1000-9604.2017.06.02 |
| [8] | Symonds RP, Davidson SE, Chan S, et al. SCOTCERV: a phase Ⅱ trial of docetaxel and gemcitabine as second line chemotherapy in cervical cancer[J]. Gynecol Oncol, 2011, 123(1): 105–109. DOI:10.1016/j.ygyno.2011.06.001 |
| [9] | Bartkova J, Lukas J, Müller H, et al. Cyclin D1 protein expression and function in human breast cancer[J]. Int J Cancer, 2010, 57(3): 353–361. |
| [10] | Goilav B, Satlin LM, Wilson PD. Pathways of apoptosis in human autosomal recessive and autosomal dominant polycystic kidney diseases[J]. Pediatr NePhrol, 2008, 23(9): 1473–1482. DOI:10.1007/s00467-008-0851-9 |
| [11] | Farin A, Suzuki SO, Weiker M, et al. TransPlanted glioma cells migrate and Proliferate on host brain vasculature: a dynamic analysis[J]. Glia, 2006, 53(8): 799–808. DOI:10.1002/glia.20334 |
| [12] | 陈晓静, 王薇, 周琛斐, 等. 肿瘤相关巨噬细胞促进宫颈癌侵袭转移的机制研究[J]. 肿瘤防治研究, 2019, 46(3): 212–217. [ Chen XJ, Wang W, Zhou CF, et al. Tumor associated macrophages promote invasion and metastasis of cervical cancer[J]. Zhong Liu Fang Zhi Yan Jiu, 2019, 46(3): 212–217. DOI:10.3971/j.issn.1000-8578.2019.18.0769 ] |
| [13] | Sui X, Kong N, Ye L, et al. P38 and JNK MAPK pathways control the balance of apoptosis and autophagy in response to chemotherapeutic agents[J]. Cancer Lett, 2014, 344(2): 174–179. DOI:10.1016/j.canlet.2013.11.019 |
 2019, Vol. 46
2019, Vol. 46


