文章信息
- 那可丁对人结肠癌5-Fu耐药细胞株HT-29/5-Fu、LoVo/5-Fu及SW480/5-Fu耐药性的影响
- Effect of Noscapine on Drug Resistance of 5-Fluorouracil-resistant Human Colon Cancer Cell Lines HT-29/5-Fu, LoVo/5-Fu and SW480/5-Fu
- 肿瘤防治研究, 2019, 46(8): 696-701
- Cancer Research on Prevention and Treatment, 2019, 46(8): 696-701
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.18.1927
- 收稿日期: 2018-12-11
- 修回日期: 2019-04-03
结肠癌是一种常见的消化道恶性肿瘤,发病率呈迅速增长的趋势[1-2]。化疗是治疗结肠癌的主要方法之一,5-氟尿嘧啶(5-Fluorouracil, 5-Fu)是用于治疗结肠癌的常用化疗药物,但经常会由于对药物产生耐药性,导致治疗失败[3],严重制约了5-Fu的临床疗效,因此,解决该问题将有利于提高结肠癌的治疗成功率。
那可丁(Noscapine, Nos)是一种从罂粟中分离出来的邻苯二甲酸异喹啉生物碱,通常被作为止咳药[4]。研究发现[5-6]Nos还是潜在的抗癌药物,可以影响肿瘤细胞的生物学行为。本研究利用反复大剂量结合药物浓度梯度法构建对5-Fu耐药的人结肠癌细胞株HT-29/5-Fu、LoVo/5-Fu及SW480/5-Fu,用半数抑制浓度(50% Inhibitory concentration, IC50)的Nos干预结肠癌细胞株HT-29、LoVo及SW480和耐药细胞株HT-29/5-Fu、LoVo/5-Fu及SW480/5-Fu后,观察检测细胞生物学特性的变化。
1 材料与方法 1.1 材料试剂:RPMI 1640培养液、胎牛血清购自美国Gibco公司;PBS、0.25%胰蛋白酶、PBST、MTT、DEPC处理水、兔抗p-glycoprotein、兔抗多药耐药相关蛋白(Multidrug resistance-associated protein, MRP)、兔抗肺耐药相关蛋白(Lung resistance-related protein, LRP)、兔抗P38、兔抗p-P38、兔抗GAPDH及HRP标记的山羊抗兔IgG均购自武汉华联科生物技术有限公司;AnnexinV-FITC/PI凋亡检测试剂盒和CycleTESTTM Plus DNA Reagent Kit购自美国BD公司;TRIzol购自美国Ambion公司;反转录试剂盒购自大连TaKaRa公司;SYBR Green PCR试剂盒购自美国KAPA Biosystems公司;PVDF转移膜、化学发光试剂购自美国Millipore公司;十二烷基硫酸钠(SDS)、TEMED购自美国Sigma公司。仪器耗材:CO2恒温培养箱购自美国Thermo公司;显微镜购自日本Nikon公司;流式细胞仪购自美国Beckman公司;荧光定量PCR仪购自美国Bio-Rad公司;全自动化学发光分析仪购自上海天能。
1.2 方法 1.2.1 构建耐药株取对数生长期的人结肠癌细胞株HT-29、LoVo和SW480,培养于含10 µg/ml 5-Fu的RPMI 1640完全培养液中,置于37℃、5%CO2饱和湿度培养箱中诱导细胞24 h。当细胞出现凋亡时,用PBS清洗3次后于不含5-Fu的RPMI 1640完全培养液中培养。待细胞恢复正常生长后,加入浓度递增的5-Fu反复处理细胞,每次增加10 µg/ml,直到细胞被最大5-Fu浓度(40 µg/ml)处理后存活至少4天则视为耐药株构建成功[7]。此次研究构建耐药株共历时10月,获得HT-29/5-Fu、LoVo/5-Fu和SW480/5-Fu耐药细胞株。撤药两周后,对耐药株进行处理观察生物学特征变化。
1.2.2 MTT法检测药敏性将对数生长期的人结肠癌细胞株HT-29、LoVo及SW480和耐药株HT-29/5-Fu、LoVo/5-Fu及SW480/5-Fu制成单细胞悬液,接种于96孔板中,每孔约5×103个细胞。在恒温培养箱中培养,待细胞贴壁后,分别加入浓度为0、10、50、100和150 μmol/L的Nos,继续培养24 h。取出3复孔,各孔加入10 µl MTT溶液(5 mg/ml),继续培养4 h。吸去上清液,加入150 µl二甲基亚砜溶解结晶物。最后使用酶标仪测定各组细胞在490 nm处的吸光度(OD)值,并计算Nos对各组细胞的IC50。
1.2.3 实验分组实验分为12组:HT-29 CON、LoVo CON和SW480 CON(亲本株对照组);HT-29 IC50、LoVo IC50和SW480 IC50(使用半数抑制浓度的Nos处理各亲本株);HT-29/5-Fu CON、LoVo/5-Fu CON和SW480/5-Fu CON(耐药株对照组);HT-29/5-Fu IC50、LoVo/5-Fu IC50和SW480/5-Fu IC50(使用半数抑制浓度的Nos处理各耐药株)。
1.2.4 观察细胞形态变化显微镜下观察人结肠癌亲本株、耐药株,以及经过半数抑制浓度Nos干预的亲本株和耐药株的细胞形态。
1.2.5 流式检测细胞周期将经过分组处理24 h后的各组细胞用0.25%的胰蛋白酶消化后,制成单细胞悬液,并离心收集。加入700 µl无水乙醇于-20℃冰箱中固定过夜。预冷PBS清洗后,加入100 µl RNase A(1 mg/ml)和400 µl碘化丙啶(50 µg/ml)溶液,避光染核10 min后,于流式细胞仪中检测DNA含量。
1.2.6 流式细胞仪检测细胞凋亡将分组处理24 h后的对数生长期细胞取出,用0.25%胰蛋白酶消化制成单细胞悬液,然后离心收集细胞。预冷PBS清洗后,将细胞重悬于200 µl结合缓冲液中,加入10 µl Annexin V-FITC,避光孵育10 min,再加入10 µl碘化丙啶避光孵育30 min后进行上机检测。
1.2.7 RT-qPCR检测P38及耐药相关蛋白的mRNA表达经过分组处理后,取生长状况良好的细胞经PBS清洗,用TRIzol提取细胞总RNA。根据TaKaRa反转录试剂盒操作说明书将RNA反转录为cDNA,再进行RT-qPCR,引物序列见表 1。反应条件为:95℃变性5 s,56℃退火10 s,72℃延伸25 s,共39个循环。
取生长状况良好的细胞,PBS清洗细胞后加入裂解液,然后提取细胞总蛋白。经过SDS-PAGE电泳、转膜、封闭后,加入稀释后的一抗(兔抗p-glycoprotein:1:1000;兔抗MRP:1:1000;兔抗LRP:1:10000;兔抗P38:1:1000;兔抗p-P38:1:1000;兔抗GAPDH:1:5000),室温孵育1 h。PBST清洗后加入二抗(HRP标记的山羊抗兔IgG),室温孵育1 h,再用PBS清洗,加入化学发光试剂进行化学发光显影,读取条带灰度值。
1.3 统计学方法用SPSS22.0统计软件对上述实验数据进行统计学分析,两组之间比较采用t检验,多组间比较采用单因素方差分析。P < 0.05为差异具有统计学意义。
2 结果 2.1 测定药物IC50随着Nos药物浓度的升高,各组细胞的抑制率也随着升高,且亲本株HT-29 CON、LoVo CON和SW480 CON抑制率高于对应耐药株,见图 1。各组细胞的IC50分别为:HT-29 CON细胞115.434 μmol/L,HT-29/5-Fu细胞657.474 μmol/L,LoVo CON细胞163.878 μmol/L,LoVo/5-Fu细胞526.336 μmol/L,SW480 CON细胞143.231 μmol/L,SW480/5-Fu细胞1064.294 μmol/L。各组细胞的IC50将作为后续实验Nos干预细胞的浓度。
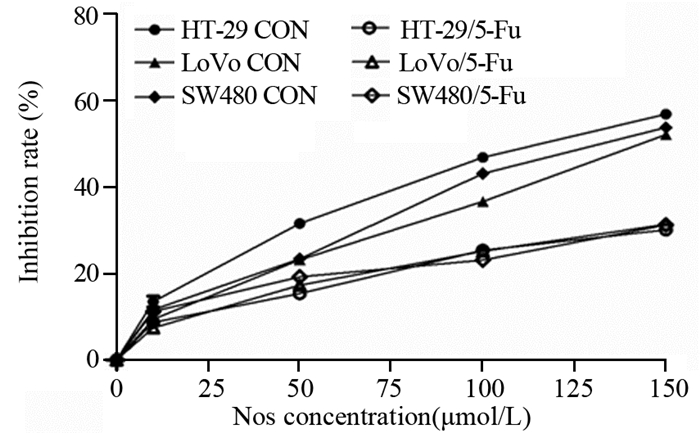
|
| 图 1 那可丁对结肠癌细胞增殖的抑制作用 Figure 1 Inhibitory effect of noscapine on proliferation of colon cancer cells |
观察各组细胞形态,亲本细胞对照组形态大多呈梭形,耐药细胞对照组开始变圆钝,Nos干预后的耐药细胞出现皱缩,细胞体积变小,形态呈圆形,并出现漂浮态,分布松散,见图 2。

|
| 图 2 那可丁对耐药细胞形态的影响(×200) Figure 2 Effect of noscapine on morphology of drug-resistant cells (×200) |
未经Nos干预的5-Fu耐药株G0/G1期细胞数量多于亲本细胞。Nos对亲本细胞和耐药细胞的干预,也使细胞周期发生了明显的变化。经Nos处理后的亲本细胞和耐药细胞分别与其相应的对照组(CON)比较,IC50 Nos处理后,处于G0/G1期的细胞数量显著增多(P=0.000),S期数量减少,说明Nos干预使细胞发生G0/G1期阻滞现象。且5-Fu耐药株和Nos的叠加作用,使得Nos干预后的耐药株G0/G1期细胞比例明显比亲本株多(P=0.024, P=0.003, P=0.000),见图 3。对细胞凋亡比例进行统计,发现与CON相比,Nos处理细胞24 h后,细胞凋亡率明显升高,见图 4。

|
| **: P < 0.01, compared with HT-29 CON, LoVo CON and SW480 CON; #: P < 0.05, ##: P < 0.01, compared with HT-29 IC50, LoVo IC50 and SW480 IC50 图 3 流式细胞仪检测那可丁对耐药细胞周期(A)及对细胞G0/G1期比例(B)的影响 Figure 3 Effect of noscapine on cell cycle(A) and G0/G1 phase proportion(B) of drug resistant cells detected by flow cytometry |
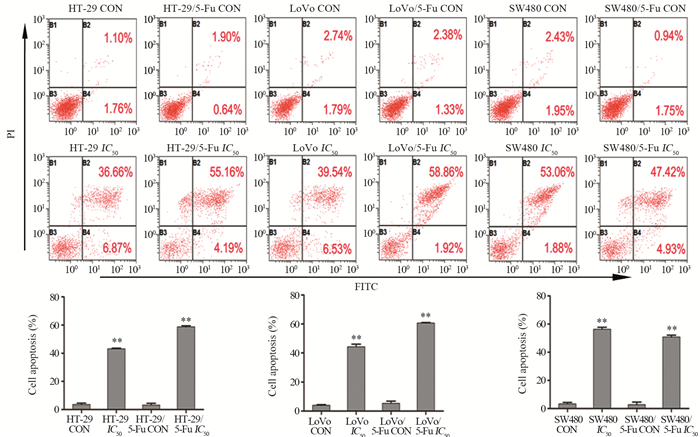
|
| **: P < 0.01, compared with HT-29 CON, LoVo CON and SW480 CON 图 4 流式细胞仪检测那可丁对耐药细胞凋亡的影响 Figure 4 Effect of noscapine on apoptosis of drug-resistant cells detected by flow cytometry |
比较各组细胞的P38 mRNA及p-P38的蛋白相对表达水平发现,Nos干预过的细胞显著低于对照组(P < 0.01)(实验具体数据请扫描OSID码见附件)。IC50 Nos处理的耐药细胞株HT-29/5-Fu、LoVo/5-Fu和SW480/5-Fu P38及和p-P38的蛋白相对表达水平明显高于IC50 Nos处理的亲本细胞株HT-29、LoVo及SW480(P < 0.05或P < 0.01),见图 5。说明耐药细胞株的P38表达高于亲本株,而Nos干预后会抑制P38的表达。
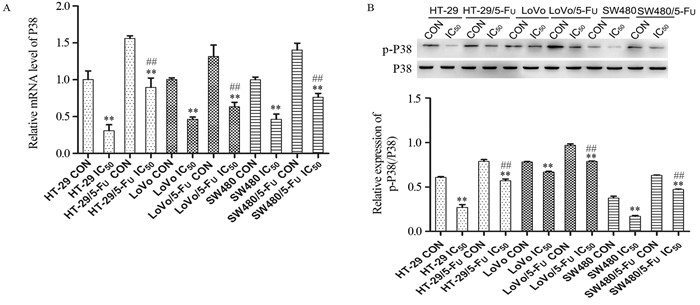
|
| *: P < 0.05, **: P < 0.01, compared with HT-29 CON, LoVo CON and SW480 CON; #: P < 0.05, ##: P < 0.01, compared with HT-29 IC50, LoVo IC50 and SW480 IC50 图 5 那可丁对P38 mRNA(A)和p-P38蛋白(B)表达的影响 Figure 5 Effect of noscapine on P38 mRNA(A) and p-P38 protein(B) expression |
与对照组细胞比较,IC50 Nos干预后细胞的MRP、LRP及p-glycoprotein的mRNA和蛋白相对表达量显著降低(P < 0.01)(实验具体数据请扫描OSID码见附件)。与IC50 Nos干预后HT-29、LoVo及SW480相比,IC50 Nos干预后的HT-29/5-Fu、LoVo/5-Fu和SW480/5-Fu的MRP、LRP及p-glycoprotein的mRNA和蛋白相对表达量明显升高(P < 0.05或P < 0.01),见图 6。结果提示耐药株的耐药相关蛋白表达升高,而Nos干预后对耐药相关蛋白表达具有一定抑制作用。
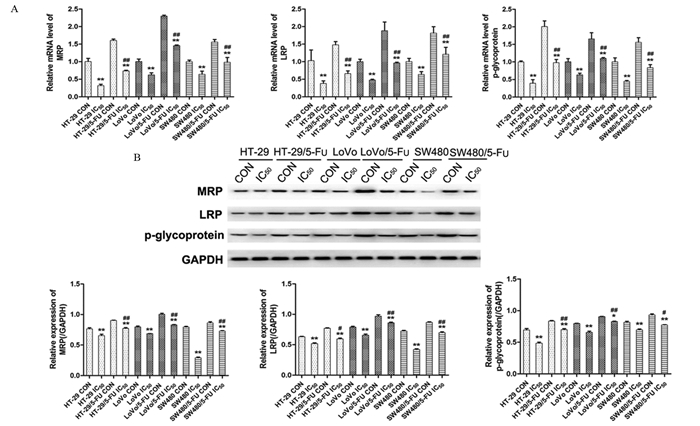
|
| *: P < 0.05, **: P < 0.01, compared with HT-29 CON, LoVo CON and SW480 CON; #: P < 0.05, ##: P < 0.01, compared with HT-29 IC50, LoVo IC50 and SW480 IC50 图 6 那可丁对MRP、LRP及p-glycoprotein mRNA(A)及蛋白表达(B)的影响 Figure 6 Effect of noscapine on mRNA(A) and protein(B) expressions of MRP, LRP and p-glycoprotein |
丝裂原活化蛋白激酶(Mitogen-activated protein kinases, MAPKs)在细胞表面到细胞核的信号转导过程中起重要作用,参与了细胞增殖、存活及凋亡的调节[8]。MAPK由P38 MAPK、c-jun氨基末端激酶(c-jun amino-terminal kinase, JNK)和细胞外调节激酶(Extracellular regulated kinase, ERK)组成,并通过磷酸化的形式发挥作用[9-10]。在多种肿瘤患者中都发现P38 MAPK水平的失调,Koul等[11]对P38在肿瘤生物学中的影响进行分析,提示P38在细胞存活、分化/无分化、周期点控制、凋亡及耐药等方面都起着关键的作用,发挥什么样的作用取决于激活P38的类型和肿瘤细胞的特异性。研究发现,P38参与了结肠癌细胞对5-Fu的耐药,P38 MAPK信号通路抑制后可提高结肠癌细胞HT-29对药物的敏感度,降低相关耐药性因子的表达水平[12]。本研究发现Nos显著抑制了耐药细胞株HT-29/5-Fu、LoVo/5-Fu和SW480/5-Fu的P38的表达和磷酸化。
MRP可以将能量依赖性的药物排出体外,从而降低药物在细胞内的浓度,使化疗药物对肿瘤细胞的作用降低[13]。相关文献[14]结果显示多药耐药蛋白1(MDR1/P-glycoprotein/ABCB1)及多药耐药相关蛋白1(MRP1/ABCC1)表达上调会抑制药物对癌细胞的毒性作用。LRP的耐药机制可能是阻止药物进入细胞核,并能将药物排出细胞外,而且LRP与MRP同在一条染色体上,且位置相近,两者的表达可能具有相关性[15]。于是,本研究进一步检测MRP、LRP及p-glycoprotein在各组细胞中的表达水平,发现这些与耐药相关的蛋白在Nos处理组显著受到抑制,说明IC50Nos降低了HT-29/5-Fu、LoVo/5-Fu和SW480/5-Fu的耐药性。前期研究[4]发现Nos使人结肠癌细胞株HT-29、LoVo和SW480阻滞于G0/G1期,本研究周期检测结果与文献一致,Nos干预后,耐药细胞株HT-29/5-Fu、LoVo/5-Fu和SW480/5-Fu发生G0/G1期阻滞现象,耐药细胞的DNA复制周期比亲本细胞长,且细胞凋亡率增加,说明Nos不仅作用于人结肠癌亲本细胞,对耐5-Fu的结肠癌细胞也具有一定的毒性作用。
综上所述,Nos促进了5-Fu耐药的结肠癌细胞发生G0/G1期阻滞及凋亡,降低了耐药细胞的耐药性,可能是通过抑制P38的表达和磷酸化而发挥作用,具体的作用机制还需进一步深入研究。
作者贡献
韩峥、刘蒙、田霞:提出研究思路、设计研究方案,并参与实验过程、论文撰写
黄晓东、朱庆曦:分析实验数据,论文审核
谭洁、刘维洁、陈巍:收集资料,实施研究过程,论文修改
邹晓丽、蔡一珊、黄莎莎:参与课题设计及论文撰写
| [1] | Miller KD, Siegel RL, Lin CC, et al. Cancer treatment and survivorship statistics, 2016[J]. CA Cancer J Clin, 2016, 66(4): 271–289. DOI:10.3322/caac.21349 |
| [2] | Zhu J, Tan Z, Hollis-Hansen K, et al. Epidemiological Trends in Colorectal Cancer in China: An Ecological Study[J]. Dig Dis Sci, 2017, 62(1): 235–243. DOI:10.1007/s10620-016-4362-4 |
| [3] | Gao Y, Xiao X, Zhang C, et al. Melatonin synergizes the chemotherapeutic effect of 5-fluorouracil in colon cancer by suppressing PI3K/AKT and NF-κB/iNOS signaling pathways[J]. J Pineal Res, 2016, 62(2). |
| [4] | 韩峥, 黄晓东, 刘蒙, 等. 人结肠癌那可丁耐药细胞株HT-29/Nos、LoVo/Nos、SW480/Nos的构建及其生物特性探究[J]. 广东医学, 2018, 39(2): 176–180. [ Han Z, Huang XD, Liu M, et al. The establishment and biological characteristics of noscapine resistant human colon carcinoma cell line HT-29/Nos, LoVo/Nos and SW480/Nos[J]. Guangdong Yi Xue, 2018, 39(2): 176–180. ] |
| [5] | Li Y, Smolke CD. Engineering biosynthesis of the anticancer alkaloid noscapine in yeast[J]. Nat Commun, 2016, 7: 12137. DOI:10.1038/ncomms12137 |
| [6] | Tomar V, Kukreti S, Prakash S, et al. Noscapine and its Analogs as Chemotherapeutic Agent: Current updates[J]. Curr Top Med Chem, 2017, 17(2): 174–188. |
| [7] | Zhang C, Ma Q, Shi Y, et al. A novel 5-fluorouracil-resistant human esophageal squamous cell carcinoma cell line Eca-109/5-FU with significant drug resistance-related characteristics[J]. Oncol Rep, 2017, 37(5): 2942–2954. DOI:10.3892/or.2017.5539 |
| [8] | Chen NN, Wei F, Wang L, et al. Tumor Necrosis Factor Alpha Induces Neural Stem Cell Apoptosis Through Activating p38 MAPK Pathway[J]. Neurochem Res, 2016, 41(11): 3052–3062. DOI:10.1007/s11064-016-2024-8 |
| [9] | Turjanski AG, Hummer G, Gutkind JS. How mitogen-activated protein kinases recognize and phosphorylate their targets: A QM/MM study[J]. J Am Chem Soc, 2009, 131(17): 6141–6148. DOI:10.1021/ja8071995 |
| [10] | Cordero-Herrera I, Martín MA, Bravo L, et al. Epicatechin gallate induces cell death via p53 activation and stimulation of p38 and JNK in human colon cancer SW480 cells[J]. Nutr Cancer, 2013, 65(5): 718–728. DOI:10.1080/01635581.2013.795981 |
| [11] | Koul HK, Pal M, Koul S. Role of p38 MAP Kinase Signal Transduction in Solid Tumors[J]. Genes Cancer, 2013, 4(9-10): 342–359. DOI:10.1177/1947601913507951 |
| [12] | Shi X, Wu S, Yang Y, et al. AQP5 silencing suppresses p38 MAPK signaling and improves drug resistance in colon cancer cells[J]. Tumor Biol, 2014, 35(7): 7035–7045. DOI:10.1007/s13277-014-1956-3 |
| [13] | Yang AK, Zhou ZW, Wei MQ, et al. Modulators of multidrug resistance associated proteins in the management of anticancer and antimicrobial drug resistance and the treatment of inflammatory diseases[J]. Curr Top Med Chem, 2010, 10(17): 1732–1756. DOI:10.2174/156802610792928040 |
| [14] | Cai B, Miao Y, Liu Y, et al. Nuclear multidrug-resistance related protein 1 contributes to multidrug-resistance of mucoepidermoid carcinoma mainly via regulating multidrug-resistance protein 1: a human mucoepidermoid carcinoma cells model and spearman's rank correlation analysis[J]. PLoS One, 2013, 8(8): e69611. DOI:10.1371/journal.pone.0069611 |
| [15] | 孔易, 胡占峰, 徐树雷, 等. 多药耐药相关蛋白和肺耐药蛋白在大肠癌中的表达及其意义[J]. 广东医学, 2014, 35(2): 255–257. [ Kong Y, Hu ZF, Xu SL, et al. The significance of the expression of multidrug resistance related proteins and lung resistance proteins in colorectal cancer[J]. Guangdong Yi Xue, 2014, 35(2): 255–257. ] |
 2019, Vol. 46
2019, Vol. 46



