文章信息
- FBXL20对胃癌细胞增殖、迁移及侵袭的影响
- Effect of FBXL20 on Proliferation, Migration and Invasion of Gastric Cancer Cells
- 肿瘤防治研究, 2019, 46(7): 600-604
- Cancer Research on Prevention and Treatment, 2019, 46(7): 600-604
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.18.1923
- 收稿日期: 2018-12-11
- 修回日期: 2019-04-08
2. 637000 南充,南充市中心医院疼痛科
2. Department of Pain Management, Nanchong Central Hospital, Nanchong 637000, China
胃癌是一种常见的消化道恶性肿瘤,其病死率居所有恶性肿瘤的第二位[1-2]。其治疗方法以手术为主并辅以化疗的综合治疗为主。然而流行病学调查结果显示其临床治疗效果并不尽如人意[3-4]。研究表明,胃癌的发生发展基于多种基因的异常表达及调控,因此明确参与其中的靶基因的作用可能有助于提高胃癌的诊治水平[5-6]。FBXL20是新近发现的泛素连接酶Skp1-Cullin1-F-box复合体中的重要组成成分,它通过泛素化降解靶分子从而调控细胞的生物学过程[7-9]。研究发现,FBXL20参与了结肠癌、食管癌、肝癌、非小细胞肺癌、喉癌等多种肿瘤细胞的增殖、迁移及侵袭过程[10-14],然而其在胃癌中的表达、作用和机制仍未见报道。因此,本研究旨在检测FBXL20在胃癌细胞中的表达,并探讨其对胃癌细胞增殖、迁移和侵袭的影响及作用机制,以期为胃癌的诊断及治疗提供一个新的基因靶点。
1 材料与方法 1.1 材料 1.1.1 细胞来源人胃黏膜上皮细胞系GES-1及3株人胃癌细胞系(BGC-823、AGS、MKN-45)均购自中国科学院上海细胞库。
1.1.2 主要试剂RPMI1640培养基、胎牛血清、青霉素、链霉素均购自美国Gibco公司。兔抗人FBXL20多克隆抗体、兔抗人GSK-3β单克隆抗体、兔抗人p-GSK-3βTyr216多克隆抗体、兔抗人β-catenin单克隆抗体、兔抗人Cyclin D1多克隆抗体、小鼠抗人E-cadherin单克隆抗体、小鼠抗人GAPDH单克隆抗体、兔抗人β-actin单克隆抗体均购自美国Abcam公司。小鼠抗人p-β-catenin单克隆抗体购自美国Santa Cruz Biotechnology公司。HRP标记的抗兔IgG二抗、HRP标记的抗小鼠IgG二抗、CCK-8试剂盒、MG-132试剂均购自上海碧云天公司。Transwell小室购自美国Corning公司,Matrigel基质胶购自美国BD公司。
1.2 方法 1.2.1 细胞培养所有细胞均采用RPMI1640培养基,配以10%胎牛血清、100 u/ml青霉素及100 μg/ml链霉素,于37℃、5%CO2培养箱中培养。取处于对数生长期的细胞进行实验。
1.2.2 慢病毒感染含有FBXL20干扰载体的慢病毒及对照病毒购自上海吉凯基因技术有限公司。所用慢病毒载体采用pGLVH1/GFP+Puro载体,其中FBXL20-RNAi序列为:5’-ACTCCTGTTACGGATATTT-3’,Control-RNAi序列为:5’-TTCTCCGAACGTGTCACGT-3’。将2 ml处于对数生长期的AGS细胞(5×105个)加入到6孔板,培养24 h后弃上清液,加入含有FBXL20干扰载体的慢病毒载体或对照病毒,并加入1 μl的Polybrene以增强感染效果。感染48 h后更换含有5 μg/ml嘌呤霉素的培养基,筛选7天后得到稳定抑制FBXL20表达的AGS细胞株(FBXL20-RNAi)及实验对照株(Control-RNAi)。
1.2.3 Western blot实验收集处于对数生长期的细胞,去除培养基后用预冷的PBS充分清洗3次。随后加入RIPA裂解液对细胞冰上裂解30 min,离心取上清液,用BCA蛋白定量试剂盒测定上清中蛋白浓度。采用10%的SDS-PAGE凝胶进行电泳分离,每个泳道蛋白上样量为40 μg,将分离后的蛋白电转至PVDF膜。用含5%脱脂奶粉的TBST封闭1 h,然后分别加入FBXL20(1:1000稀释)、GSK-3β(1:1 000稀释)、p-GSK-3βTyr216(1:1 500稀释)、β-catenin(1:1 000稀释)、p-β-catenin(1:1 000稀释)、Cyclin D1(1:1 000稀释)、E-cadherin(1:1 500稀释)及β-actin(1:1 500稀释)抗体4℃摇床孵育过夜。TBST洗膜3次后,加入对应二抗室温摇床孵育1 h,再用TBST洗膜3次, 每次10 min。ECL发光试剂盒发光显影,定影后进行分析。
1.2.4 CCK-8法检测细胞增殖将FBXL20-RNAi组及Control-RNAi组的AGS细胞接种于96孔板(5×103个/孔),每组设置5个复孔。在种板后0、12、24、36、48 h分别在每孔中加入10 μl CCK-8试剂,培养箱中继续培养2 h后用酶联免疫检测仪测定细胞在450 nm处的吸光度值,绘制细胞生长曲线。
1.2.5 Transwell实验检测细胞迁移及侵袭将FBXL20-RNAi组及Control-RNAi组的AGS细胞消化离心后,用不含血清的RPMI 1640培养基将细胞密度调整至5×104/ml。将无Matrigel基质胶和有Matrigel基质胶的8 μm孔径大小的Transwell小室放入24孔板中,分别用于完成迁移和侵袭实验。两组实验都在小室上室加入200 μl细胞悬液,下室加入700 μl含10%胎牛血清的RPMI 1640培养基,在37℃、5%CO2条件下培养24 h后,用棉签轻轻擦掉上室细胞,4%多聚甲醛固定细胞5 min,0.1%结晶紫染色5 min,PBS清洗2次。显微镜下随机选取5个视野,统计小室细胞的迁移数,取平均值进行统计分析。
1.3 统计学方法采用SPSS20.0统计软件进行数据分析,用GraphPad Prism 6.0作图。正态分布的计量资料均以均数±标准差(x±s)表示。采用t检验和单因素方差分析进行组间比较。P < 0.05为差异有统计学意义。
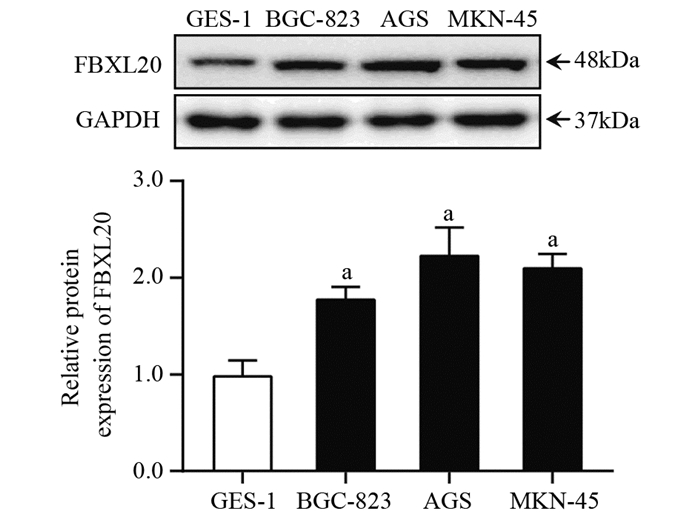
2 结果 2.1 FBXL20在胃黏膜上皮细胞系及胃癌细胞系中的表达与人胃黏膜上皮细胞GES-1(1.00±0.19)比较,胃癌细胞系BGC-823(1.79±0.15)、AGS(2.27±0.31)及MKN-45(2.11±0.17)中FBXL20的蛋白表达显著升高,差异有统计学意义(P=0.031),见图 1。
|
| a: P < 0.05, compared with GES-1 cells 图 1 人胃黏膜上皮细胞及3种胃癌细胞系中FBXL20的相对表达水平 Figure 1 Expression levels of FBXL20 in normal gastric epithelial cell line and three gastric cancer cell lines |
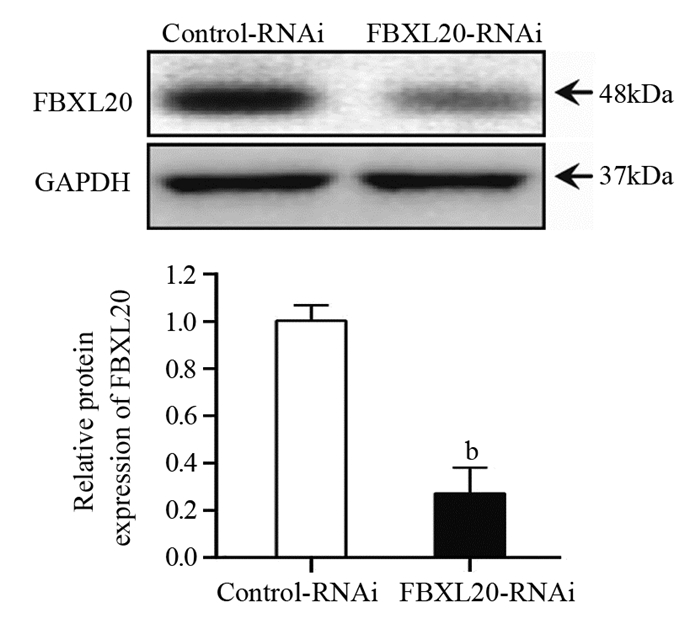
通过慢病毒感染将包含抑制FBXL20的shRNA序列导入AGS细胞中,构建了稳定抑制FBXL20表达的细胞系。与对照组(Control-RNAi)(1.00±0.07)比较,抑制组(FBXL20-RNAi)中FBXL20的蛋白表达(0.28±0.11)显著降低,差异有统计学意义(P=0.0053),见图 2。
|
| b: P < 0.01, compared with Control-RNAi group 图 2 FBXL20-RNAi慢病毒感染后AGS细胞中FBXL20表达水平 Figure 2 Expression level of FBXL20 in AGS cells after FBXL20-RNAi lentivirus infection |
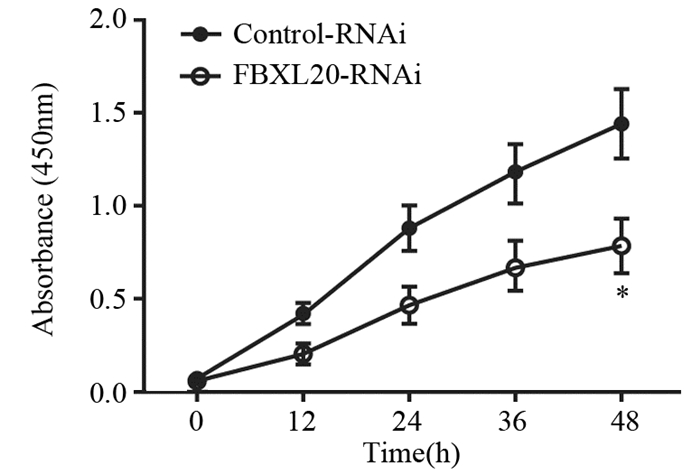
CCK-8实验检测抑制FBXL20后AGS细胞在0、12、24、36、48 h的增殖情况。与Control-RNAi组(1.43±0.19)比较,FBXL20-RNAi组(0.78±0.16)的细胞增殖能力在48 h显著降低,差异有统计学意义(P=0.031),见图 3。
|
| *: P < 0.05, compared with Control-RNAi group 图 3 CCK-8实验检测抑制FBXL20对AGS细胞增殖的影响 Figure 3 Effect of FBXL20 knockdown on proliferation of AGS cells detected by CCK-8 assay |
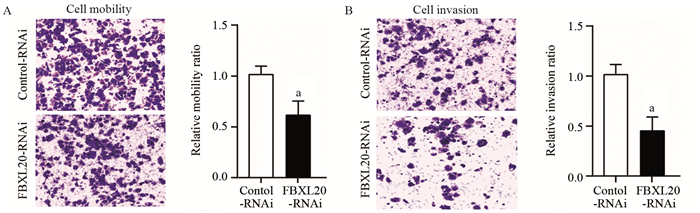
迁移实验结果表明,与Control-RNAi组(1.00±0.08)比较,FBXL20-RNAi组(0.63±0.15)相对迁移率明显降低,差异有统计学意义(P=0.048),见图 4A。侵袭实验结果表明,与Control-RNAi组(1.00±0.11)比较,FBXL20-RNAi组(0.43±0.16)相对侵袭率明显降低,差异有统计学意义(P=0.019),见图 4B。
|
| a: P < 0.05, compared with Control-RNAi group 图 4 Transwell检测抑制FBXL20对AGS细胞迁移(A)和侵袭(B)的影响 Figure 4 Effect of FBXL20 knockdown on migration(A) and invasion(B) of AGS cells detected by transwell assay |
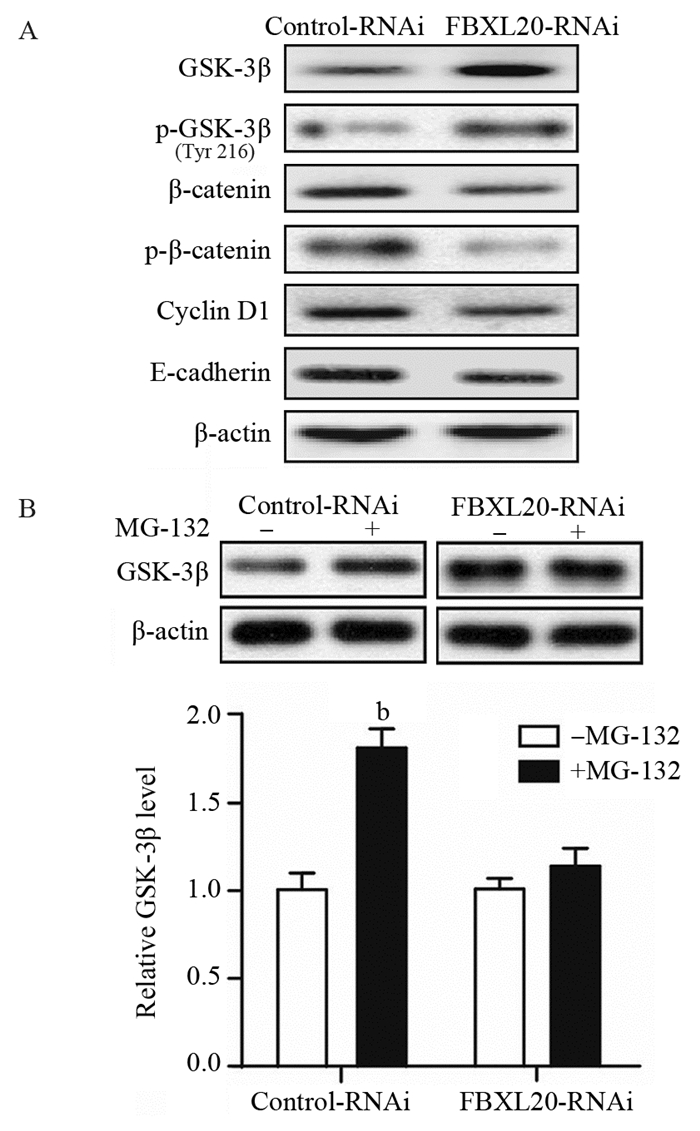
Western blot结果显示,抑制FBXL20后AGS细胞中GSK-3β、p-GSK-3βTyr216的表达增加,而β-catenin、p-β-catenin的表达降低,且受β-catenin调控的与增殖、迁移及侵袭功能密切相关的靶蛋白Cyclin D1及E-cadherin的表达也降低,见图 5A。为了进一步验证FBXL20主要是通过促进GSK-3β泛素化而调控Wnt通路,我们采用26S蛋白酶体抑制剂MG-132进行干预,发现MG-132能反转FBXL20-RNAi对GSK-3β的调控作用,见图 5B,提示FBXL20可能泛素化调控Wnt通路。
|
| b: P < 0.01, compared with-MG-132 in Control-RNAi group 图 5 Western blot检测抑制FBXL20对Wnt通路中相关蛋白表达的影响 Figure 5 Effect of FBXL20 knockdown on expression of Wnt pathway-related proteins detected by Western blot |
胃癌虽然通过手术、化疗等可以提高患者生存率,但胃癌的复发和转移仍然是导致治疗失败的主要原因[15-16]。因此,深入研究引起复发转移的相关因素并进行针对性干预是目前胃癌研究的热点与难点。
FBXL20属于泛素连接酶F-box家族成员,该家族成员可构成Skp1-Cullin1-F-box复合体,通过降解特定底物从而调节细胞增殖、周期进程、凋亡等过程。研究表明,FBXL20在结肠癌组织中高表达,并且通过介导E-cadherin的泛素化降解从而促进肿瘤细胞的侵袭[17]。抑制FBXL20能调控食管癌中β-catenin信号通路,从而诱导G0/G1期细胞周期阻滞、抑制食管癌细胞迁移和侵袭[18]。然而在非小细胞肺癌研究中发现,抑制FBXL20能促进周期蛋白CDK1、Cyclin A、Cyclin B1的表达,加快G2/M期的进程,从而促进肺癌细胞的增殖[13]。这说明FBXL20可能兼有抑癌基因和癌基因的双重作用,其作用的发挥可能具有肿瘤类别依赖性,但是FBXL20在胃癌中的表达及作用还不清楚。本研究通过对3种胃癌细胞系中FBXL20蛋白水平的检测,发现其表达明显升高。随后抑制AGS细胞中FBXL20的表达,发现细胞增殖、迁移及侵袭能力明显降低。这些结果与以往食管癌、结肠癌的研究结果相一致,表明FBXL20在胃癌中可能发挥癌基因的作用。
有研究证实,Wnt信号通路在胃癌的发生发展过程中起重要作用[19-21]。GSK-3β作为Wnt信号通路中的关键蛋白,通过磷酸化β-catenin的氨基端,开启β-catenin的泛素降解[22-23]。β-catenin的降解使其不能有效与转录因子Tcf/Let结合,从而导致增殖、迁移等相关靶基因的转录水平降低[24-25]。多种F-box家族成员可以通过泛素化降解Wnt通路中的关键蛋白从而调控肿瘤细胞的活动进程。如FBXO17能够识别和介导GSK-3β的多泛素化降解,从而抑制肺癌细胞中炎性反应因子的产生[26]。FBXW1能够促进β-catenin的泛素化降解,从而参与结直肠肿瘤的进程[27]。有研究表明,FBXL20可能参与了食管癌中Wnt通路的调控[18],因此我们预测FBXL20可能通过调控Wnt信号通路从而参与了胃癌细胞增殖、迁移及侵袭的进程。通过MG-132抑制实验,我们发现抑制FBXL20能降低GSK-3β的泛素化降解,从而增加AGS细胞中GSK-3β、p-GSK-3βTyr216表达水平。而p-GSK-3βTyr216表达的增加加速了β-catenin的磷酸化,导致与增殖及迁移相关的靶蛋白Cyclin D1及E-cadherin表达水平的下降[27-28]。由此推测,FBXL20可能通过泛素化调控GSK-3β表达水平,从而有效控制胃癌细胞中Wnt通路的信号转导,进一步调节胃癌细胞的增殖、迁移及侵袭。
综上所述,本研究表明FBXL20在胃癌细胞中高表达,且其通过促进Wnt通路中GSK-3β的泛素化降解从而促进胃癌细胞的增殖、迁移和侵袭。本研究结果为胃癌的诊断和靶向治疗提供了一个新的思路。
作者贡献
韩娟: 实验设计和实施、数据分析及论文写作
刘江: 实验实施及数据分析
黄梅: 实验设计、论文修改及审核
| [1] | Van Cutsem E, Sagaert X, Topal B, et al. Gastric cancer[J]. Lancet, 2016, 388(10060): 2654–2664. DOI:10.1016/S0140-6736(16)30354-3 |
| [2] | Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115–132. DOI:10.3322/caac.21338 |
| [3] | Orditura M, Galizia G, Sforza V, et al. Treatment of gastric cancer[J]. World J Gastroenterol, 2014, 20(7): 1635–1649. DOI:10.3748/wjg.v20.i7.1635 |
| [4] | Karimi P, Islami F, Anandasabapathy S, et al. Gastric cancer: descriptive epidemiology, risk factors, screening, and prevention[J]. Cancer Epidemiol Biomarkers Prev, 2014, 23(5): 700–713. DOI:10.1158/1055-9965.EPI-13-1057 |
| [5] | McLean MH, El-Omar EM. Genetics of gastric cancer[J]. Nat Rev Gastroenterol Hepatol, 2014, 11(11): 664–674. DOI:10.1038/nrgastro.2014.143 |
| [6] | Shimizu D, Kanda M, Kodera Y. Review of recent molecular landscape knowledge of gastric cancer[J]. Histol Histopathol, 2018, 33(1): 11–26. |
| [7] | Xiao J, Zhang T, Xu D, et al. FBXL20-mediated Vps34 ubiquitination as a p53 controlled checkpoint in regulating autophagy and receptor degradation[J]. Genes Dev, 2015, 29(2): 184–196. DOI:10.1101/gad.252528.114 |
| [8] | Yao I, Takagi H, Ageta H, et al. SCRAPPER-dependent ubiquitination of active zone protein RIM1 regulates synaptic vesicle release[J]. Cell, 2007, 130(5): 943–957. DOI:10.1016/j.cell.2007.06.052 |
| [9] | Setou M, Yao I. SCRAPPER: an F-box protein that regulates synaptic vesicle release via RIM1 degradation[J]. Tanpakushitsu Kakusan Koso, 2008, 53(1): 36–43. |
| [10] | Zhu J, Li K, Dong L, et al. Role of FBXL20 in human colorectal adenocarcinoma[J]. Oncol Rep, 2012, 28(6): 2290–2298. DOI:10.3892/or.2012.2065 |
| [11] | 何枫, 陈小龙, 吴庆琛. 敲减FBXL20基因降低食管癌KYSE150细胞增殖[J]. 基因组学与应用生物学, 2018, 37(4): 1661–1666. [ He F, Chen XL, Wu QC. Knock-down FBXL20 gene reduce the proliferation of KYSE150 cells[J]. Ji Yin Zu Xue Yu Ying Yong Sheng Wu Xue, 2018, 37(4): 1661–1666. ] |
| [12] | 牛静静, 苗风济. siRNA靶向沉默fbxl20基因对肝癌SMMC-7721细胞生物学行为的影响[J]. 川北医学院学报, 2012, 27(3): 221–225. [ Niu JJ, Miao FJ. Effect of siRNA targeted to fbxl20 on biological behavior of liver cancer SMMC-7721 cells[J]. Chuan Bei Yi Xue Yuan Xue Bao, 2012, 27(3): 221–225. DOI:10.3969/j.issn.1005-3697.2012.03.007 ] |
| [13] | 张博瀚, 吴庆琛. FBXL20对人非小细胞肺癌A549细胞生长的影响[J]. 第三军医大学学报, 2018, 40(9): 795–800. [ Zhang BH, Wu QC. Effects of FBXL20 on proliferation in human non-small cell lung cancer A549 cells[J]. Di San Jun Yi Da Xue Xue Bao, 2018, 40(9): 795–800. ] |
| [14] | 温蓓, 何刚. FBXL20在喉癌组织中的表达[J]. 四川医学, 2017, 38(1): 79–82. [ Wen B, He G. Expression of FBXL20 in laryngocarcinoma[J]. Sichuan Yi Xue, 2017, 38(1): 79–82. ] |
| [15] | Riquelme I, Saavedra K, Espinoza JA, et al. Molecular classification of gastric cancer: Towards a pathway-driven targeted therapy[J]. Oncotarget, 2015, 6(28): 24750–24779. |
| [16] | 黄倩倩, 陈晶. 胃癌复发、转移的研究进展[J]. 胃肠病学和肝病学杂志, 2017, 26(3): 241–244. [ Huang QQ, Chen J. Progress of recurrence and metastasis of gastric cancer[J]. Wei Chang Bing Xue He Gan Bing Xue Za Zhi, 2017, 26(3): 241–244. ] |
| [17] | Zhu J, Deng S, Duan J, et al. FBXL20 acts as an invasion inducer and mediates E-cadherin in colorectal adenocarcinoma[J]. Oncol Lett, 2014, 7(6): 2185–2191. DOI:10.3892/ol.2014.2031 |
| [18] | He F, Zhang C, Chen X, et al. FBXL20 promotes cell proliferation and metastasis through activating Wnt/β-catenin signaling pathway in esophageal cancer[J]. Int J Clin Exp Med, 2017, 10(5): 7796–7805. |
| [19] | Chiurillo MA. Role of the Wnt/β-catenin pathway in gastric cancer: An in-depth literature review[J]. World J Exp Med, 2015, 5(2): 84–102. DOI:10.5493/wjem.v5.i2.84 |
| [20] | Mao J, Fan S, Ma W, et al. Roles of Wnt/β-catenin signaling in the gastric cancer stem cells proliferation and salinomycin treatment[J]. Cell Death Dis, 2014, 5: e1039. DOI:10.1038/cddis.2013.515 |
| [21] | 李康, 旦增. Wnt/β-catenin信号与胃癌防治研究进展[J]. 南方医科大学学报, 2014, 34(12): 1852–1856. [ Li K, Dan Z. Research progress of Wnt/β-catenin signaling pathway in prevention and treatment of gastric cancer[J]. Nan Fang Yi Ke Da Xue Xue Bao, 2014, 34(12): 1852–1856. DOI:10.3969/j.issn.1673-4254.2014.12.32 ] |
| [22] | McCubrey JA, Steelman LS, Bertrand FE, et al. GSK-3 as potential target for therapeutic intervention in cancer[J]. Oncotarget, 2014, 5(10): 2881–2911. |
| [23] | Mukherjee A, Dhar N, Stathos M, et al. Understanding how Wnt influences destruction complex activity and β-catenin dynamics[J]. iScience, 2018, 6: 13–21. DOI:10.1016/j.isci.2018.07.007 |
| [24] | Sprowl S, Waterman ML. Past visits present: TCF/LEFs partner with ATFs for β-catenin-independent activity[J]. PLoS Genet, 2013, 9(8): e1003745. DOI:10.1371/journal.pgen.1003745 |
| [25] | Nusse R, Clevers H. Wnt/β-Catenin Signaling, Disease, and Emerging Therapeutic Modalities[J]. Cell, 2017, 169(6): 985–999. DOI:10.1016/j.cell.2017.05.016 |
| [26] | Suber T, Wei J, Jacko AM, et al. SCFFBXO17 E3 ligase modulates inflammation by regulating proteasomal degradation of glycogen synthase kinase-3β in lung epithelia[J]. J Biol Chem, 2017, 292(18): 7452–7461. DOI:10.1074/jbc.M116.771667 |
| [27] | Kitagawa M, Hatakeyama S, Shirane M, et al. An F-box protein, FWD1, mediates ubiquitin-dependent proteolysis of β-catenin[J]. EMBO J, 1999, 18(9): 2401–2410. DOI:10.1093/emboj/18.9.2401 |
| [28] | Liu X, Chu KM. E-cadherin and gastric cancer: cause, consequence, and applications[J]. Biomed Res Int, 2014, 2014: 637308. |
 2019, Vol. 46
2019, Vol. 46


