文章信息
- 前列腺癌移植瘤近红外荧光成像最佳成像时间的实验
- Best Imaging Time of Near-infrared Fluorescence Imaging for Prostate Cancer Xenografts
- 肿瘤防治研究, 2019, 46(6): 499-503
- Cancer Research on Prevention and Treatment, 2019, 46(6): 499-503
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.18.1900
- 收稿日期: 2018-12-10
- 修回日期: 2019-03-26
2. 030000 太原,山西医科大学附属大医院妇产科;
3. 030000 太原,山西医科大学第一医院泌尿外科
2. Department of Gynaecology and Obstetric, Shanxi Dayi Hospital Affiliated to Shanxi Medical University, Taiyuan 030000, China;
3. Department of Urology, First Hospital of Shanxi Medical University, Taiyuan 030000, China
前列腺癌(prostate cancer, PCa)是中老年男性常见的恶性肿瘤,在美国,其发病率位居男性恶性肿瘤的首位。近年来,随着老龄化时代的到来、饮食习惯的改变,我国前列腺癌的发病率和死亡率也呈现逐年上升趋势,其增长速度甚至超过欧美[1]。治疗局限性PCa最有效的外科方式是根治性前列腺切除术(radical prostatectomy, RP),同期进行的盆腔淋巴结清扫术(pelvic lymph node dissection, PLND)是诊断PCa有无淋巴结转移最准确的方法[2]。
吲哚菁绿(indocyanine green, ICG)是一种暗青色的近红外荧光染料,其发射光在组织中的穿透深度达1~5 cm,且受生物组织本底的影响较小,可在近红外区域呈现荧光,目前常用于血管、视网膜、肝脏肿瘤的诊断和治疗[3]。近十余年来逐渐应用于荧光引导的手术操作及临床研究。有研究报道ICG肿瘤局部注射时,染料外溢影响观察效果[4-6]。
2015年Jiang等[7]报道了一种通过静脉注射ICG显影实体肿瘤的新型注入技术,该技术能够使ICG在实体肿瘤中聚集。其他机构的研究证实ICG在神经胶质瘤、肺癌及其前哨淋巴结中也有良好的显影效果[8-10]。
为此,本实验在前期研究的基础上,建立了前列腺癌皮下移植瘤裸鼠模型,通过尾静脉注射ICG,进一步研究静脉注射ICG体外近红外荧光成像前列腺癌移植瘤显像的动态特征,最佳显影时间及成像机制,为临床应用ICG近红外荧光成像、术中引导前列腺癌根治提供明确的理论基础。
1 材料与方法 1.1 实验材料 1.1.1 细胞株和实验动物人前列腺癌细胞系PC3细胞购于上海中国科学院细胞库。SPF级BALB/c-BU雄性裸鼠10只[许可证号:SCXK(苏)2016-0010],3~4周龄,体质量15~18 g,由常州卡文斯实验动物有限公司提供并给予品系来源证明。实验动物饲养于山西医科大学实验动物中心,笼具、垫料、饲料及饮用水均经过严格灭菌处理。
1.1.2 设备近红外荧光显影仪器为多光谱分光融合外科手术引导系统(multispectral separate-merge guided surgery device,MGS),由太原赛恩思科技发展有限公司提供,型号SENA1-001,激发光波长(760±10)nm。
1.1.3 试剂近红外荧光染料选用国产注射用吲哚菁绿,丹东医创药业有限责任公司生产,批准文号为国药准字H20045514,25毫克/支。
1.2 细胞培养及处理PC3细胞株培养在含10%标准胎牛血清(北京赛澳美细胞技术有限公司)的DMEM/F12培养基(武汉博士德公司)中,0.25%胰蛋白酶消化,传代。
1.3 建立裸鼠前列腺癌移植瘤模型对数生长期的PC3细胞株消化,1200 r/min离心5 min,以完全培养基调整细胞数量至1×107个,1200 r/min再次离心5 min,弃上清液。在0℃冰上将PC3细胞重悬浮于200 μl的Matrigel基质胶(美国BD公司)中。用经过预冷的1 ml注射器抽取细胞悬液,接种至裸鼠右前肢腋窝皮下,饲养温度为25℃±1℃。约2周后,移植瘤长至约15 mm×15 mm时进行进一步实验研究[11]。
1.4 肿瘤近红外荧光显影10只荷瘤裸鼠,完全随机编号1~10号,其中1~7号裸鼠使用2%(体积分数)戊巴比妥钠(2 ml/kg)腹腔注射麻醉后固定于动物板上。通过尾静脉将10 mg/kg的ICG注入裸鼠体内,多光谱分光融合外科手术引导系统下进行显影,分别于1 min、30 min、1 h、2 h、4 h、8 h、12 h、18 h、24 h、48 h和72 h在近红外荧光成像仪下观察裸鼠肿瘤及全身显影情况并采集图片,使用ImageJ软件(http://rsb.info.nih.gov/ij/,美国国立卫生研究院)计算肿瘤及背景图像的灰度值,选择合适的感兴趣区域(regions of interest, ROI),计算肿瘤与背景的比率(tumor-to-background ratio, TBR)
通过以上实验步骤获得肿瘤最佳时间,8~10号裸鼠采用相同的实验方式注射10 mg/kg的ICG。于肿瘤最佳显影时间点剖取肿瘤组织、肝脏、胃、小肠、大肠、肾脏及瘤旁脂肪组织行离体近红外荧光成像,计算各脏器及组织的平均灰度值,并比较灰度值大小。
将获得的肿瘤组织用福尔马林固定,制成石蜡病理切片,荧光显微镜下观察肿瘤组织的荧光显影情况。
2 结果1~7号裸鼠经尾静脉注射ICG后,肝脏、甲状腺以及眼睛部位于注射后即刻显影。随着时间的推移,肿瘤部位荧光逐渐增强,瘤周背景荧光相对减弱,12 h起获得良好的TBR,此时肿瘤显影效果最佳,并延续至24 h,48 h肿瘤及背景荧光均明显减弱,72 h肿瘤及瘤周背景荧光完全消失,见图 1~2。
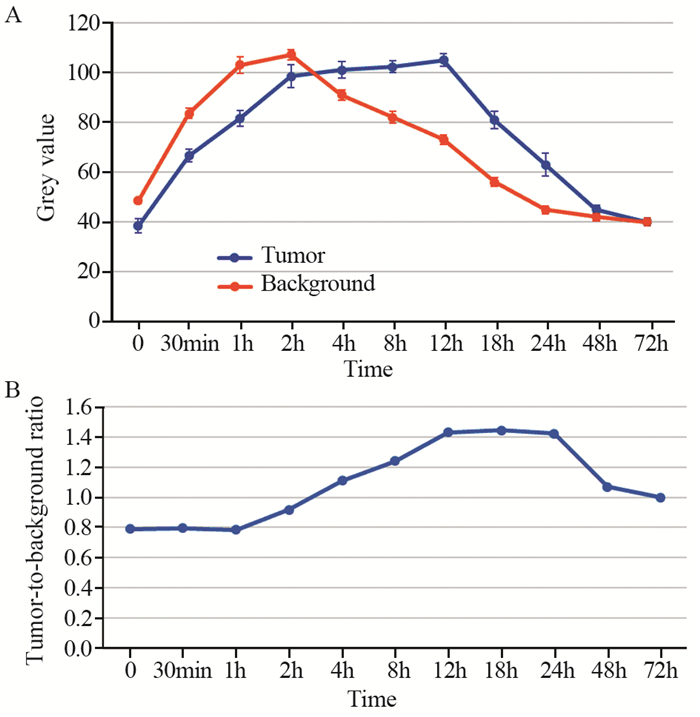
|
| A: Changes of gray values of tumor and background fluorescence over time; B: The TBR was calculated by the ratio of the tumor's fluorescence intensity and the background's fluorescence intensity. 图 1 裸鼠肿瘤及背景荧光强度和肿瘤背景比值随时间推移的变化情况 Figure 1 Changes of tumor and background fluorescence intensity and tumor background ratio over time in nude mice |
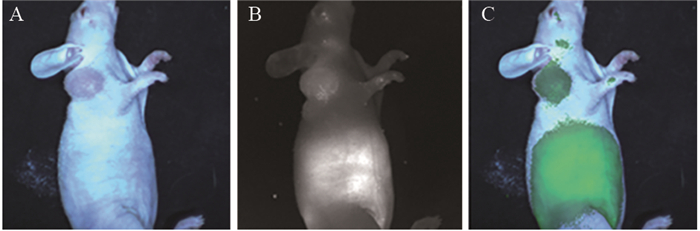
|
| A: Color image; B: Near-infrared fluorescence image; C: Fusion pseudo color image 图 2 注射ICG 24h后裸鼠的全身显影效果图 Figure 2 Whole-body development effect of nude mice after ICG injection for 24 h |
由以上结果知12~24 h为肿瘤最佳显影时间区间,将8~10号裸鼠于24 h进行解剖,观察到肝脏、胃、大肠、小肠、肾脏、肿瘤显影,瘤周脂肪组织未见明显显影,见图 3。计算各组织及器官的平均灰度值:肿瘤为69.93、肝脏为80.16、胃为210.18、小肠为105.89、大肠为166.23、肾脏为57.91、瘤周脂肪为21.43。可知显影效果:胃>大肠>小肠>肝脏>肿瘤>肾脏>瘤周脂肪组织。
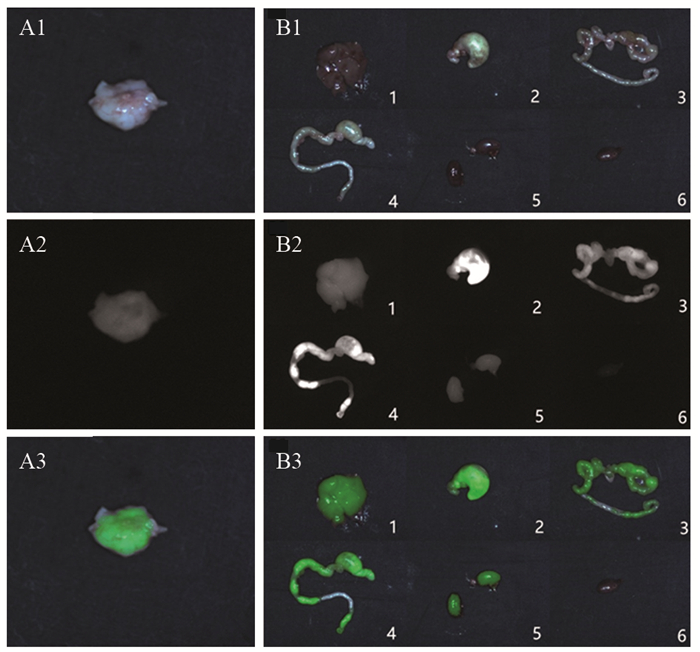
|
| A1, A2, A3: color images, near-infrared fluorescence images, and fused pseudo-color images of tumor tissues, respectively; B1, B2, and B3: color images, near-infrared fluorescence images, and fused pseudo-color images of the abdominal organs, respectively. 1-6: liver, stomach, small intestine, large intestine, kidney, and peritumoral fat tissue, respectively 图 3 注射ICG 24h后裸鼠肿瘤组织、各脏器及周围脂肪组织显影效果 Figure 3 Imaging effect of tumor tissue, organs and surrounding adipose tissue in nude mice after injection of ICG for 24 h |
荧光显微镜观察肿瘤组织的病理切片,可见明显绿色荧光信号,见图 4,为ICG染料本身的颜色,从而说明ICG积聚于肿瘤组织中。
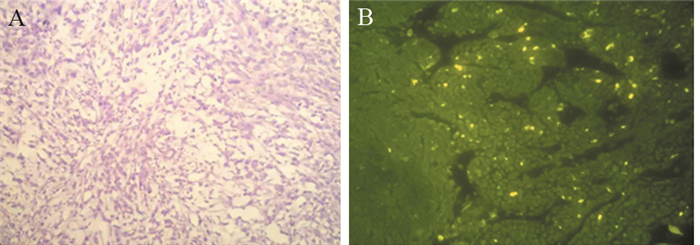
|
| Fluorescence microscopy results confirmed that ICG accumulated in tumor tissues 图 4 PC3移植瘤病理(A)和荧光显微镜下(B)检查结果(×200) Figure 4 Pathological(A) and fluorescence microscopy(B) results of PC3 xenograft tumor (×200) |
RP是治疗局限性前列腺癌最常用的临床手段,完整的切除肿瘤及转移的淋巴结对于PCa患者的预后至关重要[12]。目前关于PCa及盆腔淋巴结转移的检测手段主要有4种方式:常规的断层扫描CT、MRI、肿瘤功能性成像胆碱PET/CT以及前列腺癌特异性成像前列腺特异性膜抗原(The prostate-specific membrane antigen, PSMA)PET/CT。最新的PSMA PET/CT可以将前列腺盆腔淋巴结检出率提升至66%,但仍然有1/3的淋巴结转移被漏诊[13]。并且以上4种影像学检查只能用于术前评估,无法实时指导手术操作,导致前列腺癌手术仍然难以避免阳性切缘及阳性淋巴结的遗漏。
光学分子成像技术的发展为解决以上问题提供了新的思路。光学分子成像是一种采用光学仪器和设备在活体状态下从微观上显示组织、细胞及亚细胞水平的影像技术,具有实时、无创、精准及敏感等特点,可在细胞和分子水平进行肿瘤早期筛查和诊断[14]。其原理为采用荧光报告集团或荧光染料标记的目的细胞,通过敏感的光学成像仪器,检测活体生物体内细胞生物学行为[15]。目前有多种光学成像方式可以在术中使用,例如可见光、紫外线和红外线。与可见光相比,近红外光具有组织穿透深度大、背景吸收散射度低、自发荧光少、信噪比高等优点[16]。ICG作为目前最常用的一种近红外荧光染料,已经被用于诸多肿瘤以及前哨淋巴结(sentinel lymph node, SLN)的检测。2008年Kusano等[17]进行了胃肠道恶性肿瘤ICG荧光成像引导的SLN可行性研究。该研究小组在术中为胃癌及直肠癌患者肿瘤周围注射一定浓度的ICG,其中胃癌患者SLN的检出率为90.9%,直肠癌患者的检出率为88.5%,证明了ICG用于胃肠道SLN显影的可行性。2010年Hojo等[18]对142例乳腺癌患者使用ICG标记SLN,检出结果为99.3%(140/142),平均检出数量约为3.8个,证实ICG在乳腺癌的淋巴结清扫术中发挥着重要的临床意义。2018年查小应等[19]将ICG溶液注射至甲状腺癌患者的肿瘤周围,通过荧光示踪标记法对甲状腺癌患者进行SLN活检,检出率高于70%,且阴性率低于20%,局部注射ICG用于甲状腺癌SLN活检具有重要的临床参考价值。为了探求ICG在前列腺癌手术中的使用效果,多家国外机构试图在前列腺内注射ICG,以期望观察到前列腺肿瘤及转移的淋巴结[4-6]。然而,与胃肠道手术相比,前列腺体积较小且质韧。此外,由于骨盆的限制,RP手术操作空间常常受限。以上原因导致了局部注射ICG的难度较大,容易出现肿瘤周围的ICG染料溢出,使血管及临近组织均产生了不同程度的与转移淋巴结同等的高背景干扰信号。此外,前列腺淋巴系统的引流模式非常复杂,并显示出不同的途径,进一步阻碍了在前列腺内注射ICG的使用[4, 20]。
1986年Matsumura等[21]将伊文思蓝溶液通过尾静脉注射至荷瘤小鼠体内,观察到伊文思蓝-血浆蛋白大分子结合物具有明显的肿瘤蓄积作用以及很强的滞留性,并提出了实体肿瘤组织的高通透性和滞留效应,简称EPR(enhanced permeability and retention effect)效应。EPR效应是指当肿瘤细胞增殖、聚集直径达2~3 mm时,自发诱导形成新生血管系统,其血管形状不规则,血管扩张;内皮细胞排列疏松、细胞间隙大。同时,肿瘤组织中淋巴回流受阻。这些特殊结构可导致分子量大于40 kDa的大分子药物和胶粒载体广泛渗入肿瘤组织,蓄积并长时间滞留[22]。2015年Jiang等[7]将ICG溶液以5 mg/kg的剂量通过尾静脉注射至荷瘤裸鼠体内,证实了肿瘤对ICG染料的EPR效应。
在此基础上,Zeh等[8]通过建立神经胶质瘤的荷瘤裸鼠模型,将5 mg/kg ICG通过尾静脉注射入裸鼠体内,肿瘤于6~48 h产生了一个弱于1 h但是持续时间长并稳定的显影效果。并将这段较长时间的稳定显影平台期称之为ICG的“第二时间窗口”。随后该研究组在10名胶质母细胞瘤患者身上进行了临床试验,患者于术前1天注射5 mg/kg的ICG试剂,手术时通过近红外仪器显示:所有患者均出现了肿瘤的显影,并显现出明显的肿瘤边界。摘除瘤体后行病理检查,证实肿瘤边缘的可靠性,并得出结论:术前24 h静脉注射ICG,能够达到良好的手术显影效果。随后,Xia等[20]将此技术应用于4名前列腺癌患者,对其行机器人辅助下的RP手术,并行扩大的PLND。在近红外仪器的辅助下,术者完整地摘除了前列腺及肿瘤组织,并从3例患者中获得了额外显影的淋巴结,经病理证实为前列腺癌转移淋巴结,从而得出结论:该技术在前列腺癌患者身上具有可行性。
本实验通过建立前列腺癌荷瘤裸鼠皮下移植瘤模型着重研究了随着时间的变化ICG在前列腺肿瘤及全身代谢的情况。通过尾静脉将ICG试剂注射至前列腺癌皮下移植瘤体内,于12~24 h获得了最佳的肿瘤显影效果,此时肿瘤背景比率最高,为1.40~1.47,并且肉眼可见明确的肿瘤及背景组织分界。这与上文提到的ICG“第二时间窗口”技术有时间上的重叠。但是,本项目组通过实验并没有于1 h左右观察到明显的肿瘤显影,由于自体荧光的存在,甚至在3 h之前,瘤周的背景荧光强度会略强于肿瘤本身。我们认为此现象与ICG浓聚于前列腺癌肿瘤部位需要一定时间有关,故静脉注射ICG用于前列腺癌荷瘤裸鼠模型,其显影效果并不完全与Zeh等[8]的“第二时间窗口”理论相吻合。
同时,本研究还发现,由于ICG经肝胆代谢进入肠道等消化器官,故ICG除浓聚于肿瘤部位,直肠部位也有明显的荧光信号。在24 h解剖可知,此时直肠部位的荧光强度甚至会高于肿瘤本身,由于前列腺与直肠在解剖关系上毗邻,这种现象有可能导致前列腺部位的荧光与直肠部位的荧光重叠,影响RP手术中荧光导航的图像效果,但是,由于目前ICG用于临床RP手术的案例较少,具体的影响程度仍有待进一步的研究和临床验证。
另外,ICG静脉注射后12~24 h移植瘤成像效果最佳,与肿瘤组织血管的EPR效应有关。但是,由于单纯注射ICG缺乏靶向特异性,其成像效果还有待进一步提高。目前有研究小组将ICG与前列腺特异性膜抗原(PSMA)抗体J591相结合,制造出具有前列腺癌靶向作用的单克隆抗体-荧光团缀合物:J591-ICG。在前列腺癌皮下移植瘤的裸鼠模型中,获得了良好的肿瘤显影效果[23]。但是该试剂仍然处于动物实验阶段,其药物安全性仍需要进一步的人体试验验证,且复杂的合成机制及昂贵的单克隆抗体价格限制了此试剂的临床应用。尽管如此,ICG与特异性抗体相结合仍然是未来肿瘤显影的发展方向。
综上,ICG经静脉注射后可以被前列腺癌肿瘤吸收,并产生良好的肿瘤荧光显影的效果。肿瘤的最佳显影时间是12~24 h,未来临床应用时,只需要于术前晚给患者注射ICG,即可于手术时获得良好的显影效果,此方式简单实用且安全性佳,将具有广阔的应用前景。
作者贡献
薛亚洲:实验设计及操作、数据统计及分析、论文撰写
李虹君、赵家红、李晓慧:实验设计及操作
张瑞:数据统计及分析、论文撰写
庞建智:实验设计及操作、数据统计及分析
杨晓峰:项目管理和指导
| [1] | 李普, 秦超, 殷长军. 局限性前列腺癌盆腔淋巴结清扫的意义[J]. 临床泌尿外科杂志, 2008, 24(6): 475–8. [ Li P, Qin C, Yin CJ. Significance of pelvic lymph node dissection for localized prostate cancer[J]. Lin Chuang Mi Niao Wai Ke Za Zhi, 2008, 24(6): 475–8. DOI:10.3969/j.issn.1001-1420.2008.06.026 ] |
| [2] | 吴开杰, 贺大林. 前列腺癌根治术中盆腔淋巴结清扫的价值与抉择[J]. 现代泌尿外科杂志, 2015, 20(8): 532–5. [ Wu KJ, He DL. The significance and indications of pelvic lymph node dissection in radical prosta-tec tomy[J]. Xian Dai Mi Niao Wai Ke Za Zhi, 2015, 20(8): 532–5. DOI:10.3969/j.issn.1009-8291.2015.08.002 ] |
| [3] | Porcu EP, Salis A, Gavini E, et al. Indocyanine green delivery systems for tumour detection and treatments[J]. Biotechnol Adv, 2016, 34(5): 768–89. DOI:10.1016/j.biotechadv.2016.04.001 |
| [4] | Manny TB, Patel M, Hemal AK. Fluorescence-enhanced robotic radical prostatectomy using real-time lymphangiography and tissue marking with percutaneous injection of unconjugated indocyanine green: the initial clinical experience in 50 patients[J]. Eur Urol, 2014, 65(6): 1162–8. |
| [5] | van der Poel HG. Intraoperative laparoscopic fluorescence guidance to the sentinel lymph node in prostate cancer patients: clinical proof of concept of an integrated functional imaging approach using a multimodal tracer[J]. Eur Urol, 2011, 60(4): 826–33. DOI:10.1016/j.eururo.2011.03.024 |
| [6] | van Leeuwen FW, Hruby S. Fluorescence guidance during radical prostatectomy[J]. Eur Urol, 2014, 65(6): 1169–70. DOI:10.1016/j.eururo.2013.12.050 |
| [7] | Jiang JX, Keating JJ, Jesus EM, et al. Optimization of the enhanced permeability and retention effect for near-infrared imaging of solid tumors with indocyanine green[J]. Am J Nucl Med Mol Imaging, 2015, 5(4): 390–400. |
| [8] | Zeh R, Sheikh S, Xia L, et al. The second window ICG technique demonstrates a broad plateau period for near infrared fluorescence tumor contrast in glioblastoma[J]. PLoS One, 2017, 12(7): e0182034. DOI:10.1371/journal.pone.0182034 |
| [9] | Lee JY, Thawani JP, Pierce J, et al. Intraoperative Near-Infrared Optical Imaging Can Localize Gadolinium-Enhancing Gliomas During Surgery[J]. Neurosurgery, 2016, 79(6): 856–71. DOI:10.1227/NEU.0000000000001450 |
| [10] | Okusanya OT, Holt D, Heitjan D, et al. Intraoperative Near-Infrared Imaging Can Identify Pulmonary Nodules[J]. Ann Thorac Surg, 2014, 98(4): 1223–30. DOI:10.1016/j.athoracsur.2014.05.026 |
| [11] | 刘杰昊, 杨晓峰, 王玮, 等. 人膀胱癌BIU-87细胞裸鼠皮下移植瘤模型的建立[J]. 国际泌尿系统杂志, 2014, 34(4): 465–8. [ Liu JW, Yang XF, Wang W, et al. Establishment of subcutaneous xenograft model for human bladder carcinoma in nude mice[J]. Guo Ji Mi Niao Xi Tong Za Zhi, 2014, 34(4): 465–8. DOI:10.3760/cma.j.issn.1673-4416.2014.04.001 ] |
| [12] | Joung JY, Cho IC, Lee KH. Role of Pelvic Lymph Node Dissection in Prostate Cancer Treatment[J]. Korean J Urol, 2011, 52(7): 437–45. DOI:10.4111/kju.2011.52.7.437 |
| [13] | 朱耀. 前列腺癌盆腔淋巴结转移的诊治:新手段和新策略[J]. 中国肿瘤外科杂志, 2016, 8(2): 69–70. [ Zhu Y. Diagnosis and treatment of pelvic lymph node metastasis of prostate cancer: new methods and new strategies[J]. Zhongguo Zhong Liu Wai Ke Za Zhi, 2016, 8(2): 69–70. DOI:10.3969/j.issn.1674-4136.2016.02.001 ] |
| [14] | 刘凡, 孙蕾, 于建渤. 光学分子影像学技术在肿瘤中的应用进展[J]. 中国医学影像技术, 2017, 33(9): 1417–20. [ Liu F, Sun L, Yu JB. Application progress of optical molecular imaging technology in cancer[J]. Zhongguo Yi Xue Ying Xiang Ji Shu, 2017, 33(9): 1417–20. ] |
| [15] | 马文娟, 刘佩芳, 胡从依, 等. 肿瘤光学分子成像技术研究进展[J]. 中国医学计算机成像杂志, 2015, 21(6): 605–8. [ Ma WJ, Liu PF, Hu CY, et al. Progress of optical molecular imaging technology of tumor[J]. Zhongguo Yi Xue Ji Suan Ji Cheng Xiang Za Zhi, 2015, 21(6): 605–8. ] |
| [16] | Patel MN, Hemal AK. Molecular Targeted Fluorescence-Guided Intraoperative Imaging of Bladder Cancer Nodal Drainage Using Indocyanine Green During Radical and Partial Cystectomy[J]. Curr Urol Rep, 2016, 17(10): 74. DOI:10.1007/s11934-016-0633-z |
| [17] | Kusano M, Tajima Y, Yamazaki K, et al. Sentinel node mapping guided by indocyanine green fluorescence imaging: a new method for sentinel node navigation surgery in gastrointestinal cancer[J]. Dig Surg, 2008, 25(2): 103–8. DOI:10.1159/000121905 |
| [18] | Hojo T, Nagao T, Kikuyama M, et al. Evaluation of sentinel node biopsy by combined fluorescent and dye method and lymph flow for breast cancer[J]. Breast, 2010, 19(3): 210–3. DOI:10.1016/j.breast.2010.01.014 |
| [19] | 查小应, 费哲为, 高铭, 等. 吲哚菁绿荧光示踪标记法对甲状腺癌前哨淋巴结活检的临床价值[J]. 中国现代普通外科进展, 2018, 21(3): 195–7. [ Zha XY, Fei ZW, Gao M, et al. Clinical value of indocyanine green fluorescent labeling method in sentinel lymph node biopsy on patients with thyroid carcinoma[J]. Zhongguo Xian Dai Pu Tong Wai Ke Jin Zhan, 2018, 21(3): 195–7. ] |
| [20] | Xia L, Zeh R, Mizelle J, et al. Near-infrared Intraoperative Molecular Imaging Can Identify Metastatic Lymph Nodes in Prostate Cancer[J]. Urology, 2017, 106: 133–8. DOI:10.1016/j.urology.2017.04.020 |
| [21] | Matsumura Y, Maeda H. A new concept for macromolecular therapeutics in cancer chemotherapy: mechanism of tumoritropic accumulation of proteins and the antitumor agent smancs[J]. Cancer Res, 1986, 46(12 Pt 1): 6387–92. |
| [22] | 卢琳, 熊素彬. EPR效应在实体瘤靶向治疗中的研究进展[J]. 北方药学, 2014, 11(7): 73. [ Lu L, Xiong SB. Research progress of EPR effect in targeted therapy of solid tumors[J]. Bei Fang Yi Xue, 2014, 11(7): 73. ] |
| [23] | Nakajima T, Mitsunaga M, Bander NH, et al. Targeted, activatable, in vivo fluorescence imaging of prostate-specific membrane antigen (PSMA) positive tumors using the quenched humanized J591 antibody-indocyanine green (ICG) conjugate[J]. Bioconjug Chem, 2011, 22(8): 1700–5. DOI:10.1021/bc2002715 |
 2019, Vol. 46
2019, Vol. 46


