文章信息
- 黄芪甲苷对人结肠癌SW480细胞系增殖和凋亡的影响
- Regulatory Effect of Astragaloside A on Proliferation and Apoptosis of Human Colon Cancer SW480 Cell Line
- 肿瘤防治研究, 2019, 46(8): 702-706
- Cancer Research on Prevention and Treatment, 2019, 46(8): 702-706
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.18.1867
- 收稿日期: 2018-12-05
- 修回日期: 2019-03-15
结肠癌是消化系统中常见的恶性肿瘤,在全球范围内,结直肠癌发病率居第三位,约占所有病例的10%[1]。早期结肠癌可以通过手术治愈,而已经发生肝脏或其他部位转移的结肠癌通常难以治愈,五年生存率低[2]。化疗是治疗中晚期结肠癌的主要手段,顺铂和氟尿嘧啶是常见的药物,但毒副作用较大,严重影响患者的生活质量[3-4]。黄芪为传统中药材,广泛分布于温带地区。黄芪中提取出的天然活性成分有多糖、三萜、黄酮等,其中黄芪甲苷是黄芪的主要天然药物活性成分;目前黄芪甲苷含量常作为黄芪药材优劣的评判标准[5-6]。研究显示,黄芪甲苷有免疫调节、器官保护、降血糖血脂、抗炎、抗病毒等多种药理作用[7-8]。近年来有研究发现黄芪甲苷能增强结肠癌的化疗敏感度和调节细胞自噬[9-10],但黄芪甲苷对结肠癌SW480细胞增殖和凋亡的影响尚未见报道。本文以体外培养的人结肠癌SW480细胞为研究对象,探讨黄芪甲苷对结肠癌细胞增殖和凋亡的影响。
1 材料与方法 1.1 实验材料人结肠癌SW480细胞购自中国科学院上海生命科学研究院细胞研究中心;黄芪甲苷(纯度 > 98%, CAS: 83207-58-3)购自上海融禾医药科技发展有限公司;细胞计数试剂盒购自上海七海复泰生物科技有限公司;DMEM高糖培养基、胎牛血清购自美国Gibco公司;青霉素、链霉素双抗购自美国Hyclone公司;二甲亚砜购自美国Sigma公司;Hoechst33342购自美国Sigma公司;兔抗人增殖细胞核抗原(proliferation cell nuclear antigen, PCNA)(#2586T)、B淋巴细胞瘤-2(B-cell lymphoma-2, bcl-2)(#3498)、Bcl-2相关X蛋白(Bcl-2 associated X, Bax)(#5023)、cleaved caspase-3(#9664S)和cleaved caspase-9(#20750)购自美国Cell Signaling Technology公司,辣根过氧化物酶标记的山羊抗兔二抗购自北京中杉金桥生物技术有限公司。蛋白浓度测定试剂盒和超敏化学发光试剂盒均购自碧云天生物技术研究所。
1.2 实验方法 1.2.1 细胞的培养及处理SW480细胞接种于含10%胎牛血清、1%青霉素和链霉素的DMEM培养基中,在37℃、5%CO2的培养箱中培养。细胞覆盖率达到70%~80%时,0.25%胰酶室温下消化5 min,反复吹打为单细胞悬液后进行传代。细胞生长状态良好,呈对数生长期时用于实验。黄芪甲苷溶于二甲亚砜(dimethyl sulfoxide, DMSO),加入含血清的培养基,经孔径为0.22 μm的滤头过滤后保存。
1.2.2 CCK-8检测细胞增殖取对数生长期的SW480细胞,胰酶消化成单细胞悬液,调整细胞浓度为5×104个/毫升,取100 μl细胞悬液至96孔板,在37℃、5%CO2下培养24 h。弃上清液,更换黄芪甲苷终浓度为0、0.05、0.1、0.2、0.5、1、2、5、10、20、50、100、200、500 μmol/L的培养基,对照组中加相应浓度的DMSO。每组设置3个复孔,继续培养48 h后,换含CCK-8检测液的培养基继续培养2 h后,在酶标仪下检测450 nm处的吸光度。
将细胞分为对照组(SW480细胞)、黄芪甲苷低剂量组(5 μmol/L)、黄芪甲苷中剂量组(10 μmol/L)和黄芪甲苷高剂量组(20 μmol/L)。按照上述操作步骤,以黄芪甲苷终浓度为5、10和20 μmol/L的培养基培养SW480细胞,对照组中加相应浓度的DMSO。酶标仪下检测0、1、2、3、4 d时450 nm处的吸光值,计算细胞增殖倍数。
1.2.3 蛋白质印迹法检测蛋白表达SW480细胞在不同浓度黄芪甲苷的培养基中培养48 h后,胰酶消化细胞,加蛋白裂解缓冲液,冰上超声裂解。12 000 r/min离心20 min,取上清液,测蛋白浓度。取40 μg总蛋白用12%的聚丙烯酰胺凝胶电泳分离,转膜后,取聚偏二氟乙烯膜至5%脱脂牛奶的封闭液中,室温下缓慢摇晃封闭1 h,转移至一抗(1:1 000),4℃振荡孵育过夜,TBST(tris buffered saline tween)缓冲液洗3次,每次10 min;加二抗(1:2 000),室温下振荡器上摇晃孵育1 h,TBST缓冲液洗3次,每次10 min。将A液和B液混合后,覆盖到膜上,凝胶成像系统中进行扫描及灰度值分析。
1.2.4 Hoechst染色检测细胞凋亡取对数生长期的SW480细胞,用0.25%的胰酶消化后,接种于24孔板中,各组培养基中加入相应浓度的黄芪甲苷。于37℃、5% CO2的培养箱中培养24 h后,弃培养基,PBS洗涤3次。将配好的Hoechst染液(10 μg/ml)加到24孔板中,37℃避光处理20 min,立即在荧光显微镜紫外激发光下观察,拍照并记录。
1.2.5 流式细胞术检测细胞凋亡取对数生长期的SW480细胞,消化后接种于相应浓度黄芪甲苷的培养基中,培养48 h后收集细胞,磷酸缓冲液洗2次,加入200 μl的结合缓冲液重悬细胞;加入10 μl Annexin V后混匀,4℃孵育30 min,加入10 μl PI后迅速上机检测。
1.3 统计学方法采用SPSS16.0软件分析处理实验数据。两组间比较使用t检验。P < 0.05为差异有统计学意义。
2 结果 2.1 黄芪甲苷细胞毒性的检测CCK-8实验结果显示,黄芪甲苷浓度低于20 μmol/L时,对SW480细胞的存活率基本没有影响。当黄芪甲苷浓度高于20 μmol/L时,SW480细胞存活率出现明显的降低趋势,见图 1。计算得出IC50浓度为168 μmol/L,综合上面结果,后续实验选择黄芪甲苷的浓度为5、10和20 μmol/L。
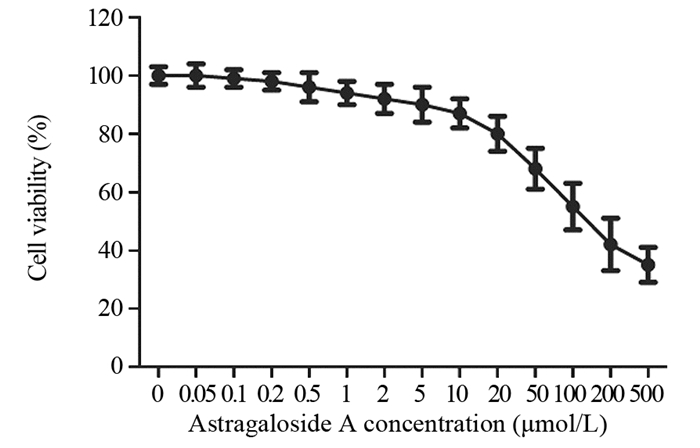
|
| 图 1 CCK-8检测黄芪甲苷对SW480细胞存活率的影响 Figure 1 Effect of astragaloside A on viability of SW480 cells detected by CCK-8 |
黄芪甲苷加药处理SW480细胞后第4天,与对照组相比,黄芪甲苷低、中、高剂量组细胞增殖倍数均显著降低,黄芪甲苷浓度越高,效果越明显(P低=0.0064; P中=0.0051; P高=0.0023),见图 2。
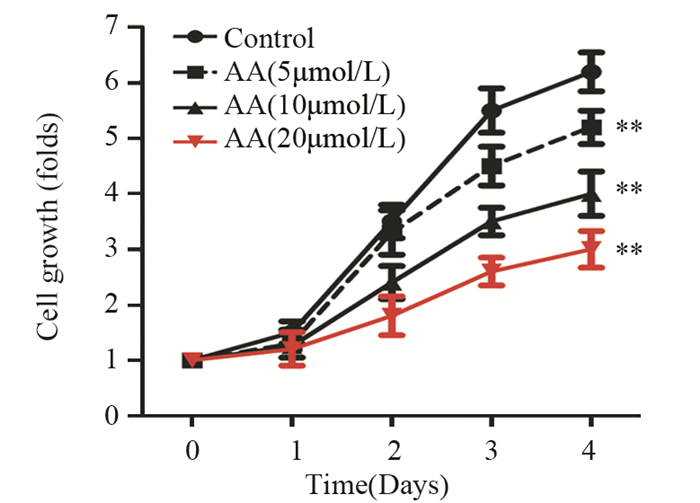
|
| **: P < 0.01, compared with Control group; AA: astragaloside A 图 2 CCK-8检测SW480细胞增殖 Figure 2 Proliferation of SW480 cells detected by CCK-8 |
Western blot进一步检测黄芪甲苷对SW480细胞中增殖标志蛋白的影响。结果显示,与对照组相比,黄芪甲苷低剂量组Ki67的表达差异无统计学意义(P=0.086),PCNA的表达水平显著降低(P=0.0046)。黄芪甲苷中、高剂量组与对照组相比,Ki67(P中=0.0048; P高=0.0021)和PCNA(P中=0.0035; P高=0.0023)的表达水平均显著降低,且随着浓度的增加效果越明显,见图 3。
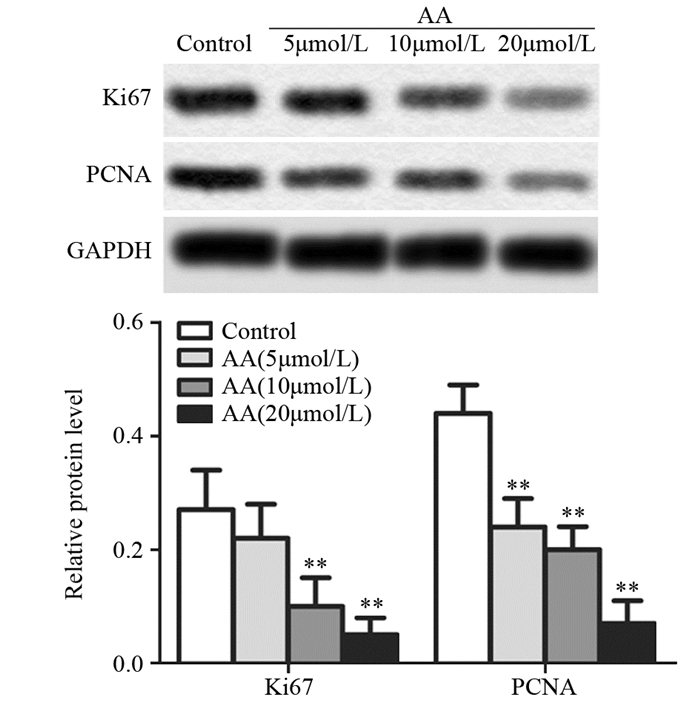
|
| **: P < 0.01, compared with Control group, n=3 图 3 蛋白质印迹检测Ki67和PCNA的表达 Figure 3 Expression levels of Ki67 and PCNA detected by Western blot |
Hoechst染色结果显示,对照组中细胞核呈圆形,且形状基本一致。在黄芪甲苷加药组中,可见细胞核固缩及新月形核,黄芪甲苷高剂量组中甚至出现细胞核破裂,见图 4A。与对照组相比,黄芪甲苷各剂量组凋亡细胞比率均显著升高(P低=0.0082; P中=0.0056; P高=0.0043),且随着黄芪甲苷浓度的增高,效果越明显,见图 4B。
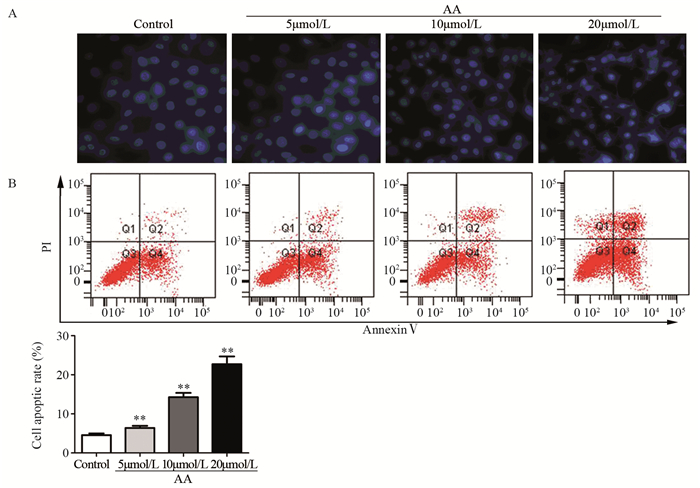
|
| **: P < 0.01, compared with Control group; A: ×400 图 4 Hoechst染色(A)和流式细胞术(B)检测各组SW480细胞凋亡情况 Figure 4 Apoptic rates of SW480 cells in each group detected by Hoechst staining(A) and flow cytometry(B) |
Western blot检测黄芪甲苷对SW480细胞凋亡相关蛋白表达的影响,与对照组相比,黄芪甲苷加药各组细胞中Bcl-2的表达显著降低(P低=0.0089; P中=0.0072; P高=0.0011),Bax(P低=0.0076; P中=0.0062; P高=0.0033)、cleaved caspase-3(P低=0.0069; P中=0.0051; P高=0.0039)和cleaved caspase-9(P低=0.0084; P中=0.0055; P高=0.0049)的表达水平均显著升高,并呈现剂量反应关系,差异有统计学意义,见图 5。
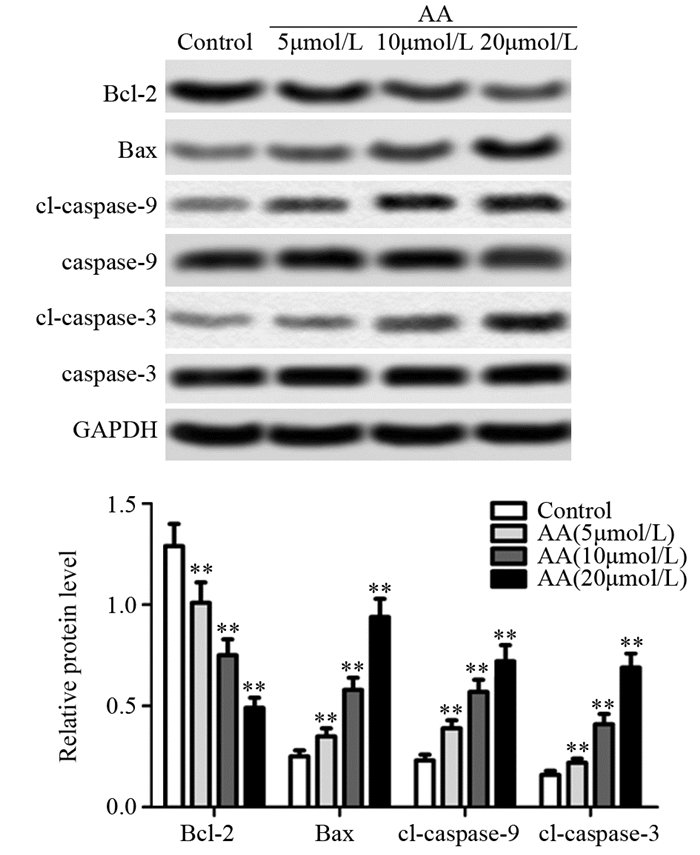
|
| cl: cleaved; **: P < 0.01, compared with Control group, n=3 图 5 蛋白质印迹法检测细胞凋亡相关蛋白的表达水平 Figure 5 Expression levels of apoptotic-related proteins detected by Western blot |
结肠癌是常见的发生于结肠部位的恶性肿瘤,早期症状不明显,多数患者确诊时已属中晚期。结肠癌的治疗以手术为主,化疗、放疗和射频消融等作为辅助手段,但中晚期结肠癌患者生存期和预后效果均不佳。许多研究显示,中药提取物在延长肿瘤生存期、提高患者生活质量、增加肿瘤药物敏感度等方面有着明显的效果,如双氢青蒿素可以诱导头颈癌细胞周期阻滞[11]。人参中提取出来的天然活性成分,人参皂苷更是被证明有多种癌症的抑制作用[12]。因而中药提取物在肿瘤治疗中的研究日渐增多。黄芪甲苷是中药黄芪中提取出的天然化合物,被证实能通过干扰免疫功能来抑制肺癌细胞的发展,还能抑制乳腺癌细胞的侵袭[13-14]。据报道,黄芪甲苷能增加结直肠癌细胞对顺铂的药物敏感度和调控细胞自噬,为进一步探讨黄芪甲苷对结肠癌细胞的作用,本文在体外实验中检测黄芪甲苷对人结肠癌细胞增殖和凋亡的影响。
本文首先采用含一系列不同浓度黄芪甲苷的培养基培养人结肠癌SW480细胞,CCK-8检测黄芪甲苷对SW480细胞存活的影响。结果显示,黄芪甲苷浓度高于20 μmol/L时,细胞存活率显著降低,提示黄芪甲苷浓度过高。黄芪甲苷浓度低于20 μmol/L时,结肠癌SW480细胞的存活率未见明显变化,因此后续实验选择黄芪甲苷的浓度为5、10和20 μmol/L。
细胞增殖和细胞凋亡调节失常是恶性肿瘤细胞具有无限增殖能力的关键因素。有研究发现黄芪甲苷对多种类型的肿瘤有增殖抑制作用,如肝癌、胃癌和乳腺癌[15-17]。本研究发现,结肠癌SW480细胞经不同浓度黄芪甲苷作用后,细胞增殖倍数显著降低,且黄芪甲苷对SW480细胞增殖的抑制作用呈时间和剂量依赖关系。Ki67为增殖细胞中核抗原,其表达量与细胞分裂密切相关,是广泛运用的增殖细胞标志之一[18]。增殖细胞核抗原PCNA是真核生物DNA所必需的蛋白,在S期细胞中含量最高,PCNA的含量已经作为评价肿瘤细胞增殖状态的重要手段[19]。大量研究显示,在结肠癌实体瘤中Ki67和PCNA高表达,抗肿瘤药物抑制结肠癌细胞增殖伴随着PCNA和Ki67表达水平的下调[20]。Western blot检测细胞中增殖标志蛋白Ki67和PCNA的表达,发现SW480细胞经黄芪甲苷作用后,细胞中Ki67和PCNA的表达水平显著降低,间接反映SW480细胞增殖能力的降低。结果与CCK-8的结果一致,表明黄芪甲苷抑制人结肠癌SW480细胞的增殖。然而黄芪甲苷抑制SW480细胞增殖的具体作用机制仍需要进一步实验探究。
在本研究中,我们用Hoechst染色检测了暴露于黄芪甲苷的SW480细胞核的形态变化和凋亡细胞的比率。研究发现黄芪甲苷加药组发生凋亡的细胞比率明显高于对照组,并呈现剂量反应关系。从形态学上观察,SW480细胞经黄芪甲苷作用后,细胞核变小、出现核固缩甚至是破碎,细胞呈现凋亡状态。同时黄芪甲苷加药组细胞中活化的caspase-3和caspase-9的蛋白含量显著高于SW480组。Caspase的活化是线粒体介导的细胞凋亡途径中不可或缺的部分。在Caspase蛋白家族中,Caspase-9处于上游蛋白酶,通过激活Caspase-3促使凋亡的不可逆转的进行[21]。大量研究显示,活化的Caspase-3蛋白含量增高,酶解下游一系列凋亡抑制蛋白和DNA合成相关蛋白,加速SW480细胞凋亡的进程。杨雨等研究显示,阿托曼黄素通过上调Caspase-3和β-catenin的表达,诱导SW480细胞凋亡[22]。本实验结果表明,黄芪甲苷能诱导人结肠癌SW480细胞凋亡。
人结肠癌SW480细胞经黄芪甲苷作用后,细胞增殖倍数显著降低,细胞增殖标志蛋白Ki67和PCNA的表达水平显著降低,提示黄芪甲苷抑制SW480细胞增殖的作用;Hoechst染色显示,黄芪甲苷作用后的SW480细胞凋亡数目明显增加,细胞核形态发生凋亡性变化,Western blot结果也显示细胞中活化后的caspase-3和caspase-9的表达显著上升。综上所述,黄芪甲苷抑制人结肠癌SW480细胞增殖、诱导细胞凋亡。下一步计划,构建荷瘤小鼠模型,体内实验检测黄芪甲苷对结肠癌增殖和凋亡的影响。
作者贡献
陈攀丽:设计实验,完成绝大部分实验和文章写作
唐建荣:参与细胞培养和实验数据处理
张逸强:参与文章修改
| [1] | Siegel RL, Miller KD, Fedewa SA, et al. Colorectal cancer statistics, 2017[J]. CA Cancer J Clin, 2017, 67(3): 117–193. |
| [2] | Afrin S, Giampieri F, Gasparrini M, et al. Chemopreventive and Therapeutic Effects of Edible Berries: A Focus on Colon Cancer Prevention and Treatment[J]. Molecules, 2016, 21(2): 169. DOI:10.3390/molecules21020169 |
| [3] | Stein KB, Snyder CF, Barone BB, et al. Colorectal cancer outcomes, recurrence, and complications in persons with and without diabetes mellitus: a systematic review and meta-analysis[J]. Dig Dis Sci, 2010, 55(7): 1839–1851. DOI:10.1007/s10620-009-0944-8 |
| [4] | André T, Boni C, Navarro M, et al. Improved overall survival with oxaliplatin, fluorouracil, and leucovorin as adjuvant treatment in stage Ⅱ or Ⅲ colon cancer in the mosaic trial[J]. J Clin Oncol, 2009, 27(19): 3109–3116. DOI:10.1200/JCO.2008.20.6771 |
| [5] | 杨庆珍, 王增绘, 付娟, 等. 黄芪化学成分与生态因子的相关性[J]. 应用生态学报, 2015, 26(3): 732–738. [ Yang QZ, Wang ZH, Fu J, et al. Correlation between chemical constituents and ecological factors of astragalus membranaceus var.mongholicus[J]. Ying Yong Sheng Tai Xue Bao, 2015, 26(3): 732–738. ] |
| [6] | Du M, Wu XJ, Ding J, et al. Astragaloside Ⅳ and polysaccharide production by hairy roots of Astragalus membranaceus in bioreactors[J]. Biotechnol Lett, 2003, 25(21): 1853–1856. DOI:10.1023/A:1026233728375 |
| [7] | Ren S, Zhang H, Mu Y, et al. Pharmacological effects of Astragaloside Ⅳ: a literature review[J]. J Tradit Chin Med, 2013, 33(3): 413–416. DOI:10.1016/S0254-6272(13)60189-2 |
| [8] | Gui D, Guo Y, Feng W, et al. Astragaloside Ⅳ, a novel antioxidant, prevents glucose-induced podocyte apoptosis in vitro and in vivo[J]. PLoS One, 2012, 7(6): e39824. DOI:10.1371/journal.pone.0039824 |
| [9] | Xie T, Li Y, Li SL, et al. Astragaloside Ⅳ enhances cisplatin chemosensitivity in human colorectal cancer via regulating NOTCH3[J]. Oncol Res, 2016, 24(6): 447–453. DOI:10.3727/096504016X14685034103590 |
| [10] | 庞歆桥, 赵鹏飞, 杨凡, 等. 黄芪甲苷联合西妥昔单抗对人结肠癌细胞系RKO自噬调节与增殖的抑制作用[J]. 实用医学杂志, 2016, 32(18): 2992–2995. [ Pang XQ, Zhao PF, Yang F, et al. Astragaloside combine with Cetuximab inhibits proliferation and regulates autophagy of human colon cancer cell RKO[J]. Shi Yong Yi Xue Za Zhi, 2016, 32(18): 2992–2995. DOI:10.3969/j.issn.1006-5725.2016.18.014 ] |
| [11] | Lin R, Zhang Z, Chen L, et al. Dihydroartemisinin (dha) induces ferroptosis and causes cell cycle arrest in head and neck carcinoma cells[J]. Cancer Lett, 2016, 381(1): 165–175. DOI:10.1016/j.canlet.2016.07.033 |
| [12] | 喻春皓, 王冲之, 袁钧苏. 西洋参抗癌研究进展——以结直肠癌为研究范例[J]. 药学学报, 2013, 48(7): 986–992. [ Yu CH, Wang CZ, Yuan CS. Progress in anti-cancer research of american ginseng: With an example of colorectal cancer[J]. Yao Xue Xue Bao, 2013, 48(7): 986–992. ] |
| [13] | Zhang A, Zheng Y, Que Z, et al. Astragaloside Ⅳ inhibits progression of lung cancer by mediating immune function of Tregs and CTLs by interfering with IDO[J]. J Cancer Res Clin Oncol, 2014, 140(11): 1883–1890. DOI:10.1007/s00432-014-1744-x |
| [14] | Jiang K, Lu Q, Li Q, et al. Astragaloside Ⅳ inhibits breast cancer cell invasion by suppressing vav3 mediated rac1/mapk signaling[J]. Int Immunopharmacol, 2017, 42: 195–202. DOI:10.1016/j.intimp.2016.10.001 |
| [15] | Ou Yang Y, Huang J, Ouyang Z, et al. Enrichment and purification process of astragalosides and their anti-human gastric cancer MKN-74 cell proliferation effect[J]. Afr Health Sci, 2014, 14(1): 22–27. DOI:10.4314/ahs.v14i1.5 |
| [16] | 马鹏飞, 阮柏, 王德盛, 等.黄芪甲苷对肝癌细胞增殖和侵袭能力的影响及其机制研究[J].现代肿瘤医学, 2014, 22(5): 1013-1015. [ The anti-proliferation and anti-invasion effect of astragaloside Ⅳ on liver cancer cell line in vitro and its mechanism[J]. Xian Dai Zhong Liu Yi Xue, 2014, 22(5): 1013-1015. ] http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=sxzlyx201405010 |
| [17] | 邓樱, 陈红风. 黄芪注射液及其有效成分对乳腺癌细胞增殖和Akt磷酸化的影响[J]. 中西医结合学报, 2009, 7(12): 1174–1180. [ Deng Y, Chen HF. Effects of Astragalus injection and its ingredients on proliferation and Akt phosphorylation of breast cancer cell lines[J]. Zhong Xi Yi Jie He Xue Bao, 2009, 7(12): 1174–1180. ] |
| [18] | Juríková M, Danihel Ľ, Polák Š, et al. Ki67, PCNA, and MCM proteins: markers of proliferation in the diagnosis of breast cancer[J]. Acta Histochem, 2016, 118(5): 544–552. DOI:10.1016/j.acthis.2016.05.002 |
| [19] | Strzalka W, Ziemienowicz A. Proliferating cell nuclear antigen (pcna): A key factor in DNA replication and cell cycle regulation[J]. Ann Bot, 2011, 107(7): 1127–1140. DOI:10.1093/aob/mcq243 |
| [20] | Yan L, Yu HH, Liu YS, et al. Esculetin enhances the inhibitory effect of 5-fluorouracil on the proliferation, migration and epithelial-mesenchymal transition of colorectal cancer[J]. Cancer Biomark, 2019, 24(2): 231–240. DOI:10.3233/CBM-181764 |
| [21] | Mirzayans R, Andrais B, Kumar P, et al. The growing complexity of cancer cell response to DNA-Damaging agents: Caspase 3 mediates cell death or survival?[J]. Int J Mol Sci, 2016, 17(5): pii: E708. DOI:10.3390/ijms17050708 |
| [22] | 杨雨, 徐文娟, 彭康, 等. 穗花杉双黄酮通过影响caspase-3和β-catenin表达诱导结肠癌细胞SW480凋亡[J]. 南方医科大学学报, 2014, 34(7): 1035–1038. [ Yang Y, Xu WJ, Peng K, et al. Amentoflavone induces apoptosis in SW480 human colorectal cancer cells via regulating β-catenin and caspase-3 expressions[J]. Nan Fang Yi Ke Da Xue Xue Bao, 2014, 34(7): 1035–1038. DOI:10.3969/j.issn.1673-4254.2014.07.24 ] |
 2019, Vol. 46
2019, Vol. 46
