文章信息
- 分化差的胃神经内分泌肿瘤预后分析
- Prognosis of Poorly-differentiated Gastric Neuroendocrine Neoplasm
- 肿瘤防治研究, 2019, 46(5): 447-451
- Cancer Research on Prevention and Treatment, 2019, 46(5): 447-451
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.18.1770
- 收稿日期: 2018-11-21
- 修回日期: 2018-12-29
2. 300000 天津,天津医科大学肿瘤医院病理科,国家肿瘤临床医学研究中心天津市肿瘤防治重点实验室
2. Department of Pathology, Tianjin Medical University Cancer Institute and Hospital, National Clinical Research Center of Cancer, Key Laboratory of Cancer Prevention and Therapy, Tianjin 300000, China
胃神经内分泌肿瘤(gastric neuroendocrine neoplasms, g-NENs)是起源于胃肠道嗜铬样细胞的罕见肿瘤[1]。根据肿瘤分化程度,WHO消化系统肿瘤分类标准把神经内分泌肿瘤(neuroendocrine neoplasms, NENs)分为:神经内分泌瘤(neuroendocrine tumor, NET),神经内分泌癌(neuroendocrine carcinoma, NEC)以及混合性腺神经内分泌癌(mixed adenoneuroendocrine carcinoma, MANEC)[2]。其中,胃NEC和MANEC分化差、预后不良。目前,影响胃NEC和MANEC生存的因素尚不明确,术后是否需要辅助治疗,辅助方案如何选择尚无定论。本研究分析了天津医科大学肿瘤医院2007年1月—2017年10月行根治性手术治疗的全部g-NENs病例,探讨了g-NEC和MANEC的临床病理特点,以及辅助治疗与预后的关系。
1 资料与方法 1.1 一般资料收集天津医科大学肿瘤医院2007年1月—2017年10月共130例经确诊并行原发肿瘤切除的胃神经内分泌肿瘤患者,占同期胃原发肿瘤手术切除患者的1.47%,其中2例合并其他肿瘤(1例并发肾癌,1例并发胰腺癌)。对其中128例患者病理切片进行复阅,按照2010年WHO消化系统肿瘤分类及分级标准重新诊断,其中124例确诊为g-NEN,且均为R0切除,见图 1。
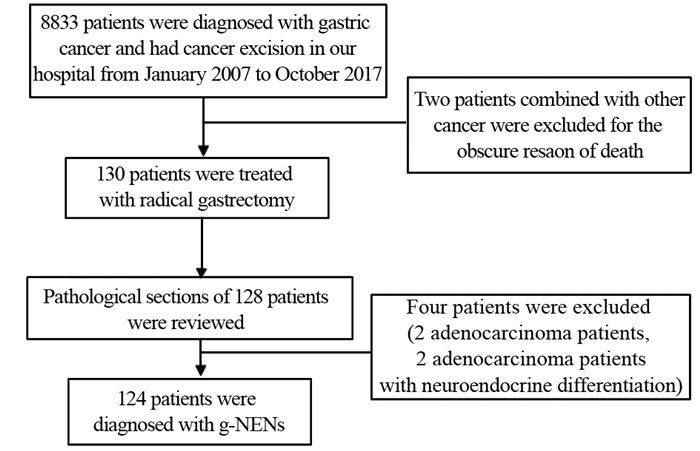
|
| 图 1 病例筛选 Figure 1 Case screening |
按照2010年WHO消化系统肿瘤分类及分级标准对病理切片进行复阅。g-NENs可分为NET、NEC和MANEC。根据病理核分裂相和Ki-67指数进行病理分级:低级别G1:核分裂相数为1/10高倍镜视野(HPF)或Ki-67指数≤2%;中级别G2:核分裂相数为2~20/10 HPF或Ki-67指数3%~20%;高级别G3:核分裂相数为 > 20/10 HPF或Ki-67指数 > 20%;如果两者不一致则采用较高分级的结果。结合影像学检查和术后病理对g-NENs进行TNM分期。
1.3 随访通过电话、病历或门诊复查进行定期随访,随访截至2018年7月9日。随访内容为患者的治疗经过、影像学检查以及患者的生存情况,随访日期为手术日至末次随访或患者死亡。
1.4 统计学方法应用SPSS21.0统计软件进行分析。采用Kaplan-Meier法绘制生存曲线和计算生存率,Log rank检验进行单因素分析,Cox比例风险回归模型进行多因素分析。P < 0.05为差异有统计学意义。
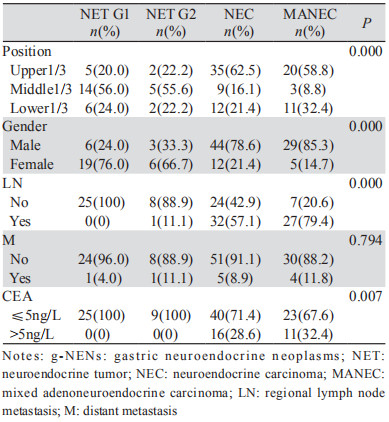
2 结果 2.1 患者的临床病理特点124例患者中有NET G1 25例、NET G2 9例、NEC 56例和MANEC 34例。各型肿瘤临床病理特点,见表 1。
全组患者的中位随访时间为23.5月,死亡36例,其中34例因肿瘤恶化而死亡,2例死于非肿瘤原因(1例死于肺炎,1例死于脑外伤)。根治性切除术后NET G1、NET G2、NEC和MANEC型肿瘤5年生存率分别为100%、100%、52.4%和38.8%(χ2=20.09, P=0.000),见图 2。
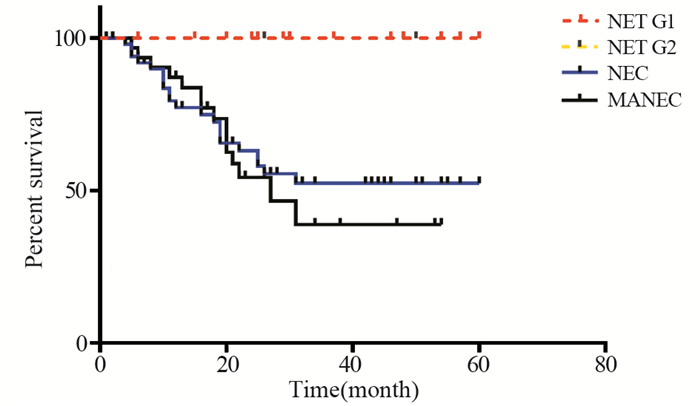
|
| 图 2 各型g-NEN患者生存情况比较 Figure 2 Survival of all types of g-NEN patients |
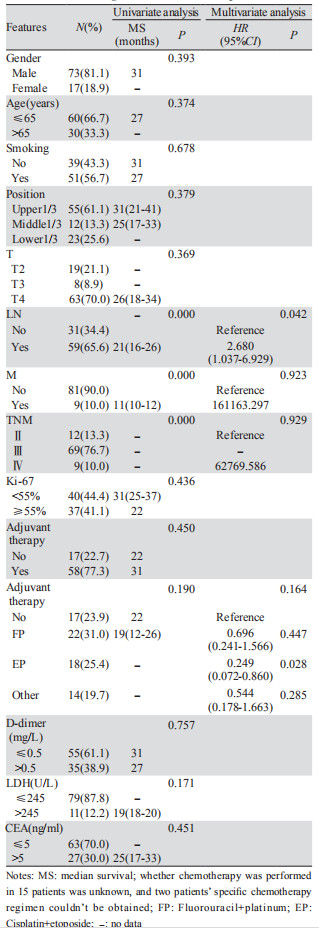
进一步分析影响NEC和MANEC预后的因素,单因素生存分析显示:淋巴结转移、远处转移、TNM分期与患者的预后相关,而性别、年龄、吸烟史、肿瘤位置、T分期、D-Dimer、LDH、CEA、有无辅助治疗等因素不影响患者的预后,见表 2。将单因素分析有意义的变量淋巴结转移、远处转移和TNM分期,以及临床认为有意义的变量有无辅助治疗(辅助化疗有获益趋势)纳入多因素Cox分析,只有淋巴结转移与否(HP=2.680, P=0.042)是影响患者预后的独立因素,同时可以看出EP(顺铂联合依托泊苷)方案术后辅助有使患者获益的趋势(P=0.028),见表 2。
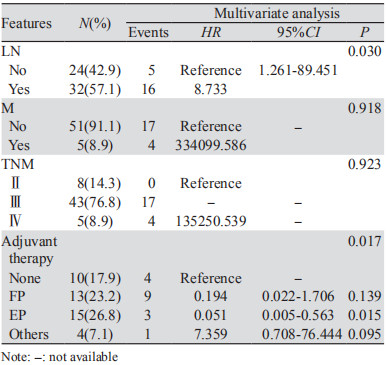
进一步通过单因素和多因素分别对g-NEC和MANEC的预后因素进行分析,其中淋巴结转移(HR=8.733, P=0.030)和辅助治疗,尤其EP方案(HR=0.051, P=0.015)是影响g-NEC患者预后的独立因素,而未发现影响MANEC患者预后的独立因素,见表 3。考虑到辅助治疗的疗效可能与分期有关,选取Ⅲ+Ⅳ期MANEC患者进行亚组分析,辅助化疗组较无辅助化疗组有获益趋势(中位OS 27月vs. 11月),但差异无统计学意义(χ2=1.734, P=0.188),见图 3。
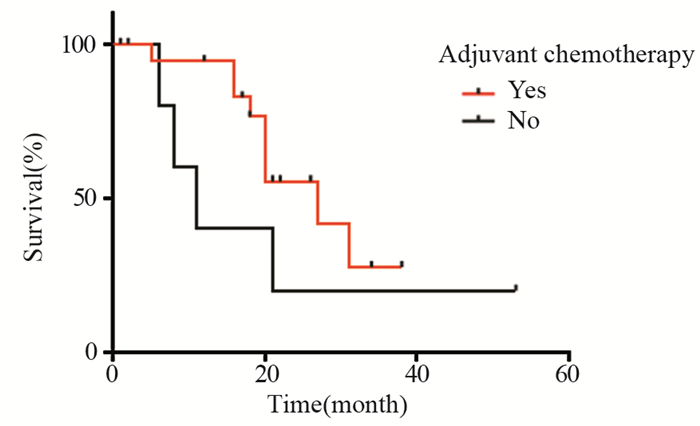
|
| 图 3 有无辅助治疗对TNM Ⅲ+Ⅳ胃MANEC患者生存的影响 Figure 3 Effect of adjuvant therapy on survival of patients with TNM Ⅲ+Ⅳ gastric MANEC |
近年来,g-NEN发病率逐年增加[3],2008年Yao等报道g-NEN占胃癌的比率不到1%[4],本研究表明,10年间于我院手术治疗的胃神经内分泌肿瘤患者占同期所有手术治疗的胃癌患者的1.47%。2010年WHO将胃神经内分泌肿瘤分为分化良好的NET(包括G1型、G2型)和分化差的NEC以及MANEC。相关文献报道,NEC中男女比例为3.8:1到4.4:1[5-6],另外,Xu等[5]对43例NEC患者进行多因素生存分析,发现女性较男性有明显的生存优势,本研究中,NEC患者的男女比例为3.6:1,与之前报道相近,但并未发现性别是NEC患者预后的影响因素。NEC和MANEC患者中淋巴结转移率、远处转移率和CEA水平较高,提示预后较差。各型肿瘤患者的5年生存情况中NEC和MANEC型肿瘤患者的生存率最低,但本研究中NEC和MANEC的预后差异无统计学意义,这与Yin等[7]研究一致,也有研究表明,NEC患者预后比MANEC患者差[8-9]。
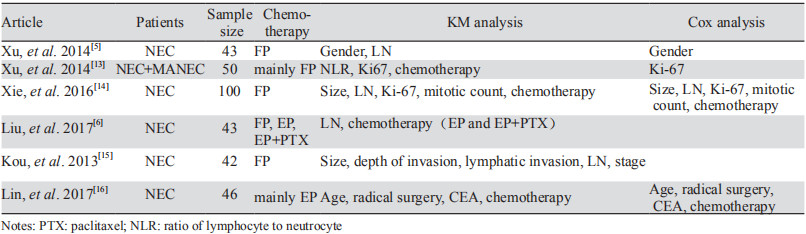
胃NEC和MANEC患者预后差,其中g-NEC患者5年生存率甚至低于胃腺癌(38.7% vs. 51.8%, P=0.030)[10-11]。目前,对于早期的g-NEC患者,多推荐手术治疗;但对于存在远处转移的患者是否需要积极的手术治疗尚需综合考虑肿瘤分级、是否存在肝外转移、原发灶和转移灶的可切除性等多方面问题;对于不能手术切除的患者,多推荐以化疗为主的综合治疗,化疗方案以EP方案为首选[12]。根治性术后患者的生存期长短不一,对于影响患者术后复发和总生存期的因素尚无明确定论,术后辅助治疗是否能改善患者预后,以及什么辅助治疗方案能更好的改善患者预后,尚未明确[5-6, 13-16],见表 4。
本研究表明对于分化差的NEC和MANEC患者,EP方案术后辅助治疗有使患者术后生存获益的趋势(HR=0.249, P=0.028)。在单独对g-NEC患者进行生存分析时,术后辅助治疗是影响患者预后的独立因素,尤其EP方案最明显,其中位OS未达到(EP组中位随访时间为26月,到随访结束共有3例死亡,2例失访,1例复发,9例无复发生存,预计其中位OS在30月以上)。类似地,Liu等[6]研究中EP组中位OS为48月,显著改善了患者的预后,而传统的氟尿嘧啶类药物联合铂类(FP)方案其中位OS在12~28.9月之间[5, 14-15]。本研究对g-NEC的分析中,FP组中位OS为19月,与无辅助化疗相比,有改善患者生存的趋势(HR=0.194, P=0.139),但差异无统计学意义,与EP方案相比,其效果欠佳。另外,有研究表明[17],对于转移或复发的g-NEC,IP方案能使患者中位生存期达22月,该方案可能是使g-NEC术后患者生存获益的潜在治疗方案。研究表明[18-20],g-NEC对含铂化疗方案的敏感度与Ki-67指数相关,对于Ki-67指数≤55%的g-NEC患者,一般不推荐含铂辅助治疗,但本研究中辅助治疗的效果与Ki-67指数无关(χ2=0.010, P=0.920),见图 4。
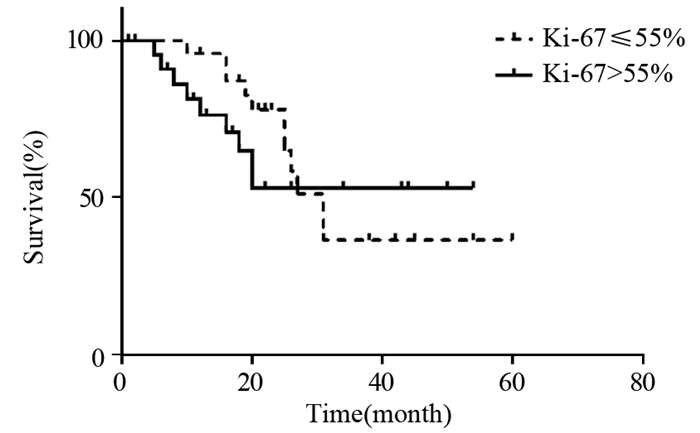
|
| 图 4 含铂化疗方案对不同Ki-67指数的NEC患者预后的影响 Figure 4 Effects of chemotherapy with platinum on prognosis of patients with different Ki-67 index |
MANEC是腺癌与神经内分泌癌的混合,影响胃MANEC预后的临床病理因素以及术后辅助治疗能否使患者获益,目前尚无明确结论[21]。本研究对可能影响胃MANEC患者预后的临床病理因素进行单因素分析,发现患者预后只与淋巴结转移有关,把是否有淋巴结转移和是否有辅助治疗纳入Cox分析,二者均不是影响MANEC患者预后的独立因素。考虑到辅助治疗的疗效可能与肿瘤分期有关,选取Ⅲ+Ⅳ期患者作为研究对象,单因素分析显示:辅助化疗组较无辅助治疗组有获益趋势,但差异无统计学意义(P=0.188)。无辅助治疗组中有1例肿瘤浸透浆膜并且合并淋巴结转移的患者,53月无瘤生存,这可能对P值产生了一定的影响。本研究是回顾性分析,且样本量较小,所得结论仍需大样本前瞻性研究来证实。
综上所述,g-NEC患者的预后与淋巴结转移和有无辅助治疗有关;无论是否有淋巴结转移或远处转移,术后应当给予辅助治疗,EP方案化疗是一个合理选择。本研究未发现胃MANEC患者的独立预后因素,此类患者术后是否需要化疗,有待进一步研究。
作者贡献
张剑: 收集资料、分析数据、撰写论文
臧凤琳: 病理阅片
张家丽: 收集资料、论文修改
张新伟: 论文修改
| [1] | Modlin IM, Shapiro MD, Kidd M. Siegfried Oberndorfer: origins and perspectives of carcinoid tumors[J]. Hum Pathol, 2004, 35(12): 1440–51. DOI:10.1016/j.humpath.2004.09.018 |
| [2] | Rindi G, Arnold R, Bosman FT, et al. WHO Classification of Tumours of the Digestive System[M]. 4th ed. Lyon, France: International Agency for Research on Cancer (IARC), 2010: 13-4. |
| [3] | Cao LL, Lu J, Lin JX, et al. Incidence and survival trends for gastric neuroendocrine neoplasms: An analysis of 3523 patients in the SEER database[J]. Eur J Surg Oncol, 2018, 44(10): 1628–33. DOI:10.1016/j.ejso.2018.01.082 |
| [4] | Yao JC, Hassan M, Phan A, et al. One hundred years after " carcinoid" : epidemiology of and prognostic factors for neuroendocrine tumors in 35, 825 cases in the United States[J]. J Clin Oncol, 2008, 26(18): 3063–72. DOI:10.1200/JCO.2007.15.4377 |
| [5] | Xu X, Li J, Han X, et al. Clinical characteristics and prognostic factors of patients with gastric neuroendocrine carcinoma treated with radical surgery[J]. Chin Med J (Engl), 2014, 127(13): 2419–22. |
| [6] | Liu DJ, Fu XL, Liu W, et al. Clinicopathological, treatment, and prognosis study of 43 gastric neuroendocrine carcinomas[J]. World J Gastroenterol, 2017, 23(3): 516–24. DOI:10.3748/wjg.v23.i3.516 |
| [7] | Yin XN, Shen CY, Yin YQ, et al. Prognoses in patients with primary gastrointestinal neuroendocrine neoplasms based on the proposed new classification scheme[J]. Asia Pac J Clin Oncol, 2018, 14(2): e37–e44. DOI:10.1111/ajco.2018.14.issue-2 |
| [8] | Kim BS, Park YS, Yook JH, et al. Comparison of the prognostic values of the 2010 WHO classification, AJCC 7th edition, and ENETS classification of gastric neuroendocrine tumors[J]. Medicine (Baltimore), 2016, 95(30): e3977. DOI:10.1097/MD.0000000000003977 |
| [9] | Park JY, Ryu MH, Park YS, et al. Prognostic significance of neuroendocrine components in gastric carcinomas[J]. Eur J Cancer, 2014, 50(16): 2802–9. DOI:10.1016/j.ejca.2014.08.004 |
| [10] | Xie JW, Lu J, Lin JX, et al. Different long-term oncologic outcomes after radical surgical resection for neuroendocrine carcinoma and adenocarcinoma of the stomach[J]. Oncotarget, 2017, 8(34): 57495–504. |
| [11] | Ishida M, Sekine S, Fukagawa T, et al. Neuroendocrine carcinoma of the stomach: morphologic and immunohistochemical characteristics and prognosis.J]. Am J Surg Pathol, 2013, 37(7): 949-59. |
| [12] | 陈洛海, 陈洁, 周志伟. 胃肠道神经内分泌肿瘤治疗最新指南解读[J]. 中华胃肠外科杂志, 2016, 19(11): 1201–4. [ Chen LH, Chen J, Zhou ZW. Interpretation of the latest guidelines in the treatment of gastrointestinal neuroendocrine neoplasms[J]. Zhonghua Wei Chang Wai Ke Za Zhi, 2016, 19(11): 1201–4. DOI:10.3760/cma.j.issn.1671-0274.2016.11.001 ] |
| [13] | 徐海燕, 张志影, 任芳, 等. 胃神经内分泌癌的临床病理特征及预后因素[J]. 世界华人消化杂志, 2014, 22(22): 3291–9. [ Xu HY, Zhang ZY, Ren F, et al. Clinicopathological characteristics and prognostic factors of gastric neuroendocrine carcinoma[J]. Shi Jie Hua Ren Xiao Hua Za Zhi, 2014, 22(22): 3291–9. ] |
| [14] | Xie JW, Sun YQ, Feng CY, et al. Evaluation of clinicopathological factors related to the prognosis of gastric neuroendocrine carcinoma[J]. Eur J Surg Oncol, 2016, 42(10): 1464–70. DOI:10.1016/j.ejso.2016.08.004 |
| [15] | 寇玉, 高业博, 马杰, 等. 胃神经内分泌癌42例预后分析[J]. 中华胃肠外科杂志, 2013, 16(6): 570–3. [ Kou Y, Gao YB, Ma J, et al. Prognostic analysis of 42 patients with gastric neuroendocrine carcinoma[J]. Zhonghua Wei Chang Wai Ke Za Zhi, 2013, 16(6): 570–3. DOI:10.3760/cma.j.issn.1671-0274.2013.06.018 ] |
| [16] | 林晓琳, 许琦, 刘泽兵, 等. 胃神经内分泌癌临床病理特征及预后相关因素[J]. 肿瘤, 2017, 37(10): 1079–85. [ Lin XL, Xu Q, Liu ZB, et al. Clinicopathological characteristics and prognosis-srlated factors of gastric neuroendocrine carcinoma[J]. Zhong Liu, 2017, 37(10): 1079–85. DOI:10.3781/j.issn.1000-7431.2017.33.528 ] |
| [17] | Okita NT, Kato K, Takahari D, et al. Neuroendocrine tumors of the stomach: chemotherapy with cisplatin plus irinotecan is effective for gastric poorly-differentiated neuroendocrine carcinoma[J]. Gastric Cancer, 2011, 14(2): 161–5. DOI:10.1007/s10120-011-0025-5 |
| [18] | Coriat R, Walter T, Terris Bea. Gastroenteropancreatic Well-Differentiated Grade 3 Neuroendocrine Tumors: Review and Position Statement[J]. Oncologist, 2016, 21(10): 1191–9. DOI:10.1634/theoncologist.2015-0476 |
| [19] | Heetfeld M, Chougnet CN, Olsen IH, et al. Characteristics and treatment of patients with G3 gastroenteropancreatic neuroendocrine neoplasms[J]. Endocr Relat Cancer, 2015, 22(4): 657–64. DOI:10.1530/ERC-15-0119 |
| [20] | Vélayoudom-Céphise FL, Duvillard P, Foucan L, et al. Are G3 ENETS neuroendocrine neoplasms heterogeneous?[J]. Endocr Relat Cancer, 2013, 20(5): 649–57. DOI:10.1530/ERC-13-0027 |
| [21] | de Mestier L, Cros J, Neuzillet C, et al. Digestive System Mixed Neuroendocrine-Non-Neuroendocrine Neoplasms[J]. Neuroendocrinology, 2017, 105(4): 412–5. DOI:10.1159/000475527 |
 2019, Vol. 46
2019, Vol. 46