文章信息
- 重要神经血管周围肉瘤手术联合后装放疗效果分析
- Effect of Surgical Excision Combined with Brachytherapy Treatment on Sarcoma Surrounding Important Nerve and Blood Vessels
- 肿瘤防治研究, 2019, 46(8): 729-732
- Cancer Research on Prevention and Treatment, 2019, 46(8): 729-732
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.18.1685
- 收稿日期: 2018-12-29
- 修回日期: 2019-03-05
2. 300060 天津,天津医科大学肿瘤医院放疗科;国家肿瘤临床医学研究中心;天津市“肿瘤防治”重点实验室;天津市恶性肿瘤临床医学研究中心
2. Radiotherapy Department, Tianjin Medical University Cancer Institute and Hospital, National Clinical Research Center for Cancer, Key Laboratory of Cancer Prevention and Therapy, Tianjin, Tianjin's Clinical Research Center for Cancer, Tianjin 300060, China
软组织肉瘤(soft tissue sarcomas, STS)是起源于结缔组织、可发生于任何解剖部位、包含多种病理类型的软组织恶性肿瘤。发病率1.28/10万~1.72/10万,占成人所有恶性肿瘤的0.73%~0.81%[1]。2015年美国新增约11 930例STS,死亡约4 870例[2]。50多种STS组织学亚型中,常见类型包括多形性肉瘤、脂肪肉瘤、平滑肌肉瘤、滑膜肉瘤、恶性外周神经鞘瘤,占所有软组织肉瘤75%[3],STS的治疗目的是在获得良好的肿瘤局部控制的同时,尽可能地保留肢体功能和外观。外科手术治疗仍然是唯一可获得根治的治疗手段[1]。近年来,外科手术也发生了很大变化,由于放化疗等肿瘤治疗手段的进步,STS的治疗已经由过去的截肢术等对肢体功能影响较大的手术方式转变为保肢手术联合放疗和化疗等多种手段的综合治疗,但对于腹股沟、腘窝、腋窝、前臂等重要神经血管周围软组织肉瘤局部控制率仍是难题,一般需要联合外照射放疗进一步补充治疗。后装放疗(brachytherapy)可最大程度杀灭肿瘤细胞而对周围血管神经等正常组织不造成严重影响,从而提高肿瘤的局部控制率。本研究对重要神经血管周围的肉瘤行手术切除,并于神经血管周围置后装管,术后补充后装放疗,评价该治疗方案的治疗效果及不良反应。
1 资料与方法 1.1 一般资料收集2015年3月—2017年4月天津医科大学肿瘤医院骨与软组织肿瘤科收治的30例重要血管神经周围软组织肉瘤患者资料。其中男14例,女16例;年龄12~75岁,中位年龄49岁。肉瘤分型包括:多形性未分化肉瘤9例、滑膜肉瘤4例、脂肪肉瘤10例、横纹肌肉瘤2例、纤维肉瘤3例、高级别恶性孤立性纤维性肿瘤1例、骨外骨肉瘤1例。按2010年AJCC第七版软组织肉瘤分期分为:ⅠA期0例、ⅠB期2例、ⅡA期2例、ⅡB期11例、Ⅲ期15例。肿瘤发生于上肢部位9例,下肢16例,腹股沟3例,腋窝2例。
1.2 术前准备所有患者常规评估心肺功能,无手术禁忌。术前行穿刺活检,病理明确诊断为肉瘤。行强化MRI或者强化CT等检查,评估肿瘤大小、解剖位置及与周围神经、血管的位置关系,并设计手术方案。
1.3 治疗方案本次入组30例患者的STS,均与周围重要神经或者血管毗邻,未形成包裹,但外科手术治疗很难达到R0切除。所有入组病例严格按照肿瘤外科的原则,除了重要神经血管周围,其余切缘严格按照R0切除。手术具体操作要求[1]:(1)术前基于病理和强化MRI、强化CT等资料制定手术方案,设计最佳手术入路及手术切除范围和重建所需的技术准备;(2)将活检道与肿瘤作为一个整体同时切除;(3)直视下必须努力获得安全边界;(4)误入肿瘤时无论是否达到肿瘤实质,均应立即严密缝合并扩大切除;(5)贴肿瘤面切除时需要特别标记,并在术后获取切缘信息;(6)切除的标本必须标记极相,并要求病理医师出具边缘是否残留的评价报告;(7)肢体位置较深的高级别软组织肉瘤,尽量实施间室切除或间隙切除;(8)肿瘤切除过程中,切忌挤压肿瘤。1例典型病例MRI检查结果见图 1。
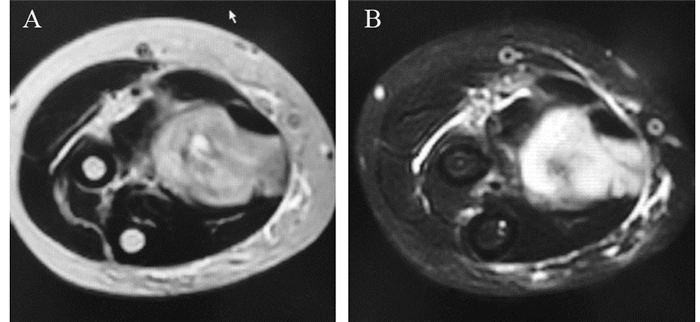
|
| A: slightly high signal intensity on T1WI; B: high signal intensity on T2WI 图 1 1例典型重要血管神经周围软组织肉瘤患者的术前MRI检查结果 Figure 1 Preoperative MRI of one typical patient with sarcoma surrounding important nerve and blood vessels |
术中置后装管:后装管为瑞典产施源软管(Flexible implant tube),外径1.9 mm,长约30 cm,后装机为瑞典Nucletron高剂量后装机,型号为microselectron。采用后装治疗计划系统Oncentra Version: 4.3。术中完整切除肿瘤后,确认瘤床范围,肉眼下按照巴黎布管原则,间隔1 cm摆放后装管,出皮处以纽扣缝合固定,瘤床内后装管应用缝合线多点固定,见图 2。
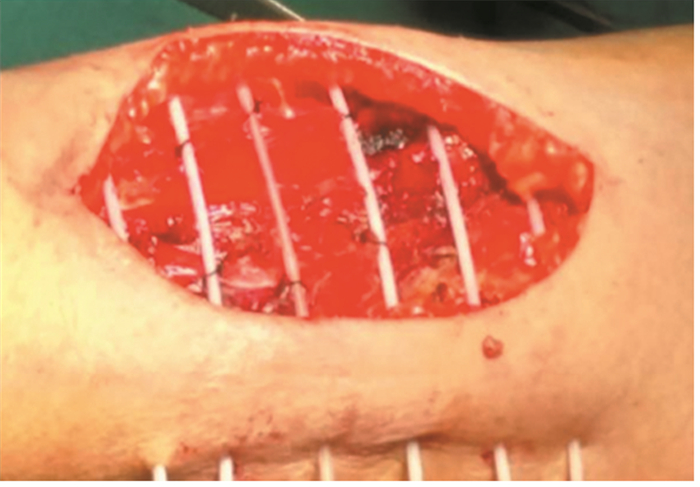
|
| 图 2 1例典型重要血管神经周围软组织肉瘤患者术中置管情况 Figure 2 Tubes fixed in operation on one typical patient with sarcoma surrounding important nerve and blood vessels |
术后制定后装计划并进行后装放疗:术后行螺旋CT薄层扫描,将数据传送至后装治疗计划系统进行三维重建和剂量设计,并进行逆向优化设计,使后装放疗剂量更加均匀,见图 3。术后第3~5天开始高剂量近距离放疗,每次剂量为200 cGy,一天2次,连续5天完成后拔管,切口定期换药,适当延长缝合线拆除时间。
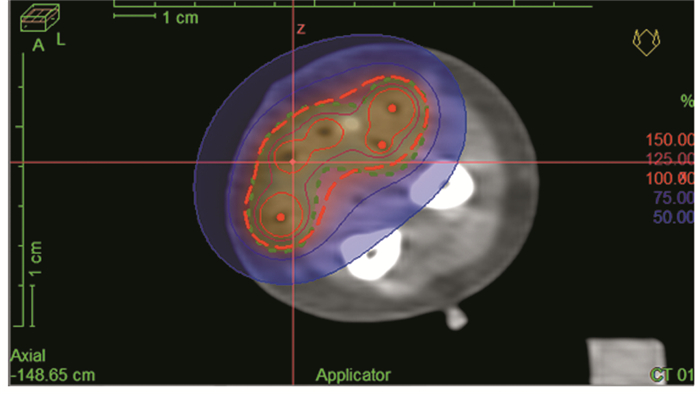
|
| 图 3 重要血管神经周围软组织肉瘤患者的后装计划:三维重建和剂量设计 Figure 3 Brachytherapy plan formulation for one typical patient with sarcoma surrounding important nerve and blood vessels: three-dimensional reconstruction and dose design |
术前新辅助化疗16例,术后化疗23例,化疗方案为AI方案,7例患者术前穿刺病理考虑恶性,未明确肉瘤级别,未进行新辅助化疗,10例脂肪肉瘤中4例为黏液性脂肪肉瘤、3例纤维肉瘤,考虑低度恶性,未进行化疗。
1.5 随访术后3年内每3月随访1次,行体格检查及影像学检查,术后瘤床区域尽量选择磁共振检查,观察是否存在局部复发及其他并发症。记录患者的伤口愈合、局部控制及肢体功能情况。放射治疗结束时通过皮肤放射损伤来评估局部并发症。根据放射肿瘤协作组(RTOG)分级标准来分级皮肤急性放射损伤:0级:无变化;1级:滤泡样暗色红斑、脱发、干性脱皮、出汗减少;2级:触痛性或鲜色红斑、片状湿性脱皮、中度水肿;3级:皮肤皱褶以外融合的湿性脱皮、凹陷性水肿;4级:溃疡、出血、坏死。观察皮肤放疗后的远期并发症。患者肢体功能评估使用国际骨与软组织肿瘤协会(MSTS)功能评估标准,术后6月行功能评分。
1.6 统计学方法用IBM SPSS Statistics 22.0统计软件进行分析,采用配对样本t检验,P < 0.05为差异有统计学意义,应用Kaplan-Meier法进行生存分析。
2 结果对患者追踪随访18~43月,平均随访31.6月,中位随访时间32.0月,2年生存率为96.7%;外科切缘R0 18例(60%),R1 12例(40%),无R2切缘;30例患者术前MSTS评分为23.36±1.51,术后6月评分为21.51±1.82,差异无统计学意义(P > 0.05),手术联合后装治疗后,患者肢体功能无明显受限影响。
术后随访中,肿瘤局部复发2例,1例患者手术后18月肿瘤复发,全身多发转移,肿瘤晚期恶液质死亡。截止2018年10月,患者局部控制率为93.3%,1例局部切口延迟愈合,换药时间为半年,切口愈合。
术后放疗的远期并发症,1级25例,2级3例,3级1例,4级1例。2级以上的放疗并发症发生率为16.7%。
3 讨论软组织肉瘤是一种来源于黏液、纤维、脂肪、平滑肌、滑膜、横纹肌、间皮、血管等结缔组织的恶性肿瘤,包括起源于神经外胚层的神经组织肿瘤,不包括骨、软骨和淋巴造血组织。对于发病部位,肢体以未分化多形性肉瘤、脂肪肉瘤和滑膜肉瘤最多见,其中脂肪肉瘤好发于臀部、大腿和腹膜后,滑膜肉瘤最常见于中青年的关节附近,腺泡状软组织肉瘤多发生于下肢[1],本文回顾性分析了我院30例软组织肉瘤患者,发病部位位于四肢、腹股沟、腋窝、腘窝等部位,与重要神经血管关系密切,临床安全切缘很难达到,此类患者复发率较高。
外科手术是软组织肉瘤治疗的主要治疗方式之一,手术的目的不仅是完整切除肿瘤,而且要求获取安全的外科边缘。术后功能恢复与安全边界发生矛盾时,通常需要牺牲部分功能。安全外科边界是指MRI显示软组织肉瘤边缘或反应区外1 cm处,手术是在保证安全外科边界基础上追求完整切除肿瘤[1]。对于体积较大、较深或侵犯邻近大血管、神经、关节和骨骼等重要组织的肿瘤,无法达到R0切除,需要进行术前放化疗和介入治疗,否则有必要进行截肢。如果肿瘤侵犯多个间室或主要血管、神经,不能达到间室切除或广泛切除,保肢手术不可能获得满意的外科边界,截肢手术将使患者获益,但截肢为致残手术,使患者很难接受,勉强保肢往往局部复发率极高。
放射治疗作用于软组织肉瘤术后的亚临床病灶,可以起到杀灭残留微病灶,减少局部复发的作用。软组织肉瘤的术后放射治疗包括外照射及近距离放疗[1]。对于软组织肉瘤来说,由于大多肿瘤较大,且常常侵犯重要的血管及神经,导致肿瘤无法彻底切除,这时单纯应用外照射可能很难达到治疗要求,可能就需要近距离放疗的介入。
近距离放疗(brachytherapy)是在术中将塑料导管间隔1 cm平行放置于瘤床上并缝合固定,手术恢复期后,应用后装治疗系统将放射性粒子置入施源软管中,进行照射治疗。近距离放疗常用于辅助治疗,在标准外照射放疗后进行补充(5~15 Gy, 2~3 d),也可单独使用(45~50 Gy, 4~6 d)[4]。近距离放疗具有一定局部控制率(50%~70%),但并发症较高(80%)[5]。近距离放疗作为局部加量的手段可灵活地与外照射联合使用。后装治疗同外照射相比:(1)术后短时间内使肿瘤或瘤床受到高剂量的照射,大大缩短了住院治疗周期;(2)解决了手术野肿瘤残留问题,既能最大限度杀灭肿瘤细胞,又不影响周围血管、神经及其他组织,保证患肢血供,避免神经损伤,提高患者保肢质量;(3)可根据肿瘤的形态和体积进行施源器的设置,从而保证放疗区域得到足量均匀照射,更具有靶向性。美国后装治疗共识指出后装治疗是软组织肉瘤的有效治疗方式,能够改善肿瘤术后的局部控制率,对于切除范围有限的肿瘤,后装治疗是有效的治疗方式[6-7]。
Laskar等[8]对105例儿童软组织肉瘤患者进行了广泛切除术,其中81%的患者术后进行了后装治疗,其余患者术后进行了后装治疗+外照射治疗,研究发现单纯后装治疗与后装联合外照射相比,局部控制率无统计学意义,而且研究发现低剂量与高剂量后装治疗相比无统计学意义。Sharma等[9]对52例软组织肉瘤患者进行了手术切除,术后进行了高剂量的后装治疗,并进一步补充了外照射治疗,治疗后患者中位随访时间为46月,无局部复发病例,但是12例患者发生了远处转移,5年生存率为67%。Manir等[10]对29例非转移性肉瘤进行了后装治疗,中位随访时间为20月(17~51月),局部复发率为85.7%,中位无瘤生存时间为39.7月,总生存期为42.4月,14.8%病例发生2级以上的后装治疗相关并发症。Kim等[11]对80例肉瘤患者进行手术并联合放疗,中位随访时间为37.1月,局部复发率为41.3%,远处转移率为10%,2年和5年生存率分别为87.5%、71.1%。本研究结果与以上后装治疗研究结果基本一致,相对文献报道手术联合外照射放疗对于局部控制率具有更好的治疗效果,而且患肢功能得到了较好的保留。
通过本研究发现重要神经血管周围肉瘤手术切除联合后装治疗能够取得较高的局部控制率,保留肢体并对患者的肢体功能影响较小,还需积极防控后装治疗相关并发症。但本研究随访时间短,样本量小,存在局限性,需继续延长随访时间,并进一步加大样本量,以提高研究结论的准确性。
作者贡献
张超:临床试验实施,术后随访,文章撰写
王国文:临床试验实施,论文修改
韩秀鑫:临床试验实施,术后随访,数据统计
滕胜、马育林:临床试验实施
陈忠杰:制定后装计划
孙武军:后装放疗试验实施
| [1] | 中国抗癌协会肉瘤专业委员会, 中国临床肿瘤学会. 软组织肉瘤诊治中国专家共识(2015年版)[J]. 中华肿瘤杂志, 2016, 38(4): 310–320. [ Sarcoma Committee of Chinese Anti- Cancer Association, Chinese Society of Clinical Oncology. Chinese expert consensus on diagnosis and treatment of soft tissue sarcomas(Version 2015)[J]. Zhonghua Zhong Liu Za Zhi, 2016, 38(4): 310–320. DOI:10.3760/cma.j.issn.0253-3766.2016.04.013 ] |
| [2] | Siegel RL, Miller KD, Jemal A. Cancer statistics, 2015[J]. CA Cancer J Clin, 2015, 65(1): 5–29. DOI:10.3322/caac.21254 |
| [3] | Jo VY, Fletcher CD. WHO classification of soft tissue tumours: an update based on the 2013 (4th) edition[J]. Pathology, 2014, 46(2): 95–104. |
| [4] | Nag S, Shasha D, Janjan N, et al. The American Brachytherapy Society recommendations for brachytherapy of soft tissue sarcomas[J]. Int J Radiat Oncol Biol Phys, 2001, 49(4): 1033–1043. DOI:10.1016/S0360-3016(00)01534-0 |
| [5] | Torres MA, Ballo MT, Butler CE, et al. Management of locally recurrent soft-tissue sarcoma after prior surgery and radiation therapy[J]. Int J Radiat Oncol Biol Phys, 2007, 67(4): 1124–1129. DOI:10.1016/j.ijrobp.2006.10.036 |
| [6] | Naghavi AO, Fernandez DC, Mesko N, et al. American Brachytherapy Society consensus statement for soft tissue sarcoma brachyth-erapy[J]. Brachytherapy, 2017, 16(3): 466–489. DOI:10.1016/j.brachy.2017.02.004 |
| [7] | Laskar S1, Pilar A1, Khanna N, et al. Interstitial brachytherapy for orbital soft tissue sarcoma: an innovative technique[J]. J Contemp Brachytherapy, 2017, 9(5): 466–471. |
| [8] | Laskar S, Pilar A, Khanna N, et al. Interstitial brachytherapy for pediatric soft tissue sarcoma: Evolving practice over three decades and long-term outcomes[J]. Pediatr Blood Cancer, 2018, 65(9): e27112. DOI:10.1002/pbc.27112 |
| [9] | Sharma DN, Deo SV, Rath GK, et al. Perioperative high-dose-rate interstitial brachytherapy combined external beam radiation therapy for soft tissue sarcoma[J]. Brachytherapy, 2015, 14(4): 571–577. DOI:10.1016/j.brachy.2015.03.002 |
| [10] | Manir KS, Basu A, Choudhury KB, et al. Interstitial brachytherapy in soft tissue sarcoma: a 5 years institutional experience with Cobalt 60-based high-dose-rate brachytherapy system[J]. J Conte-mp Brachytherapy, 2018, 10(5): 431–438. DOI:10.5114/jcb.2018.78994 |
| [11] | Kim HJ, Koom WS, Cho J, et al. Efficacy of Postoperative Radiotherapy Using Modern Techniques in Patients with Retroperitoneal Soft Tissue Sarcoma[J]. Yonsei Med J, 2018, 59(9): 1049–1056. DOI:10.3349/ymj.2018.59.9.1049 |
 2019, Vol. 46
2019, Vol. 46


