文章信息
- 沉默UBE2N对人喉鳞癌hep-2细胞放射敏感度的影响
- Effects of UBE2N Knockdown on Radiosensitivity of Human Laryngeal Squamous Cell Carcinoma hep-2 Cells
- 肿瘤防治研究, 2019, 46(7): 583-587
- Cancer Research on Prevention and Treatment, 2019, 46(7): 583-587
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.18.1648
- 收稿日期: 2018-11-07
- 修回日期: 2019-04-01
2. 442000 十堰,锦州医科大学十堰市太和医院研究生培养基地;
3. 442000 十堰,湖北医药学院基础医学院生物化学教研室;
4. 42000 十堰,湖北医药学院生物工程学院;
5. 442000 十堰,湖北医药学院第一临床学院
2. Postgraduate Training Base, Shiyan Taihe Hospital, Jinzhou University of Medical Sciences, Shiyan 442000, China;
3. Department of Biochemistry, School of Basic Medical Sciences, Hubei University of Medicine, Shiyan 442000, China;
4. School of Biological Engineering, Hubei University of Medicine, Shiyan 442000, China;
5. The First Clinical School, Hubei University of Medicine, Shiyan 442000, China
近年来,我国喉癌发病率及死亡率不断上升,已成为头颈部最常见的恶性肿瘤之一[1],晚期喉癌术后同期放化疗的5年生存率为68.2%,单纯放疗的5年生存率仅为48.9%[2]。放疗在喉鳞癌的治疗中起到至关重要的作用[3]。放射抵抗是导致放疗失败的重要原因[4]。
UBE2N是泛素交联酶E2家族的成员之一。泛素交联酶E2家族参与泛素-蛋白酶体复合通路(ubiquitin-proteasome pathway, UPP)对底物蛋白的泛素化降解[5]。泛素-蛋白酶体复合通路在调控细胞周期、增殖、信号转导、DNA损伤修复、免疫应答等方面都发挥着重要作用[6]。UBE2N是DNA损伤修复通路的成员[7],DNA损伤后,UBE2N与泛素连接酶RNF8及RNF168结合后,促进DNA损伤反应中BRCA1及H2AX的泛素化修饰,从而促进下游DNA损伤反应的进行[8]。研究发现泛素交联酶UBE2N可能调控肿瘤细胞的放疗敏感度[9]。本研究沉默喉鳞癌hep-2细胞中UBE2N的表达,通过CCK8法、流式细胞术及克隆形成等实验,验证沉默UBE2N表达后对喉鳞癌细胞放射敏感度的影响,为明确UBE2N在调控喉鳞癌细胞放射敏感度中的作用提供实验依据。
1 材料与方法 1.1 实验材料DMEM培养基、胎牛血清购自美国Gibco公司;UBE2N siRNA沉默序列和阴性对照序列均由上海吉玛公司合成。RNA反转录试剂盒、PCR扩增试剂盒购自日本TaKaRa公司;蛋白裂解液、蛋白提取试剂盒、BCA蛋白定量试剂盒、细胞周期检测试剂盒、细胞凋亡检测试剂盒均购自南通碧云天生物技术研究所;内参GAPDH购自苏州GenePharma公司。GAPDH抗体、β-actin抗体、UBE2N抗体及各HRP-标记二抗购自英国Abcam公司;ECL化学发光试剂盒购自美国Thermo公司。Lipofectamine 3000购自美国Invitrogen公司;CCK8试剂盒购自日本同仁公司。流式细胞仪购自美国BD公司;荧光定量PCR仪、酶标仪、凝胶成像系统购自美国Bio-Rad公司。相机购自日本Canon公司。
1.2 实验方法 1.2.1 细胞培养人喉鳞癌hep-2细胞购自中国科学院上海细胞库,用含10%胎牛血清的DMEM培养基,置于37℃含5%CO2的细胞培养箱中培养。
1.2.2 UBE2N RNA沉默质粒转染实验分为UBE2N干扰组(UBE2N-siRNA)和阴性对照组(NC),UBE2N RNA沉默靶序列为:5′-AUCCAGAUGAUCCAUUAGCAATT-3′,阴性对照序列为:5′-TTCTCCGAACGTGTCACGT-3′。收集细胞,调整细胞密度至2×105/ml,接种于6孔板。待细胞贴壁生长后,按照Lipofectamine 3000说明书操作转染siRNA,转染24、48、72、96 h后,收集细胞进行后续相关实验。
1.2.3 qPCR实验收集细胞(约1×106个),按照RNA反转录试剂盒说明书操作提取RNA。取总RNA 2μg进行反转录反应,然后进行qPCR反应,PCR反应条件:95℃预变性1 min,95℃变性15 s,60℃退火1 min,72℃延伸1min,40个循环。UBE2N引物序列为:F: 5′-GCGTTTGCTGGCAGAACCAG-3′,R: 5′-CTCAAAGGGGGAATCCTGAGGG-3′;GAPDH引物序列为:F: 5′-CCAACCGCGAGAAGATGA-3′,R: 5′-CCAGAGGCGTACAGGGATAG-3′。以GAPDH为内参,按照2-ΔΔCt法计算UBE2N相对表达量。
1.2.4 Western blot实验收集细胞(约1×106个),按照试剂盒说明书操作提取蛋白,采用BCA法进行蛋白定量。取10 μg总蛋白用10% SDS-PAGE胶电泳,转膜后置于5%脱脂奶粉中室温封闭2 h。一抗4℃孵育过夜,二抗室温孵育2 h,采用ECL化学发光试剂盒显影。以ImagePro Plus 6.0图像分析软件计算灰度值,将内参蛋白与目的蛋白两者灰度值的比值作为目的蛋白的表达量。
1.2.5 CCK8增殖实验hep-2细胞经siRNA转染,并用0、2、4、6、8 Gy X线照射或不照射,收集细胞(约1×106个),以每孔3 000个细胞铺到96孔板中,培养24、48、72和96 h后分别向对应的细胞中加入CCK8,将96孔培养板置于37℃恒温箱孵育1 h,用酶标仪测450 nm处吸光度值。
1.2.6 细胞凋亡的测定hep-2细胞经siRNA转染,并用0、2、4、6、8 Gy X线照射后,收集细胞(约1×106个),预冷PBS洗3次。按照细胞凋亡检测试剂盒说明书操作,采用Annexin V/PI双染,流式细胞仪检测细胞凋亡。
1.2.7 细胞周期的测定hep-2细胞经siRNA转染,并用0、2、4、6、8 Gy X线照射后,收集细胞(约1×106个),预冷PBS洗3次。70%的冷乙醇4℃固定过夜。按照细胞周期检测试剂盒说明书操作染色,采用流式细胞仪检测细胞周期。
1.2.8 细胞克隆形成实验hep-2细胞经siRNA转染,收集细胞铺到6孔板中,每孔2 000个细胞。每组3孔平行样本。并用0、2、4、6、8 Gy X线照射后,静置于37℃培养箱中培养14天。14天后培养板中出现肉眼可见克隆时,终止培养,用PBS轻轻冲洗2~3遍,1%结晶紫染色20 min,除去染色液,纯水轻轻洗涤2~3遍,晾干,用相机拍照留底,在显微镜下计数克隆个数,≥50个的细胞团作为一个克隆。根据克隆形成计数结果计算每组细胞克隆形成率。
1.3 统计学方法使用SPSS 22.0软件分析数据。以上所有实验至少重复三次,数据结果以(x±s)表示,通过配对样本t检验进行计算分析。P < 0.05为差异有统计学意义。
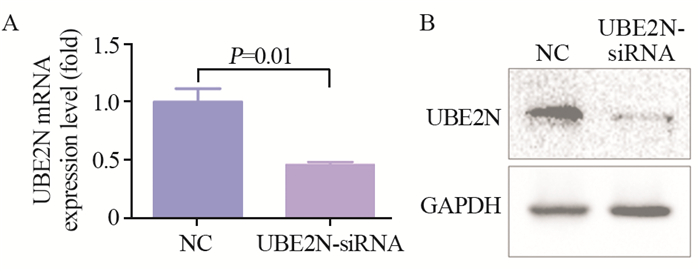
2 结果 2.1 UBE2N siRNA沉默效果检测转染48 h后qPCR检测结果显示:UBE2N-siRNA组UBE2N mRNA表达(0.459±0.044)明显受到抑制,与NC组(1.000)比较,差异有统计学意义(F=0.10, P=0.01),见图 1A。转染72 h后Western blot结果显示:UBE2N siRNA显著抑制了UBE2N蛋白水平,见图 1B。上述结果表明UBE2N siRNA能够有效抑制hep-2细胞UBE2N表达。
|
| 图 1 qPCR和Western blot法检测siRNA沉默UBE2N后UBE2N mRNA(A)和蛋白水平(B) Figure 1 UBE2N mRNA(A) and protein(B) expression detected by qPCR and Western blot after UBE2N siRNA transfection |
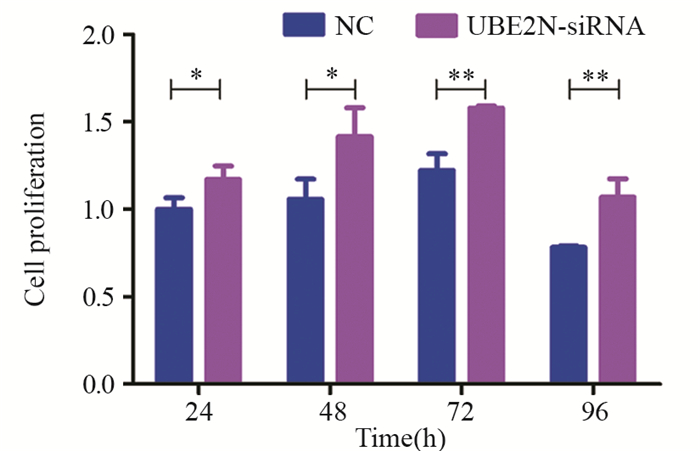
CCK8检测结果显示:经siRNA沉默24 h后, UBE2N-siRNA组和NC组细胞活力指数分别为(0.31±0.02)和(0.26±0.02)(P=0.042);48 h后, 细胞活力指数分别为(0.49±0.10)和(0.29±0.02)(P=0.037);72 h后, 细胞活力指数分别为(0.35±0.00)和(0.23±0.02)(P=0.003);96 h后, 细胞活力指数分别为(0.27±0.03)和(0.20±0.00)(P=0.009)。说明沉默UBE2N显著提高hep-2细胞增殖能力,见图 2。
|
| *: P < 0.05; **: P < 0.01, compared with NC group 图 2 CCK8检测沉默UBE2N后hep-2细胞增殖情况 Figure 2 Effects of UBE2N silence on hep-2 cell proliferation detected by CCK8 assay |
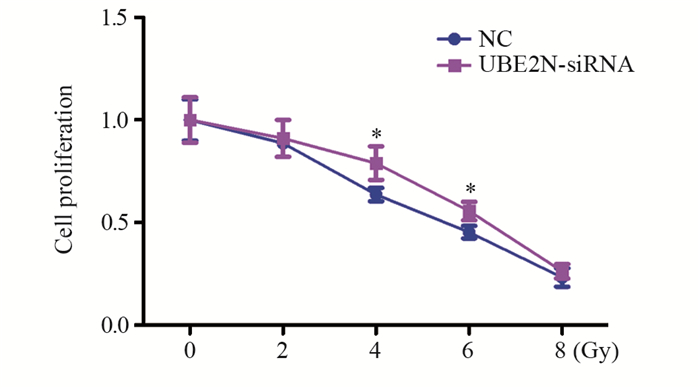
经0、2、4、6、8 Gy射线照射48 h后,CCK8法结果显示:4、6 Gy射线照射后,UBE2N-siRNA组hep-2细胞增殖能力显著高于NC组(F4Gy=0.27, P4Gy=0.04; F6Gy=0.63, P6Gy=0.03),见图 3。提示沉默UBE2N会增强喉鳞癌细胞放射抵抗。
|
| *: P < 0.05, compared with NC group 图 3 CCK8检测沉默UBE2N后hep-2细胞辐射后细胞增殖情况 Figure 3 Effect of UBE2N silence on proliferation of hep-2 cells detected by CCK8 assay after UBE2N siRNA transfection and different doses of irradiation |
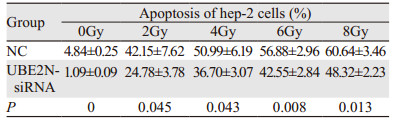
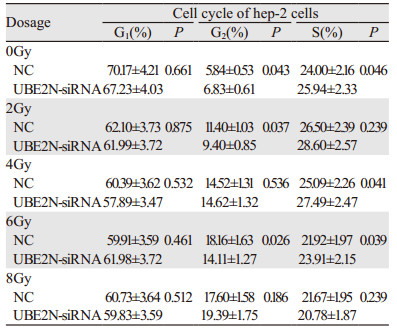
经0、2、4、6、8 Gy射线照射后,NC组和UBE2N-siRNA组G1期细胞比例差异无统计学意义(均P > 0.05);未经射线照射(0 Gy),UBE2N-siRNA组G2期细胞比例明显高于NC组(P=0.043);但经2、6 Gy射线照射后,UBE2N-siRNA组G2期细胞比例明显低于NC组(均P < 0.05);经0、4、6 Gy射线照射后,UBE2N-siRNA组S期细胞比例明显高于NC组(均P < 0.05),见图 4、表 1。结果表明经辐射处理后,沉默UBE2N会促进DNA合成,并部分解除G2阻滞,提示沉默UBE2N会增强喉鳞癌细胞放射抵抗。
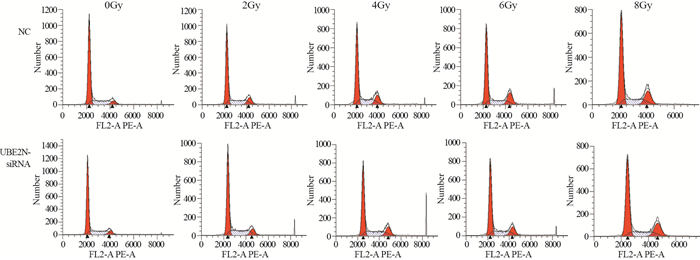
|
| 图 4 流式细胞术检测沉默UBE2N基因对辐射后hep-2细胞周期的影响 Figure 4 Effects of UBE2N silence on cell cycle of hep-2 cells detected by flow cytometry after UBE2N siRNA transfection and different doses of irradiation |
|
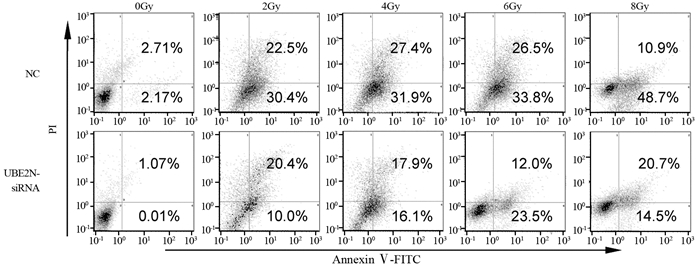
沉默UBE2N并经0、2、4、6、8 Gy射线照射后,Annexin V/PI双染法结果显示:UBE2N干扰组细胞总凋亡率(早期凋亡+晚期凋亡)显著低于NC组(均P < 0.05),见图 5、表 2。结果证明沉默UBE2N降低辐射诱导的喉鳞癌细胞凋亡。
|
| 图 5 流式细胞术检测沉默UBE2N对辐射后hep-2细胞凋亡的影响 Figure 5 Effects of UBE2N silence on apoptosis of hep-2 cells detected by flow cytometry after UBE2N siRNA transfection and different doses of irradiation |
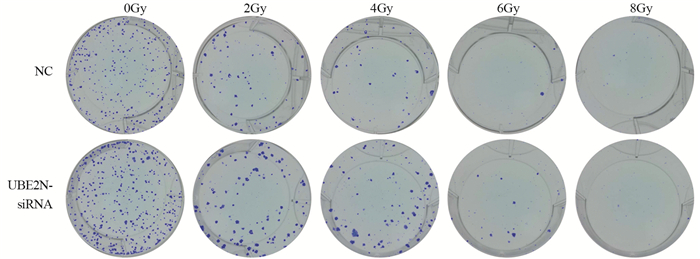
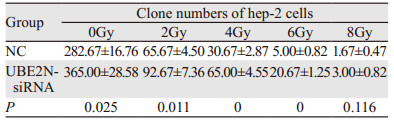
沉默UBE2N并经0、2、4、6 Gy射线照射后,UBE2N-siRNA组细胞克隆形成能力显著强于NC组(均P < 0.05),见图 6、表 3。提示沉默UBE2N会增强喉鳞癌细胞放射抵抗。
|
| 图 6 克隆形成实验检测沉默UBE2N对辐射后hep-2细胞克隆形成能力的影响 Figure 6 Effects of UBE2N silence on clone formation of hep-2 cells detected by clone formation assay after UBE2N siRNA transfection and different doses of irradiation |
|
近年研究显示,泛素交联酶与肿瘤放疗抵抗密切相关。研究发现使用一种特异性抑制小分子抑制剂NSC697923抑制UBE2N后,P53及JNK通路激活,神经母细胞瘤细胞、弥漫性大B淋巴瘤细胞的增殖减慢并促进其凋亡,故而推测UBE2N可能是这两种肿瘤的潜在治疗靶点之一[10-11]。张喜梅等在人喉鳞癌细胞株中发现UBE2N在放疗抵抗株hep-2R中表达明显高于亲本细胞hep-2,提示泛素交联酶UBE2N可能调控肿瘤细胞的放射敏感度[9],但未做相关功能实验进行验证。
细胞周期调控是决定细胞放射敏感度的一个关键因素。辐射诱导DNA损伤,使细胞周期产生阻滞,如G2/M期阻滞[12],为DNA修复提供充足的时间[13]。本研究发现在细胞周期实验中,hep-2细胞转染UBE2N siRNA后,其S期显著延长,而G2期显著缩短,增殖实验也表明沉默UBE2N增强hep-2细胞增殖,因此UBE2N调控细胞增殖和细胞周期可能是调节放射敏感度的重要机制。
细胞凋亡是影响细胞放射敏感度的重要原因,是一种潜在的放疗增敏机制[14-15],辐射可通过多种途径诱导细胞凋亡。本研究通过AnnexinV/PI双染法证实,经X线照射后,转染UBE2N siRNA较转染阴性对照NC的hep-2细胞凋亡比例明显减少。克隆形成率是反映细胞群体依赖性和增殖能力的重要指标。本研究发现经X线照射后,UBE2N沉默组细胞克隆形成率显著升高,提示沉默UBE2N能显著降低喉鳞癌细胞群体依赖性,并增强喉鳞癌细胞增殖能力。
综上所述,UBE2N通过调控细胞增殖、细胞周期进展、细胞克隆形成能力和细胞凋亡来影响喉鳞癌细胞放射抵抗。本研究在细胞水平探讨了UBE2N对人喉鳞癌细胞放射抵抗的影响,但相关动物实验和机制研究并未完成,因此,在体内外探讨UBE2N在人喉鳞癌细胞放射敏感度的机制是我们下一步需要完成的内容,以期为喉鳞癌放疗增敏提供新的可靠靶点。
作者贡献
宫梦晓: 实验的实施及论文写作
邓鑫州、沈力、柯青、吴林: 提供实验技术、写作指导
张梦琳 、刘艳芹: 细胞培养
陈晓琳、邱小燕: 蛋白提取和数据处理
骆志国: 项目支助及实验理论指导,提供实验平台
| [1] | Siegel RL, Miller KD, Jemal A. Cancer statistics, 2019[J]. CA Cancer J Clin, 2019, 69(1): 7–34. DOI:10.3322/caac.v69.1 |
| [2] | 曾晓, 李甸源, 曾艳, 等. 晚期喉癌术后患者行同期放化疗与单纯放疗的临床疗效比较及预后分析[J]. 肿瘤防治研究, 2014, 41(8): 423–425. [ Zeng X, Li DY, Zeng Y, et al. Clinical efficacy and prognosis of concomitant cheno-radiotherapy and simple radiotherapy on patients with advanced laryngeal cancer after lanryngectomy[J]. Zhong Liu Fang Zhi Yan Jiu, 2014, 41(8): 423–425. ] |
| [3] | Han J, Nian H, Zheng ZY, et al. Effects of health education intervention on negative emotion and quality of life of patients withlaryngeal cancerafter postoperativeradiotherapy[J]. Cancer Radiother, 2018, 22(1): 1–8. |
| [4] | 喻而.晚期喉癌复发因素探讨及肿瘤干细胞在喉癌放疗抵抗中的作用机制研究[D].杭州: 浙江大学, 2017. [ Yu E. Clinical analysis of risk factors for recurrence and study of cancer stem cells in the mechanism of radioresistance on laryngeal squamous cell carcinoma[D]. Hangzhou: Zhejiang University, 2017. ] http://cdmd.cnki.com.cn/Article/CDMD-10335-1017122199.htm |
| [5] | Brzovic PS, Klevit RE. Ubiquitin transfer from the E2 perspective: why is UbcH5 so promiscuous?[J]. Cell Cycle, 2006, 5(24): 2867–2873. DOI:10.4161/cc.5.24.3592 |
| [6] | Wagner SA, Beli P, Weinert BT, et al. A proteome-wide, quantitative survey of in vivo ubiquitylation sites reveals widespread regulatory roles[J]. Mol Cell Proteomics, 2011, 10(10): M111.013284. DOI:10.1074/mcp.M111.013284 |
| [7] | Bonanno L, Costa C, Majem M, et al. The predictive value of 53BP1 and BRCA1 mRNA expression in advanced non-small-cell lung cancer patients treated with first-line platinum-based chemotherapy[J]. Oncotarget, 2013, 4(10): 1572–1581. |
| [8] | Ulrich HD, Walden H. Ubiquitin signalling in DNA replication and repair[J]. Nat Rev Mol Cell Biol, 2010, 11(7): 479–489. DOI:10.1038/nrm2921 |
| [9] | 张喜梅, 周福祥, 周云峰, 等. 辐射诱导放射抵抗鳞癌细胞株的蛋白质组学差异分析[J]. 中华放射医学与防护杂志, 2011, 31(5): 548–551. [ Zhang XM, Zhou FX, Zhou YF, et al. Proteomic difference analysis of radiation-induced radiation-resistant squamous cell carcinoma cell lines[J]. Zhonghua Fang She Yi Xue Yu Fang Hu Za Zhi, 2011, 31(5): 548–551. DOI:10.3760/cma.j.issn.0254-5098.2011.05.010 ] |
| [10] | Cheng J, Fan YH, Xu X, et al. A small-molecule inhibitor of UBE2N induces neuroblastoma cell death via activation of p53 and JNK pathways[J]. Cell Death Dis, 2014, 5: e1079. DOI:10.1038/cddis.2014.54 |
| [11] | Pulvino M, Liang Y, Oleksyn D, et al. Inhibition of proliferation and survival of diffuse large B-cell lymphoma cells by a small-molecule inhibitor of the ubiquitin-conjugating enzyme Ubc13-Uev1A[J]. Blood, 2012, 120(8): 1668–1677. DOI:10.1182/blood-2012-02-406074 |
| [12] | 张美婷, 山顺林, 耿炜. 癌细胞放射抵抗性机制的研究进展[J]. 东南大学学报(医学版), 2017, 36(1): 116–119. [ Zhang MT, Shan SL, Geng W. Advances in research on radioresistance mechanism of cancer cells[J]. Dong Nan Da Xue Xue Bao (Yi Xue Ban), 2017, 36(1): 116–119. DOI:10.3969/j.issn.1671-6264.2017.01.030 ] |
| [13] | Kong Z, Xie D, Boike T, et al. Downregulation of human DAB2IP gene expression in prostate cancer cells results in resistance to ionizing radiation[J]. Cancer Res, 2010, 70(7): 2829–2839. DOI:10.1158/0008-5472.CAN-09-2919 |
| [14] | 陈瑶, 李思维. 鼻咽癌放疗敏感性的研究进展[J]. 华夏医学, 2017, 30(1): 167–171. [ Chen Y, Li SW. Advances in radiotherapy sensitivity of nasopharyngeal carcinoma[J]. Huaxia Yi Xue, 2017, 30(1): 167–171. ] |
| [15] | Li L, Dong X, Peng F, et al. Integrin β1 regulates the invasion and radioresistance of laryngeal cancer cells by targeting CD147[J]. Cancer Cell Int, 2018, 18: 80. DOI:10.1186/s12935-018-0578-z |
 2019, Vol. 46
2019, Vol. 46