文章信息
- 甲状腺未分化癌88例治疗及预后分析
- Treatment and Prognosis of Anaplastic Thyroid Carcinoma: A Clinical Study of 88 Cases
- 肿瘤防治研究, 2019, 46(5): 431-435
- Cancer Research on Prevention and Treatment, 2019, 46(5): 431-435
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.18.1639
- 收稿日期: 2018-11-05
- 修回日期: 2019-03-05
甲状腺未分化癌(anaplastic thyroid carcinoma, ATC)发病率低,仅占甲状腺恶性肿瘤的2%~5%,但其死亡率却高达15%~50%,是甲状腺癌中恶性程度最高的一种肿瘤[1-2]。该病好发于60~80岁老年女性,男女比例1:2.3,多数患者就诊时表现为颈部突然增大的肿块、呼吸困难、吞咽困难、声音嘶哑及远处转移,中位生存期3~9月,1年生存率仅占20%[3]。目前ATC的治疗方式主要有手术、放疗、化疗、靶向、综合治疗,虽然有临床研究表明综合治疗可以控制局部复发,提高生存率,但临床样本量少,多为单中心回顾性研究,仍缺乏规范统一的治疗模式。本研究回顾性分析了88例ATC患者的临床资料,旨在了解ATC的临床特征、预后因素及选择合适的治疗方案。
1 资料与方法 1.1 临床资料本研究经天津医科大学肿瘤医院伦理委员会批准,所有患者均知情同意。收集2003年1月—2016年5月在天津医科大学肿瘤医院诊治的88例患者。所有患者的病理资料均经病理学专家确诊。其中男37例、女51例,男女之比1:1.38,年龄17~89岁,平均年龄61岁,中位年龄63岁。
1.2 临床表现患者主要症状为偶然发现的颈部肿块、颈部肿块持续数年突然增大、声音嘶哑、呼吸困难、吞咽困难、颈部疼痛。既往甲状腺乳头癌病史者占2.3%(2/88);首诊发现远处转移者占28.4%(25/88),最常见肺转移20例,其次骨转移4例、皮肤转移4例、胸膜转移1例、眼眶转移1例,其中肺合并骨转移3例、合并皮肤转移2例,合并其他转移部位可见脑、肝脏、胰腺。
1.3 随访方式采用门诊或电话方式对患者进行随访,随访时间截至2018年6月。生存期即自确诊之日至末次随访日或死亡时间。随访结束时全部患者已死亡。
1.4 治疗与分组88例患者接受了不同治疗方案,5例因晚期疾病阶段或其他问题拒绝接受手术、放疗、化疗等任何治疗方案,仅行穿刺活检明确病理诊断(本研究中只做气管切开术和(或)组织活检不被视为手术)。治疗方式可分为三组,第一组接受术后放疗和(或)化疗的综合治疗模式(35例):术后放疗(12例)、术后放化疗(18例)、术后化疗(5例);第二组仅行手术切除(44例);第三组非手术组(4例):单独化疗(1例)、单独放疗(1例)、放化疗(2例)。手术方式可分为两类,第一类仅原发灶切除,如肿物扩大切除、腺叶切除、全甲状腺切除及周围组织广泛切除等(45例);第二类甲状腺癌根治术,即甲状腺切除术并淋巴结清扫,如根治性颈淋巴结清扫、选择性颈淋巴结清扫(34例)。有关肿瘤切除边缘的数据无法获得,难以确定这些手术是否为R0(无残留肿瘤),R1(微观残留肿瘤)或R2(肉眼可见的残留肿瘤)。放疗剂量≥40 Gy为足量放疗(22例);未经治疗及放疗剂量 < 40 Gy为不足量放疗(66例)。接受化疗(26例),化疗方案包括表柔吡星和铂类、紫杉醇和铂类、环磷酰胺+铂类、单药多西他赛等,化疗周期2~8周期。
1.5 统计学方法采用SPSS17.0软件进行分析。生存率的分析采用Kaplan-Meier法进行Log rank生存分布检验。对于单因素分析有意义的变量引入Cox回归模型从而排除变量之间的干扰因素,确立影响预后的独立因素。P < 0.05为差异有统计学意义。
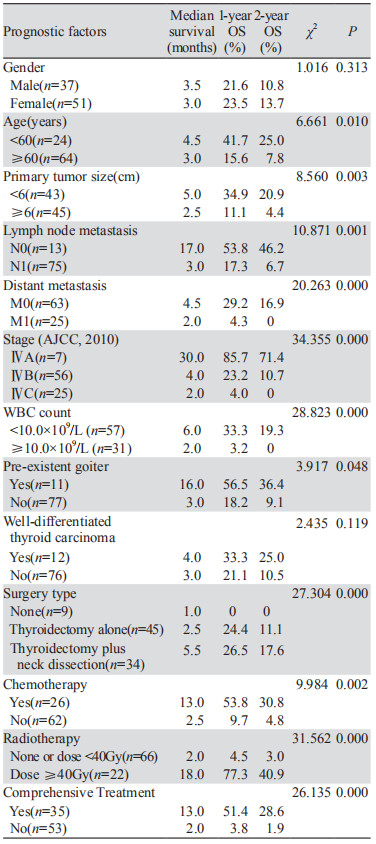
2 结果 2.1 随访结果治疗期间有2例患者由于颈部肿块压迫呼吸道,呼吸衰竭死亡;其余患者在随访期间全部死亡,其中27例患者死于肿瘤远处转移(2例患者随访中发现)、59例患者来自局部疾病进展,随访至2018年5月,没有患者在此项研究中失访。88例患者中位生存时间为3.5月;6月生存率30.7%,1年生存率为22.7%,2年生存率为11.4%,见表 1。
|
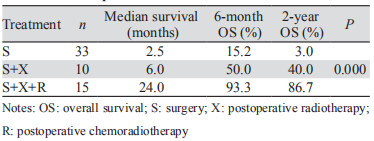
肿物最大径、年龄、远处转移、淋巴结转移、分期、白细胞数、放疗、化疗、甲状腺结节、不同手术方式、综合治疗是影响甲状腺未分化癌患者预后的因素,而患者性别、是否合并分化型甲状腺癌成分与预后无关,综合治疗在本次研究中具体定义为术后联合放疗和(或)化疗,见表 1。ⅣA和ⅣB期患者共63例,其中58例ⅣA和ⅣB期患者分为三组:单纯手术组(n=33)、术后放疗组(n=10)和术后放化疗组(n=15);5例患者被排除本研究,分别为术后化疗组(n=2)、单纯化疗组(n=1)和未治疗组(n=2)。研究表明放化疗组患者预后较好(P < 0.050),见表 2。
|
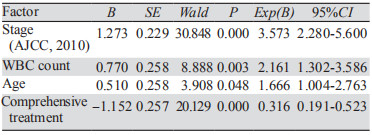
将单因素分析有意义的指标引入Cox回归模型,发现年龄 < 60岁、分期早、白细胞数 < 10.0×109/L、接受综合治疗(P < 0.05)是决定甲状腺未分化癌预后较好的独立因素,见表 3、图 1。
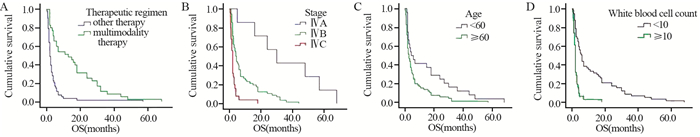
|
| 图 1 不同治疗方式(A)、临床分期(B)、年龄(C)和白细胞数量(D)的甲状腺未分化癌患者生存曲线 Figure 1 Survival curves of anaplastic thyroid carcinoma (ATC) patients with different therapies(A), clinical stages(B), ages(C) and WBC counts(D) |
本研究中有17例患者的病理切片进行了免疫组织化学染色,由于各个患者检查指标并不完全相同,未作统计分析,该结果详见表 4。
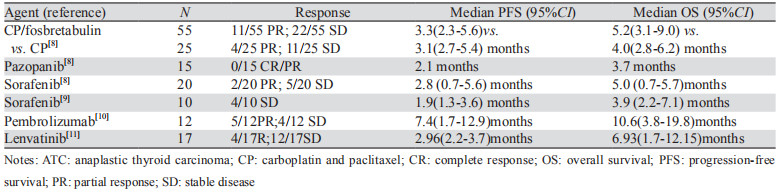
结合本研究的免疫组织化学结果及相关文献报道,目前已经了解到ATC发生过程中一些基因和信号通路发生了改变,如P53基因家族,RAS,BRAF、MAPK途径[4-7]。通过PubMed数据库检索到一些分子靶向药物如多靶点激酶抑制剂、血管生成抑制剂和免疫抑制剂正用于ATC的Ⅱ期临床试验,虽然目前药物试验均未显示完全缓解,但部分患者取得PR或SD,并且毒性耐受性良好,见表 5[8-11]。美国FDA已批准达拉非尼联合曲美替尼治疗无法手术切除的BRAFV600E突变阳性的甲状腺未分化癌。
本研究中,患者的男女比例为1:1.38,平均年龄61岁,超过三分之一的患者年龄大于70岁,是影响预后的独立危险因素。有文献报道甲状腺未分化癌大多发生在70~80岁的老年人,女性多于男性,年龄≥55岁是预后不良的独立危险因素[3, 12-13]。
ATC恶性程度高,侵袭能力强,常伴有淋巴结转移,侵入邻近组织引起相应的临床症状。大约40%的患者有远处转移,是预后不良的独立因素,其中肺部转移占80%[2],本研究首诊远处转移占28.4%,低于文献报道可能与之前影像学检查尚不完善、未能及时发现小的转移灶相关。根据UICC和AJCC分期标准,所有的ATC一经确诊均属于Ⅳ期,不论原发灶大小、淋巴结转移情况[14],肿瘤分期经多因素分析是影响预后的独立因素,国外有研究发现伴有淋巴结转移患者预后更差[15]。根据常见临床症状筛选出高危患者,通过病理学明确诊断从而早期治疗尤为重要。
手术切除是ⅣA、ⅣB期可切除患者治疗的基石,术后淋巴结清扫组较单纯甲状腺切除预后较好,可能与本研究中淋巴结转移患者所占比例较大相关,大多文献报道手术切缘R0、R1较R2可明显提高生存期[14, 16-17],本研究由于数据缺乏未作统计分析。与国外研究相一致,术后辅助放化疗并且放射剂量 > 40 Gy为重要的预后因素[2-3, 13, 16-18]。化疗是否可以延长患者生存期、改善预后仍然存在争议[19-20]。ATC病情发展迅速并且患者多为合并其他基础疾病的老年人,身体状况差,常不能耐受化疗药物的毒性作用,因此根据患者身体状况制定合适的化疗方案尤为重要。
与本研究相一致的是国外动物实验模型及临床病理统计分析表明ATC发生可能与甲状腺结节及分化型甲状腺癌相关,其中P53基因家族、调控细胞周期基因家族等参与了去分化及间质转化过程,但预后与二者无相关性[8, 21-25]。肿瘤细胞增殖活跃分泌集落刺激因子、白介素等细胞因子促进白细胞生长,并且其计数≥10.0×109/L是影响预后独立危险因素,其他研究结果也证明了这个观点[3]。
虽然综合治疗模式提高了部分生存率,但总体预后仍较差,5年生存率仅为3%~10%。综上所述:对ATC患者我们得出以下结论:(1)年龄≥60岁、分期晚、白细胞计数≥10.0×109/L是预后不良的独立因素;(2)当对于ⅣA、ⅣB期患者建议手术联合放化疗的综合治疗(放疗剂量≥40 Gy,手术应尽可能做到R0切除);(3)对于丧失手术机会或有手术禁忌证的患者建议放疗和(或)化疗;(4)甲状腺结节和分化型甲状腺癌可转化成未分化癌,需要更多的临床、基础研究明确转化机制,筛选特定靶点,从而通过特定靶向药物改善预后。本研究为回顾性研究且样本量较小,更需前瞻性和多中心大样本资料为ATC的规范治疗进一步提供证据。
作者贡献
刘敬敬: 病例查阅、数据收集、统计分析及文章撰写
曹水: 课题设计、文章修改
| [1] | Wendler J, Kroiss M, Gast K, et al. Clinical presentation, treatment and outcome of anaplastic thyroid carcinoma: results of a multicenter study in Germany[J]. Eur J Endocrinol, 2016, 175(6): 521–9. DOI:10.1530/EJE-16-0574 |
| [2] | Derbel O, Limem S, Ségura-Ferlay C, et al. Results of combined treatment of anaplastic thyroid carcinoma (ATC)[J]. BMC Cancer, 2011, 11: 469. DOI:10.1186/1471-2407-11-469 |
| [3] | Sun C, Li Q, Hu Z, et al. Treatment and prognosis of anaplastic thyroid carcinoma: experience from a single institution in China[J]. PLoS One, 2013, 8(11): e80011. DOI:10.1371/journal.pone.0080011 |
| [4] | Latteyer S, Tiedje V, König K, et al. Targeted next-generation sequencing for TP53, RAS, BRAF, ALK and NF1 mutations in anaplastic thyroid cancer[J]. Endocrine, 2016, 54(3): 733–41. DOI:10.1007/s12020-016-1080-9 |
| [5] | Tiedje V, Ting S, Herold T, et al. NGS based identification of mutational hotspots for targeted therapy in anaplastic thyroid carcinoma[J]. Oncotarget, 2017, 8(26): 42613–20. |
| [6] | Wagle N, Grabiner BC, Van Allen EM, et al. Response and acquired resistance to everolimus in anaplastic thyroid cancer[J]. N Engl J Med, 2014, 371(15): 1426–33. DOI:10.1056/NEJMoa1403352 |
| [7] | Nakazawa T, Kondo T, Vuong HG, et al. High expression of CD10 in anaplastic thyroid carcinomas[J]. Histopathology, 2018, 73(3): 492–9. DOI:10.1111/his.2018.73.issue-3 |
| [8] | Steggink LC, van Dijk BA, Links TP, et al. Survival in anaplastic thyroid cancer in relation to pre-existing goiter: a population-based study[J]. Am J Surg, 2015, 209(6): 1013–9. DOI:10.1016/j.amjsurg.2014.06.027 |
| [9] | Ito Y, Onoda N, Ito KI, et al. Sorafenib in Japanese Patients with Locally Advanced or Metastatic Medullary Thyroid Carcinoma and Anaplastic Thyroid Carcinoma[J]. Thyroid, 2017, 27(9): 1142–8. DOI:10.1089/thy.2016.0621 |
| [10] | Iyer PC, Dadu R, Gule-Monroe M, et al. Salvage pembrolizumab added to kinase inhibitor therapy for the treatment of anaplastic thyroid carcinoma[J]. J Immunother Cancer, 2018, 6(1): 68. DOI:10.1186/s40425-018-0378-y |
| [11] | Tiedje V, Stuschke M, Weber F, et al. Anaplastic thyroid carcinoma: review of treatment protocols[J]. Endocr Relat Cancer, 2018, 25(3): R153-61. |
| [12] | Sugitani I, Kasai N, Fujimoto Y, et al. Prognostic factors and therapeutic strategy for anaplastic carcinoma of the thyroid[J]. World J Surg, 2001, 25(5): 617–22. DOI:10.1007/s002680020166 |
| [13] | Liu TR, Xiao ZW, Xu HN, et al. Treatment and Prognosis of Anaplastic Thyroid Carcinoma: A Clinical Study of 50 Cases[J]. PLoS One, 2016, 11(10): e0164840. DOI:10.1371/journal.pone.0164840 |
| [14] | Goffredo P, Thomas SM, Adam MA, et al. Impact of Timeliness of Resection and Thyroidectomy Margin Status on Survival for Patients with Anaplastic Thyroid Cancer: An Analysis of 335 Cases[J]. Ann Surg Oncol, 2015, 22(13): 4166–74. DOI:10.1245/s10434-015-4742-6 |
| [15] | Dumke AK, Pelz T, Vordermark D. Long-term results of radiotherapy in anaplastic thyroid cancer[J]. Radiat Oncol, 2014, 9(1): 90. DOI:10.1186/1748-717X-9-90 |
| [16] | Swaak-Kragten AT, de Wilt JH, Schmitz PI, et al. Multimodality treatment for anaplastic thyroid carcinoma--treatment outcome in 75 patients[J]. Radiother Oncol, 2009, 92(1): 100–4. DOI:10.1016/j.radonc.2009.02.016 |
| [17] | Baek SK, Lee MC, Hah JH, et al. Role of surgery in the management of anaplastic thyroid carcinoma: Korean nationwide multicenter study of 329 patients with anaplastic thyroid carcinoma, 2000 to 2012[J]. Head Neck, 2017, 39(1): 133–9. DOI:10.1002/hed.v39.1 |
| [18] | Käsmann L, Bolm L, Janssen S, et al. Prognostic Factors for Survival in Patients Treated with Multimodal Therapy for Anaplastic Thyroid Cancer[J]. Anticancer Res, 2016, 36(9): 4697–700. DOI:10.21873/anticanres |
| [19] | Seto A, Sugitani I, Toda K, et al. Chemotherapy for anaplastic thyroid cancer using docetaxel and cisplatin: report of eight cases[J]. Surg Today, 2013, [Epub ahead of print]. |
| [20] | Siironen P, Hagström J, Mäenpää HO, et al. Anaplastic and poorly differentiated thyroid carcinoma: therapeutic strategies and treatment outcome of 52 consecutive patients[J]. Oncology, 2010, 79(5-6): 400–8. DOI:10.1159/000322640 |
| [21] | Aghajanzadeh M, Asgary MR, Mohammadi F, et al. An investigation into symptoms, diagnosis, treatment, and treatment complications in patients with retrosternal goiter[J]. J Family Med Prim Care, 2018, 7(1): 224–9. DOI:10.4103/jfmpc.jfmpc_286_17 |
| [22] | Haigh PI, Ituarte PH, Wu HS, et al. Completely resected anaplastic thyroid carcinoma combined with adjuvant chemotherapy and irradiation is associated with prolonged survival[J]. Cancer, 2001, 91(12): 2335–42. DOI:10.1002/(ISSN)1097-0142 |
| [23] | Manzella L, Stella S, Pennisi MS, et al. New Insights in Thyroid Cancer and p53 Family Proteins[J]. Int J Mol Sci, 2017, 18(6). Pii: E1325. |
| [24] | Li L, Wang X, Sharvan R, et al. Berberine could inhibit thyroid carcinoma cells by inducing mitochondrial apoptosis, G0/G1 cell cycle arrest and suppressing migration via PI3K-AKT and MAPK signaling pathways[J]. Biomed Pharmacother, 2017, 95: 1225–31. DOI:10.1016/j.biopha.2017.09.010 |
| [25] | Bishop JA, Sharma R, Westra WH. PAX8 immunostaining of anaplastic thyroid carcinoma: a reliable means of discerning thyroid origin for undifferentiated tumors of the head and neck[J]. Hum Pathol, 2011, 42(12): 1873–7. DOI:10.1016/j.humpath.2011.02.004 |
 2019, Vol. 46
2019, Vol. 46