文章信息
- miR-144对胰腺癌SW1990细胞增殖、迁移、侵袭及PI3K通路的影响
- Effects of miR-144 on Proliferation, Migration, Invasion and PI3K Pathway of Pancreatic Cancer SW1990 Cells
- 肿瘤防治研究, 2019, 46(10): 879-883
- Cancer Research on Prevention and Treatment, 2019, 46(10): 879-883
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.18.1524
- 收稿日期: 2019-04-02
- 修回日期: 2019-07-15
胰腺癌是一种恶性程度较高且预后较差的实体瘤,其具有较强的侵袭能力,患者确诊时已发生远处转移从而导致患者死亡率逐年升高[1]。探讨胰腺癌发生、发展、侵袭及转移机制对早期诊断及治疗均具有重要意义。随着生物信息技术发展,研究发现微小RNA(microRNA, miRNA)可通过调控靶基因表达进而参与基因转录后表达过程,其中部分miRNA还可通过抑制靶基因表达进而参与多种恶性肿瘤发生、发展、侵袭及转移等过程[2]。相关研究表明微小RNA-144(miRNA-144, miR-144)在乳腺癌组织及细胞中均呈低表达,其可通过负向调控靶基因CEP55表达进而抑制乳腺癌细胞增殖、侵袭及迁移[3]。同时研究发现磷脂酰肌醇-3激酶/丝氨酸-苏氨酸蛋白激酶(phosphoinositide-3kinase/protein kinase B, PI3K/Akt)信号通路激活后可增强胰腺癌细胞增殖及侵袭能力[4]。关于miR-144在胰腺癌中表达及其潜在作用机制的研究鲜见报道,因此本研究初步探讨miR-144对胰腺癌SW1990细胞的增殖、迁移及侵袭的影响,并分析其对PI3K/Akt信号通路的影响,旨在为揭示胰腺癌发病机制提供理论依据。
1 材料与方法 1.1 实验细胞人正常胰腺上皮细胞系HPDE、胰腺癌细胞系SW1990均购于中国上海中科院细胞库,将其冻存于-80℃冰箱。
1.2 主要试剂及仪器DMEM培养基购自赛默飞世尔科技(中国)有限公司;Lipofectamine 2000转染试剂购自美国Invitrogen公司;鼠抗人PI3K、p-PI3K、Akt和磷酸化蛋白(phospho-protein kinase, p-Akt)多克隆抗体均选购自美国R & D公司;RNA提取试剂盒、RT-qPCR检测试剂盒购自宝日医生物技术(北京)有限公司;蛋白提取试剂盒购自美国Thermo Fisher Scientific公司;荧光定量PCR仪器购自德国Eppendorf公司;蛋白凝胶成像仪购自美国Bio-Red公司。
1.3 方法 1.3.1 细胞培养取出冻存的HPDE和SW1990细胞,将其进行水浴(37℃),离心后弃上清液,加入含10%胎牛血清的DMEM培养基中,置于培养箱中培养(37℃、5%CO2),细胞生长至80%时弃培养基,PBS清洗,0.2%胰酶消化5 min,细胞培养至第3代时可用于后续研究。
1.3.2 细胞转染及分组取对数期细胞,转染前1 h将培养液替换为Opti-MEM减血清培养基,参照Lipofectamine 2000转染试剂盒进行转染,将miR-144阴性对照质粒、miR-144 mimic质粒分别转染至SW1990细胞,其中miR-144阴性对照质粒、miR-144 mimic质粒均由生工生物工程(上海)股份有限公司设计合成,分别命名为阴性转染组、miR-144过表达组,未经处理的细胞命名为空白对照组,转染后将其置于培养箱中(37℃、5%CO2)培养48 h,收集细胞上清液待测。
1.3.3 RT-qPCR检测miR-144表达水平按照RNA试剂盒说明书提取细胞总RNA,参照反转录试剂盒反转录为cDNA。采用RT-qPCR试剂盒进行实时荧光定量反应。反应体系为20 μl: SYBR Premix 10 μl,cDNA 1 μl,H2O 8 μl,上下游引物各0.5 μl。反应程序:95℃ 20 s,95℃ 10 s,60℃ 20 s,72℃ 10 s,共40个循环。miR-144以U6作为内参基因,采用2-ΔΔCt法计算miR-144的相对表达量。
1.3.4 CCK-8法检测细胞增殖情况转染后培养48 h收集细胞,将其接种至细胞培养板,分别在12、24、48和72 h加入CCK-8试剂,继续培养2 h后,收集细胞,使用全自动酶标仪检测450 nm波长下各孔细胞吸光度值(OD)。细胞增殖率=OD实验组均值/OD空白组均值×100%。
1.3.5 平板细胞克隆形成实验检测菌落形成收集转染后培养48 h的对数期细胞并将其接种于96孔板中,孵育24 h(37℃、5%CO2),PBS清洗,加入4%甲醛(甲硫醇:冰醋酸=7:1)固定15 min,采用含0.1%结晶紫溶液染色30 min,水洗干燥后拍照计数克隆形成个数。
1.3.6 Transwell检测细胞迁移能力转染后细胞饥饿培养24 h,制备单细胞悬浮液,细胞密度调整为5×104个/毫升,在Transwell小室上室内加入200 μl单细胞悬浮液(1×104个/孔),下室添加500 μl胎牛血清培养基,培养24 h后取出小室,用棉签清理未迁移细胞并利用多聚甲醛固定,采用吉姆萨法染色15 min,随机选取5个视野在显微镜下进行计数并计算平均值。
1.3.7 Transwell检测细胞侵袭能力细胞转染后继续培养48 h后制备单细胞悬浮液,细胞密度调整为5×104个/毫升,在小室上室内(已被Matrigel基质胶包被)加入200 μl细胞悬液(细胞数为1×104个/孔),下室中加入500 μl胎牛血清培养基,培养24 h,PBS清洗,加入多聚甲醛固定30 min,结晶紫溶液染色2 h,PBS清洗后在光学显微镜下计算穿膜细胞数量。
1.3.8 Western blot法检测PI3K、p-PI3K、Akt、p-Akt蛋白表达水平采用RIPA裂解液裂解细胞并提取细胞总蛋白质,采用12%SDS-PAGE电泳分离等量蛋白,将其转移至PVDF膜,封闭后分别加入PI3K、p-PI3K、Akt、p-Akt一抗(1:500),4℃孵育,次日分别加入二抗(1:5000),室温孵育1 h,均以β-actin为内参,ECL发光试剂显影,采用Quantity One软件评估PI3K、Akt、p-Akt蛋白相对表达水平。
1.4 统计学方法采用SPSS17.0统计软件对数据进行分析,计量资料符合正态分布的数据均以均数±标准差(x±s)表示,多组间比较采用方差分析,两组间比较采用t检验,各组数据均以P < 0.05为差异有统计学意义。
2 结果 2.1 HPDE、SW1990细胞系中miR-144及转染后miR-144的表达水平与HPDE细胞(1.04±0.17)相比,SW1990细胞(0.48±0.08)中miR-144的表达水平显著降低(t=7.301, P=0.0001)。与空白对照组(0.98±0.16)、阴性转染组(1.01±0.17)相比,miR-144过表达组(3.92±0.65)中miR-144表达水平显著升高(F=107.626, P=0.0001)。
2.2 细胞增殖情况随着细胞培养时间延长,miR-144过表达组细胞增殖率逐渐降低,同一时间内miR-144过表达组细胞增殖率均显著低于空白对照组、阴性转染组(P < 0.05),见表 1。
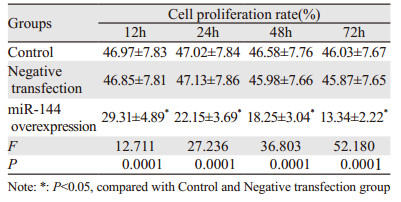
|
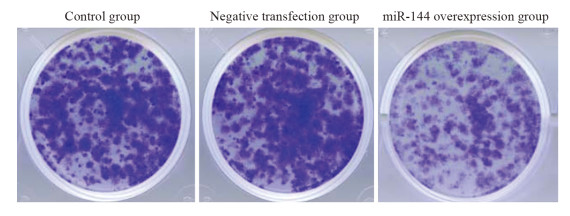
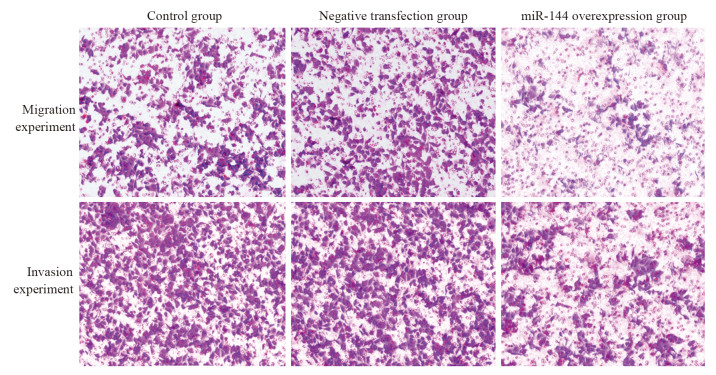
与空白对照组、阴性转染组相比,miR-144过表达组细胞菌落、迁移、侵袭数量均显著降低(均P < 0.05),见图 1~2、表 2。
|
| 图 1 过表达miR-144后细胞菌落形成情况 Figure 1 Cell colony formation after miR-144 was overexpressed |
|
| 图 2 过表达miR-144后细胞迁移、侵袭情况(×100) Figure 2 Cell migration and invasion after miR-144 was overexpressed (×100) |
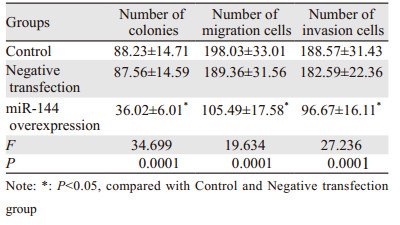
|
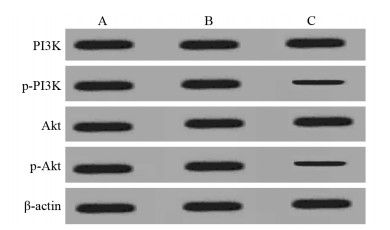
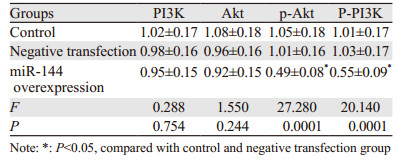
与空白对照组、阴性转染组相比,miR-144过表达组p-PI3K、p-Akt蛋白表达水平均显著降低(均P < 0.05),见图 3、表 3。
|
| A: Control group; B: Negative transfection group; C: miR-144 overexpression group 图 3 过表达miR-144后PI3K、Akt、p-Akt蛋白表达情况 Figure 3 Expression of PI3K, Akt and p-Akt proteins in SW1990 cells with miR-144 overexpression |
|
胰腺癌患者发病初期临床症状不明显,大部分患者确诊时已处于胰腺癌晚期并导致手术治疗失败率增加[5]。由于胰腺癌早期易发生远处侵袭及转移导致患者预后较差,故而从分子水平揭示其侵袭转移机制具有重要意义[6]。研究表明部分miRNA可在胰腺癌组织中呈高表达,并可促进胰腺癌细胞侵袭及转移能力[7-8]。另有研究表明PI3K/Akt信号通路与癌细胞增殖、迁移及侵袭有关,抑制PI3K/Akt信号通路可有效抑制癌细胞增殖并促使其细胞周期发生阻滞从而促进癌细胞凋亡[9]。因此,本研究主要分析miR-144对胰腺癌细胞的增殖、迁移及侵袭能力的影响,同时研究miR-144对PI3K通路的作用及其影响。
miR-144可通过下调靶基因TIGAR表达进而抑制肺癌细胞增殖,还可通过影响Wnt等信号通路对肺鳞癌发生及发展发挥调控作用[10-11]。Ren等研究表明miR-144在胃癌中呈低表达,同时其可促使靶基因RLIP76表达水平降低进而发挥抑癌基因作用[12]。Han等研究发现miR-144可通过调控CXC趋化因子配体11表达进而参与结直肠癌发生及发展过程[13]。关于miR-144在胰腺癌中的表达研究尚未见报道,本研究结果显示SW1990细胞系中miR-144表达水平显著低于HPDE细胞系,说明胰腺癌细胞中miR-144呈低表达,提示miR-144在胰腺癌发生及发展中可能发挥抑癌基因作用。另有研究显示miR-144过表达后可通过抑制靶基因RUX1表达进而抑制卵巢癌细胞增殖及迁移[14]。胃癌组织及细胞中miR-144过表达时可通过靶基因环氧合酶-2表达水平进而抑制胃癌细胞增殖及迁移并诱导癌细胞凋亡[15]。本研究结果显示胰腺癌细胞SW1990中miR-144过表达组miR-144表达水平显著高于空白对照组、阴性转染组,且miR-144过表达组细胞增殖率显著低于空白对照组、阴性转染组,此外,miR-144过表达组细胞菌落、迁移、侵袭数量均显著低于空白对照组、阴性转染组,说明胰腺癌细胞SW1990中miR-144过表达后,细胞增殖、迁移及侵袭能力显著降低,提示miR-144可抑制胰腺癌细胞增殖、迁移及侵袭。
肿瘤迁移及侵袭与血管内皮生长因子(VEGF)密切相关,研究表明PI3K/Akt通路激活后可导致内皮细胞及癌细胞中VEGF水平显著增加,可通过抑制VEGF表达并影响PI3K/Akt信号通路进而抑制癌细胞发生、发展及转移[16-17]。相关研究表明上调血管内皮生长因子C(VEGFC)与血管内皮生长因子A(VEGFA)可激活PI3K/Akt通路进而促进癌细胞侵袭、迁移[18-19]。Tao等研究发现miR-144可通过调控靶基因VEGFC及VEGFA表达进而抑制宫颈癌细胞增殖及迁移[20]。以上研究结果提示胰腺癌细胞中miR-144表达对PI3K/Akt信号通路具有一定影响。本研究结果显示miR-144过表达组p-PI3K、p-Akt蛋白表达水平均显著低于空白对照组、阴性转染组,说明胰腺癌SW1990细胞中miR-144可影响p-PI3K、p-Akt蛋白表达,提示miR-144表达可影响胰腺癌PI3K/Akt信号通路,其可能作用机制为miR-144通过负向调控靶基因VEGFC、VEGFA表达并影响PI3K/Akt信号通路进而抑制胰腺癌细胞增殖、迁移及侵袭。
综上,miR-144在胰腺癌SW1990细胞中呈低表达,其可能通过影响PI3K/Akt信号通路进而影响胰腺癌细胞增殖、迁移及侵袭,为胰腺癌的治疗提供新方向。本研究存在不足之处,关于胰腺癌中miR-144与PI3K/Akt信号通路的具体作用机制及其他通路相关蛋白的具体调控过程,需深入研究进行验证。
作者贡献
王开琼:文章的构思与设计;实验的实施与可行性分析;数据结果的分析与解释;文章的撰写、修订及监督管理
邢贻雷:数据的结果分析与解释
乔欣:数据收集、整理与分析及对论文的修订
李仕总、宫东伟、余智威:协助论文的撰写
吴奕强:实验的实施与可行性分析、文章质量的控制及 审校
| [1] | 张亚娜, 马望, 王峰, 等. 二甲双胍对胰腺癌和胰腺癌干细胞中ALDH1表达的作用[J]. 肿瘤防治研究, 2017, 44(3): 177–183. [ Zhang YN, Ma W, Wang F, et al. Effects of metformin on ALDH1 expression in pancreatic cancer and pancreatic cancer stem cells[J]. Zhong Liu Fang Zhi Yan Jiu, 2017, 44(3): 177–183. DOI:10.3971/j.issn.1000-8578.2017.03.005 ] |
| [2] | 邓小斌, 孙圣荣. MicroRNA-221在恶性肿瘤中的研究进展[J]. 武汉大学学报(医学版), 2016, 37(6): 925–928. [ Deng XB, Sun SR. Research progress of miRNA-221 in malignant tumors[J]. Wuhan Da Xue Xue Bao(Yi Xue Ban), 2016, 37(6): 925–928. ] |
| [3] | Yin Y, Cai J, Meng F, et al. MiR-144 suppresses proliferation, invasion, and migration of breast cancer cells through inhibiting CEP55[J]. Cancer Biol Ther, 2018, 19(4): 306–315. DOI:10.1080/15384047.2017.1416934 |
| [4] | 张涓娟, 蒲宇, 李勇, 等. PI3K/AKT和MAPK/ERK1/2信号通路对胰腺癌PANC-1细胞VEGF表达的影响[J]. 川北医学院学报, 2014, 29(1): 44–48. [ Zhang JJ, Pu Y, Li Y, et al. Influence of PI3K and MAPKs signaling pathways on expression of VEGF in human pancreatic cancer PANC-1 cells[J]. Chuanbei Yi Xue Yuan Xue Bao, 2014, 29(1): 44–48. DOI:10.3969/j.issn.1005-3697.2014.01.09 ] |
| [5] | Bisht S, Feldmann G. Novel targets in pancreatic cancer therapy-current status and ongoing translational efforts[J]. Oncol Res Treat, 2018, 41(10): 596–602. DOI:10.1159/000493437 |
| [6] | 周显飞, 田舍, 王杰, 等. microRNA-29c对人胰腺癌细胞侵袭转移的抑制作用及机制[J]. 贵阳医学院学报, 2016, 41(9): 997–1001. [ Zhou XF, Tian S, Wang J, et al. Study on microRNA-29c inhibition effect and mechanism on human pancreatic cancer cells migration[J]. Guiyang Yi Xue Yuan Xue Bao, 2016, 41(9): 997–1001. ] |
| [7] | Zhao Y, Zhao L, Ischenko I, et al. Antisense inhibition of microRNA-21 and microRNA-221 in tumor-initiating stem-like cells modulates tumorigenesis, metastasis, and chemotherapy resistance in pancreatic cancer[J]. Target Oncol, 2015, 10(4): 535–548. DOI:10.1007/s11523-015-0360-2 |
| [8] | Zhu G, Zhou L, Liu H, et al. MicroRNA-224 Promotes Pancreatic Cancer Cell Proliferation and Migration by Targeting the TXNIP-Mediated HIF1α Pathway[J]. Cell Physiol Biochem, 2018, 48(4): 1735–1746. DOI:10.1159/000492309 |
| [9] | Qin A, Qian W. MicroRNA-7 inhibits colorectal cancer cell proliferation, migration and invasion via TYRO3 and phosphoinositide 3-kinase/protein B kinase/mammalian target of rapamycin pathway suppression[J]. Int J Mol Med, 2018, 42(5): 2503–2514. |
| [10] | Chen S, Lip L, Li J, et al. MiR-144 inhibits proliferation and induces apoptosis and autophagy in lung cancer cells by targeting TIGAR[J]. Cell Physiol Biochem, 2015, 35(3): 997–1007. DOI:10.1159/000369755 |
| [11] | 李伟, 王兆松, 董秋萍, 等. 肺鳞癌中miR-144靶基因预测及其生物信息学分析[J]. 天津医科大学学报, 2018, 24(4): 287–290. [ Li W, Wang ZS, Dong QP, et al. Bioinformatic analysis and prediction of miR-144 target genes in lung squamous cell carcinoma[J]. Tianjin Yi Ke Da Xue Xue Bao, 2018, 24(4): 287–290. ] |
| [12] | Ren K, Liu QQ, An ZF, et al. MiR-144 functions as tumor suppressor by targeting PIM1 in gastric cancer[J]. Eur Rev Med Pharmacol Sci, 2017, 21(13): 3028–3037. |
| [13] | Han B, Feng D, Yu X, et al. MicroRNA-144 mediates chronic inflammation and tumorigenesis in colorectal cancer progression via regulating C-X-C motif chemokine ligand 11[J]. Exp Ther Med, 2018, 16(3): 1935–1943. |
| [14] | Han S, Zhu J, Zhang Y. miR-144 Potentially Suppresses Proliferation and Migration of Ovarian Cancer Cells by Targeting RUNX1[J]. Med Sci Monit Basic Res, 2018, 24: 40–46. DOI:10.12659/MSMBR.907333 |
| [15] | Yao Q, Gu A, Wang Z, et al. MicroRNA-144 functions as a tumor suppressor in gastric cancer by targeting cyclooxygenase-2[J]. Exp Ther Med, 2018, 15(3): 3088–3095. |
| [16] | Wang S, Yan Y, Cheng Z, et al. Sotetsuflavone suppresses invasion and metastasis in non-small-cell lung cancer A549 cells by reversing EMT via the TNF-α/NF-κB and PI3K/AKT signaling pathway[J]. Cell Death Discov, 2018, 4: 26. |
| [17] | Feng Y, Zu LL, Zhang L. MicroRNA-26b inhibits the tumor growth of human liver cancer through the PI3K/Akt and NF-κB/MMP-9/VEGF pathways[J]. Oncol Rep, 2018, 39(5): 2288–2296. |
| [18] | 张洋, 刘晓菲, 王楠, 等. 阳和化岩汤联合曲妥珠对HER-2高表达型乳腺癌细胞PTEN-PI3K/Akt通路及VEGFC的影响研究[J]. 江苏中医药, 2018, 50(6): 79–82. [ Zhang Y, Liu XF, Wang N, et al. Effects of Yanghe Huayan Decoction combined with trastuzum on PTEN-PI3K/Akt pathway and VEGFC in HER-2 high expression breast cancer cells[J]. Jiangsu Zhong Yi Yao, 2018, 50(6): 79–82. DOI:10.3969/j.issn.1672-397X.2018.06.031 ] |
| [19] | Chen HX, Xu XX, Tan BZ, et al. MicroRNA-29b Inhibits Angiogenesis by Targeting VEGFA through the MAPK/ERK and PI3K/Akt Signaling Pathways in Endometrial Carcinoma[J]. Cell Physiol Biochem, 2017, 41(3): 933–946. DOI:10.1159/000460510 |
| [20] | Tao P, Wen H, Yang B, et al. miR-144 inhibits growth and metastasis of cervical cancer cells by targeting VEGFA and VEGFC[J]. Exp Ther Med, 2018, 15(1): 562–568. |
 2019, Vol. 46
2019, Vol. 46


