文章信息
- 程序性死亡受体1和淋巴细胞激活基因3在食管胃交界部腺癌围手术期的表达及意义
- Expression of Programmed Cell Death 1 and Lymphocyte Activation Gene 3 in Perioperation of Adenocarcinoma of Esophagogastric Junction and Related Significance
- 肿瘤防治研究, 2019, 46(5): 436-439
- Cancer Research on Prevention and Treatment, 2019, 46(5): 436-439
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.18.1518
- 收稿日期: 2018-10-17
- 修回日期: 2019-02-16
食管胃交界部腺癌(adenocarcinoma of esophagogastric junction, AEGJ)是我国常见的消化道恶性肿瘤之一,随着肿瘤的发展,肿瘤细胞分泌多种细胞因子抑制细胞免疫[1]。手术创伤所造成的炎性应激反应将进一步抑制细胞免疫反应,但具体机制尚不明了[2]。T淋巴细胞是细胞免疫的重要组成部分,而消化道肿瘤根治术后T淋巴细胞将显著减少,进而抑制细胞免疫能力[3]。既往研究显示:手术创伤所造成的细胞免疫功能障碍在术后1周内较为明显[4]。我们在前期研究中已证实AEGJ患者术后T淋巴细胞明显减少[5]。
本研究回顾性分析102例进展期AEGJ行经腹根治性切除+D2淋巴结清除术患者围手术期外周血T淋巴细胞亚群比例及程序性死亡受体1(programmed cell death 1, PD-1)和淋巴细胞激活基因3(lymphocyte-activation gene 3, LAG-3)在T细胞上的表达水平,了解其在根治性手术创伤抑制细胞免疫功能中的作用。
1 资料与方法 1.1 一般资料收集2015年1月—2017年12月安阳市肿瘤医院腹部肿瘤外科手术治疗的进展期AEGJ患者,其中102例符合入组标准作为实验组,并行经腹根治切除+D2淋巴结清除术,围手术期给予常规处理。研究对象的纳入标准:(1)术前经胃镜活检病理确诊为腺癌;(2)排除远处转移;(3)年龄40~70岁;(4)无手术禁忌证并无术前肿瘤治疗;(5)无其他恶性肿瘤病史及放化疗史;(6)签署知情同意书,并要求手术治疗;(7)术中确诊侵犯浆膜和(或)发现区域肿大淋巴结,而且未发现腹盆腔种植灶。所有病例手术标本均经病理学检查证实,并获得安阳市肿瘤医院生命科学伦理审查委员会审查同意。选同期健康体检志愿者为对照组,共87例,均无恶性肿瘤病、代谢疾病、免疫系统疾病病史。实验组和对照组两组间比较,年龄、性别、身体质量指数、并发症率差异均无统计学意义(均P > 0.05)。
1.2 诊断和分期所有病例术后检出淋巴结均≥20枚[6],病理结果均经石蜡切片复阅证实。根据2016年美国癌症联合会(American Joint Committee on Cancer, AJCC)第8版胃癌TNM分期标准[7]进行术后病理分期,其中,ⅡB期17例,Ⅲ期85例。
1.3 手术治疗实验组所有患者均给予经腹食管胃交界部腺癌R0切除+D2淋巴结清扫。术前均预防性应用抗生素,术后1 d给予肠外营养、缓慢经空肠营养管给予肠内营养并床上活动。术后2 d床边活动,术后5 d排除吻合口瘘后停肠外营养,开始经口进全流食并配合鼻饲。无围手术期死亡病例。
1.4 观察指标采用酶联免疫吸附试验(ELISA)法检测血清中C反应蛋白(C-reactive protein, CRP)的浓度(CRP ELISA试剂盒购于RD公司)。应用美国Beckman Coulter公司生产的Epics-XL Ⅱ型流式细胞仪行流式细胞术检测CD3+、CD3+CD4+、CD3+CD8+ T细胞比例和PD-1、LAG-3表达的比值。使用直接免疫荧光法标记全血,应用Flow-Jo软件检测分析实验组术前、术后1天(1 POD)、术后3天(3 POD)、术后7天(7 POD)、术后9天(9 POD)和对照组各指标的变化情况。
1.5 统计学方法使用SPSS 22.0统计软件进行统计学处理。对计数资料采用χ2检验、计量资料采用t检验、重复测量数据采用重复测量的方差分析,P < 0.05为差异有统计学意义。
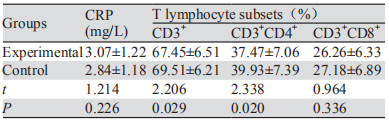
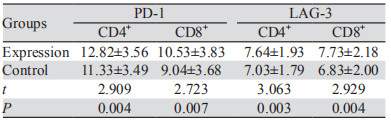
2 结果 2.1 实验组术前各观察指标和对照组的比较实验组术前的CD3+、CD3+CD4+T细胞比例均低于对照组(均P < 0.05),而血清CRP水平和CD3+CD8+ T细胞的比例两组之间差异无统计学意义(均P > 0.05),见表 1。PD-1和LAG-3在CD4+和CD8+T细胞的阳性率实验组均高于对照组,且差异均有统计学意义(均P < 0.05),见表 2。
|
|
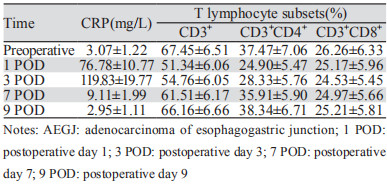
炎性反应因子—C反应蛋白水平在术后第1天迅速升高,明显大于术前水平(P < 0.05),于术后第3天达到顶点然后逐渐下降,至术后第7天仍高于术前水平(P < 0.05),术后第9天达到术前水平。而CD3+、CD3+CD4+T细胞于术后第1天均迅速下降(P < 0.01),然后逐渐回升,于术后第9天达术前水平(P > 0.05)。而CD3+CD8+T细胞于术后稍降低,仅术后第3天比例显著低于术前(t=2.089, P=0.038),其余差异均无统计学意义(均P > 0.05),见表 3。
|
CD4+PD-1+T细胞在外周静脉血淋巴细胞中的比例在术后第1天达到最大值,显著高于术前水平(14.84±4.09 vs. 12.82±3.56),差异有统计学意义(t=3.766, P < 0.001),随后逐渐下降,术后第3天仍显著高于术前水平(t=2.359, P=0.019),至术后第7天进一步下降,且接近术前水平(t=0.777, P=0.438),至术后第9天继续下降,稍低于术前水平,差异无统计学意义(t=0.450, P=0.653),但仍高于对照组(12.60±3.46 vs. 11.33±3.49),差异有统计意义(t=2.517, P=0.013)。术后CD8+PD-1+T细胞在外周静脉血淋巴细胞中的比例均高于术前(P < 0.05),并呈逐渐升高趋势,于术后第7天到达最大值(t=4.168, P < 0.001),随后逐渐下降,见表 4。

|
术后CD4+LAG-3+T细胞在外周静脉血淋巴细胞中的比例呈逐渐升高趋势,于术后7天到达最大值,随后逐渐下降,但仅术后第7天明显高于术前,差异有统计学意义(t=2.199, P=0.029),其余差异无统计学意义(均P > 0.05)。术后CD8+LAG-3+T细胞在外周静脉血淋巴细胞中的比例术后1天略下降,然后逐渐升高,于术后第7天到达最大值,随后再次下降,但差异均无统计学意义(均P > 0.05),见表 4。
3 讨论T淋巴细胞介导的抗肿瘤免疫反应是机体清除肿瘤原发灶、防止肿瘤转移的主要力量。T淋巴细胞总数及淋巴细胞亚群比例的变化将导致T淋巴细胞功能异常。既往研究显示:PD-1[8]和LAG-3[9]均是调节抗原特异性T细胞效应的负调节蛋白。PD-1通过活化半胱氨酸天冬氨酸蛋白酶3[10]和抑制γ-干扰素[11]来调节淋巴细胞的数量及功能。LAG-3表达在活化的T淋巴细胞上,是活化T细胞的抑制性受体,负性调控着T细胞功能。本研究结果证实了进展期AEGJ患者CD3+、CD3+CD4+T淋巴细胞均较正常人群低,而且PD-1、LAG-3在CD4+、CD8+T淋巴细胞上的表达均较正常人群高。说明进展期AEGJ肿瘤负荷较大,肿瘤细胞分泌的多种细胞因子抑制了细胞免疫功能,这与既往的研究结果[12-13]相一致。
CRP被广泛应用于评估炎性反应和作为组织损伤的指标[14]。根治性手术创伤大,在围手术期将引起一系列复杂的生物学反应。我们发现CRP在术后迅速升高,于术后3天达顶峰,然后逐渐下降,术后9天降至正常范围,符合手术创伤后炎性反应规律。这种手术应激将进一步抑制细胞免疫。本研究发现AEGJ患者根治术后PD-1、LAG-3在CD4+、CD8+T淋巴细胞上的表达发生了一些改变,说明他们均在围手术期抑制细胞免疫中发挥作用。CD4+PD-1+T细胞比例在术后1天迅速升高,并到达顶峰,然后逐渐下降,到术后7天接近于术前水平。CD4+PD-1+T细胞比例的变化曲线与围手术期细胞免疫状态相一致,即术后1天细胞免疫功能障碍最明显,至术后7天部分恢复。这与Takaya等[15]在胃癌中的研究结果相符。可以认为术后各种炎性因子促进了CD4+PD-1+T细胞表达升高进而调控T淋巴细胞亚群的改变,从而抑制机体细胞免疫能力。而CD8+PD-1+T细胞的变化规律则为:术后逐渐增加,于术后7天到峰值,然后缓慢下降,说明CD8+PD-1+T细胞比例受多种因素影响,而手术创伤不是其重要的影响因素。
LAG-3作为另一种调节抗原特异性T细胞效应的负调节蛋白可促进CD4+和CD8+T细胞的功能衰竭,并与肿瘤的不良预后有关[9]。本研究结果显示,术后CD4+LAG-3+T细胞在外周静脉血淋巴细胞中的比例呈逐渐升高趋势,术后第7天到达最大值,随后逐渐下降,但增加幅度较小,仅术后第7天明显高于术前。而CD8+LAG-3+T细胞在外周静脉血淋巴细胞中的比例在术后第1天略下降,然后逐渐升高,于术后第7天到达最大值,随后再次下降,变化幅度均较小,与术前相比,均无显著差异。由此可以看出,围手术期LAG-3在外周血CD4+、CD8+T淋巴细胞上表达变化均不能反映手术创伤所造成的细胞免疫抑制程度。
综上所述,进展期AEGJ术前机体细胞免疫能力受到一定程度的抑制,而术后细胞免疫抑制进一步加重。进展期AEGJ患者围手术期PD-1和LAG-3在CD4+、CD8+T细胞上的表达均有不同程度的上调,这可能与AEGJ手术后的细胞免疫抑制有关。但仅CD4+PD-1+T淋巴细胞比例的变化规律与围手术期机体细胞免疫功能变化相吻合,说明CD4+PD-1+T淋巴细胞在术后细胞免疫功能的调控中发挥重要作用。
作者贡献
张伟: 承担课题设计、进程管理和论文撰写
李守淼: 承担质量管控、统计处理等工作
龚艳鑫: 承担实验操作、数据收集整理等工作
李保中: 承担实验的统筹安排
张志忠、刘志强: 承担手术治疗及围手术期管理等工作
| [1] | Kim R. Effects of surgery and anesthetic choice on immunosuppression and cancer recurrence[J]. J Transl Med, 2018, 16(1): 8. DOI:10.1186/s12967-018-1389-7 |
| [2] | Ananth AA, Tai LH, Lansdell C, et al. Surgical Stress Abrogates Pre-Existing Protective T Cell Mediated Anti-Tumor Immunity Leading to Postoperative Cancer Recurrence[J]. PLoS One, 2016, 11(5): e0155947. DOI:10.1371/journal.pone.0155947 |
| [3] | Wichmann MW, Hüttl TP, Winter H, et al. Immunological effects of laparoscopic vs open colorectal surgery: a prospective clinical study[J]. Arch Surg, 2005, 140(7): 692–7. DOI:10.1001/archsurg.140.7.692 |
| [4] | Chen L, Sun L, Lang Y, et al. Fast-track surgery improves postoperative clinical recovery and cellular and humoral immunity after esophagectomy for esophageal cancer[J]. BMC Cancer, 2016, 16: 449. DOI:10.1186/s12885-016-2506-8 |
| [5] | 李守淼, 张志忠, 张伟, 等. 食管胃交界部腺癌术后腹腔热灌注化疗对细胞免疫的影响[J]. 中华普通外科杂志, 2017, 32(12): 1047–9. [ Li SM, Zhang ZZ, Zhang W, et al. Influence of hyperthermic intraperitoneal perfusion chemotherapy on cellular immune function in esophagogastric junction adenocarcinoma after radical resection[J]. Zhonghua Pu Tong Wai Ke Za Zhi, 2017, 32(12): 1047–9. ] |
| [6] | 徐志云, 刘良, 杨立信, 等. 淋巴结清扫数目对淋巴结转移阴性SiewertⅡ型食管胃交界部癌的影响[J]. 实用医学杂志, 2016, 32(23): 3878–81. [ Xu ZY, Liu L, Yang LX, et al. Survival analysis the impact of the number of negative lymph nodes negative lymph node in Siewert Ⅱ adenocarcinoma of the esophagogastrci junction without lymphatic metastasis[J]. Shi Yong Yi Xue Za Zhi, 2016, 32(23): 3878–81. ] |
| [7] | 刘光艺, 黄镇, 王子卫. 第8版国际抗癌联盟和美国癌症联合委员会胃癌TNM分期系统简介及解读[J]. 腹部外科, 2017, 30(4): 241–5. [ Liu GY, Huang Z, Wang ZW. The 8th edition of the Union for International Cancer Control and the American Joint Committee on Cancer gastric cancer TNM staging system: explanation and elaboration[J]. Fu Bu Wai Ke, 2017, 30(4): 241–5. ] |
| [8] | Pakkala S, Owonikoko TK. Immune checkpoint inhibitors in small cell lung cancer[J]. J Thorac Dis, 2018, 10(Suppl 3): S460–S7. |
| [9] | Deng WW, Mao L, Yu GT, et al. LAG-3 confers poor prognosis and its blockade reshapes antitumor response in head and neck squamous cell carcinoma[J]. Oncoimmunology, 2016, 5(11): e1239005. DOI:10.1080/2162402X.2016.1239005 |
| [10] | Xu P, Zhang P, Sun Z, et al. Surgical trauma induces postoperative T-cell dysfunction in lung cancer patients through the programmed death-1 pathway[J]. Cancer Immunol Immunother, 2015, 64(11): 1383–92. DOI:10.1007/s00262-015-1740-2 |
| [11] | Saito H, Kuroda H, Matsunaga T, et al. Increased PD-1 expression on CD4+ and CD8+T cells is involved in immune evasion in gastric cancer[J]. J Surg Oncol, 2013, 107(5): 517–22. DOI:10.1002/jso.23281 |
| [12] | Hase S, Weinitschke K, Fischer K, et al. Monitoring peri-operative immune suppression in renal cancer patients[J]. Oncol Rep, 2011, 25(5): 1455–64. |
| [13] | Sellitto A, Galizia G, De Fanis U, et al. Behavior of circulating CD4+CD25+Foxp3+ regulatory T cells in colon cancer patients undergoing surgery[J]. J Clin Immunol, 2011, 31(6): 1095–104. DOI:10.1007/s10875-011-9585-8 |
| [14] | 孟成, 于洋, 王智浩, 等. 加速康复外科在胃癌根治术中临床价值的前瞻性研究[J]. 中华消化外科杂志, 2015, 14(1): 52–6.]. [ Meng C, Yu Y, Wang ZH, et al. Clinical efficacy of enhanced recovery after surgery in the radical gastrectomy for gastric cancer: a prospective study[J]. Zhonghua Xiao Hua Wai Ke Za Zhi, 2015, 14(1): 52–6.]. DOI:10.3760/cma.j.issn.1673-9752.2015.01.012 ] |
| [15] | Takaya S, Saito H, Ikeguchi M. Upregulation of Immune Checkpoint Molecules, PD-1 and LAG-3, on CD4+ and CD8+T Cells after Gastric Cancer Surgery[J]. Yonago Acta Med, 2015, 58(1): 39–44. |
 2019, Vol. 46
2019, Vol. 46


