文章信息
- Sestrin2在鼻咽癌中的表达及其生物学功能
- Expression and Biological Functions of Sestrin2 in Nasopharyngeal Carcinoma
- 肿瘤防治研究, 2019, 46(5): 421-425
- Cancer Research on Prevention and Treatment, 2019, 46(5): 421-425
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.18.1469
- 收稿日期: 2018-10-10
- 修回日期: 2018-11-26
鼻咽癌(nasopharyngeal carcinoma, NPC)起源于鼻咽部黏膜上皮组织和腺体,多为低分化鳞状细胞癌,恶性程度高且易转移和复发,是我国南方(广东、广西、福建、湖南和江西等)及东南亚地区较为常见的恶性肿瘤[1]。尽管目前手术联合放化疗显著提高了鼻咽癌的治疗效果,但是,中晚期鼻咽癌患者的5年生存率仍低于60%,且预后较差[2-4]。因此,深入研究鼻咽癌的发生与发展机制,寻找新的治疗方法,对改善患者治疗效果和预后具有重要意义。
Sestrin2是应激诱导蛋白Sestrins家族的重要成员,是一种进化上高度保守的蛋白[5]。在DNA损伤、氧化应激、内质网应激等损伤因子的作用下,Sestrin2可通过调控腺苷酸激活蛋白激酶(AMP-activated protein kinase, AMPK)和哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)这两大信号通路维持细胞稳态[6]。多项研究表明Sestrin2表达下调与多种恶性肿瘤相关,包括结直肠癌、乳腺癌、膀胱癌、肝癌、骨肉瘤等[7]。然而,Sestrin2在鼻咽癌发生发展中的作用及其机制尚不清楚。本研究首先检测了Sestrin2在鼻咽癌患者肿瘤和癌旁组织的表达,继而通过pcDNA3.1/Sestrin2转染鼻咽癌CNE-1细胞,观察过表达Sestrin2对CNE-1细胞增殖和凋亡的影响,以期为鼻咽癌的治疗提供新的靶点及理论依据。
1 资料与方法 1.1 临床标本收集收集2016年1月—2018年2月湖北省肿瘤医院收治的46例鼻咽癌及相应癌旁正常组织标本。所有患者均行病理活检,且活检前未接受放、化疗,结合临床表现和鼻咽部CT检查确诊为鼻咽部鳞状细胞癌。排除标准:(1)年龄 < 18岁或 > 75岁;(2)合并其他部位的原发性肿瘤或转移癌;(3)严重的感染性疾病及免疫功能障碍者;(4)妊娠期和哺乳期女性;(5)精神异常患者等。其中有3例因合并其他部位的原发性肿瘤或转移癌、1例因合并严重的感染性疾病及免疫功能障碍、1例因妊娠期排除,最终纳入41例患者;所有标本的收集均获得患者的知情同意,并通过湖北省肿瘤医院伦理委员会审核批准。
1.2 试剂人鼻咽癌鳞癌细胞株CNE-1购自中国科学院典型培养物保藏委员会细胞库,pcDNA3.1/Sestrin2质粒由上海吉凯基因化学技术有限公司合成和鉴定。RNA提取试剂盒和CCK-8试剂盒购自美国Thermo公司。TRIzol、反转录试剂盒和细胞凋亡检测试剂盒均购自德国Roche公司。LipofectamineTM2000转染试剂盒和RPMI 1640培养基购自美国Invitrogen公司。兔抗人Sestrin2抗体、兔抗p-AMPK抗体、兔抗人AMPK抗体、兔抗人p-mTOR抗体、兔抗人mTOR抗体和兔抗人甘油醛-3-磷酸脱氢酶(Glyceraldehyde-3-phosphate dehydrogenase, GAPDH)抗体均购自美国Abcam公司。
1.3 实验方法 1.3.1 免疫组织化学染色4%的多聚甲醛固定标本,石蜡包埋后将蜡块切成4 μm厚的组织切片。放入二甲苯后酒精梯度脱蜡,再放入微波炉中进行抗原修复,用3%双氧水溶液阻断内源性过氧化物酶。3%小牛血清封闭后加入Sestrin2抗体和二抗,待切片显色后苏木精对比染色细胞核,脱水封片后显微镜下观察并采集图片。Sestrin2阳性表达物定位于细胞内,细胞内出现棕黄色颗粒者为阳性细胞。免疫组织化学结果判断:阳性细胞数 < 10%为(-),阳性细胞数10%~25%为(+),阳性细胞数≥25%~50%为(++),阳性细胞数≥50%为(+++)。将(-)归为阴性表达,(+)~(+++)归为阳性表达。
1.3.2 细胞培养及转染将人鼻咽癌CNE-1细胞置于含10%胎牛血清的RPMI 1640培养基中,培养于5%CO2、37℃的培养箱。待细胞培养至对数期时,利用脂质体LipofectamineTM2000转染CNE-1细胞。将细胞分为三组:未处理组(正常CNE-1细胞)、阴性对照组(转染空载体pcDNA3.1)和转染组(转染pcDNA3.1/Sestrin2)。
1.3.3 RT-PCR法检测Sestrin2 mRNA水平转染后的CNE-1细胞培养48h后利用TRIzol法提取总RNA,用反转录试剂盒将RNA反转录成cDNA,利用罗氏Lightcycler480 RT-PCR仪进行扩增。反应条件为:95℃预变性10 min,95℃变性15 s,60℃退火1 min,共40个循环,72℃延伸10 min。以GAPDH作为内参,对RT-PCR结果进行定量分析。利用Primer-BLAST在线设计引物,特异性引物序列由上海生工生物工程有限公司合成。GAPDH上游引物序列为5' -CGGAGTCAACGGATTTGGTCGTAT-3' ,下游引物序列为5' -AGCCTTCTCCATGGTGGTGAAGAC-3' 。Sestrin2上游引物:5' -TCTTACCTGGTAGGCTCCCAC-3' ,下游引物:5' -AGCAACTTGTTGATCTCGCTG-3' 。实验重复3次,取均值。
1.3.4 Western blot法检测Sestrin2蛋白水平细胞蛋白提取试剂盒提取总蛋白,二喹啉甲酸(Bicinchoninic acid, BCA)法进行总蛋白浓度和定量检测。制备十二烷基硫酸钠-聚丙烯酰胺凝胶,每孔加入50 µg的蛋白样品,75 V恒压电泳30 min后,100 V恒压电泳2 h。待电泳结束后,湿转法将蛋白电转移到PVDF膜上,5%牛血清白蛋白封闭60 min后,加入相应的一抗,4℃孵育过夜。随后二抗室温孵育1 h,利用Odyssey双色红外激光成像系统扫膜,以GAPDH为内参,分析目的蛋白表达水平。实验重复3次,取均值。
1.3.5 CCK-8法检测细胞增殖活性取对数生长期细胞接种到96孔培养板中,调整细胞密度为5×103个每孔。每孔中加入10 µl的CCK-8溶液后37℃孵育4 h,移除上清液,加入150 µl的二甲基亚砜溶液,37℃孵育10 min,酶标仪检测450 nm波长处每孔的吸光度值(OD值)。实验重复3次,取均值。
1.3.6 流式细胞术检测细胞凋亡将处于对数生长期的细胞接种于6孔板中培养48 h,收集细胞后弃上清液。200 μl的结合缓冲液重悬细胞,5 μl膜联蛋白V-FITC(Annexin V-FITC)和5 μl碘化丙啶(PI)染色液,37℃避光孵育15 min后,加入150 µl的缓冲液,流式细胞仪检测细胞凋亡水平。实验重复3次,取均值。
1.4 统计学方法采用SPSS 21.0软件进行统计学处理。计量数据以均数±标准差表示,非参数检验采用Mann-Whitney U检验,多组比较采用单因素方差分析。以P < 0.05为差异有统计学意义。
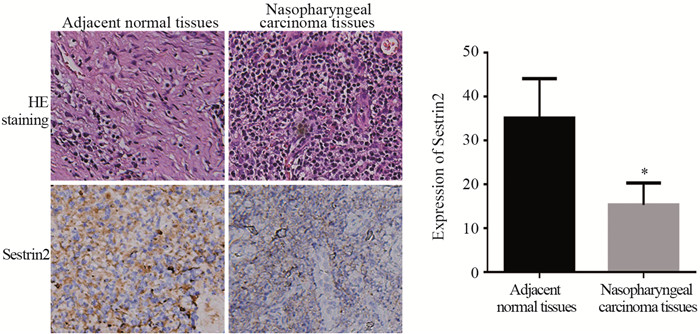
2 结果 2.1 Sestrin2在鼻咽癌及癌旁正常组织中的表达免疫组织化学结果显示鼻咽癌及癌旁正常组织均有Sestrin2的表达,且肿瘤组织Sestrin2的表达量明显低于癌旁正常组织,差异有统计学意义(P=0.00241),见图 1。
|
| *: P<0.05, compared with adjacent normal tissues 图 1 鼻咽癌组织与癌旁正常组织中Sestrin2的表达(×200) Figure 1 Sestrin2 expression in nasopharyngeal carcinoma and adjacent normal tissues (×200) |
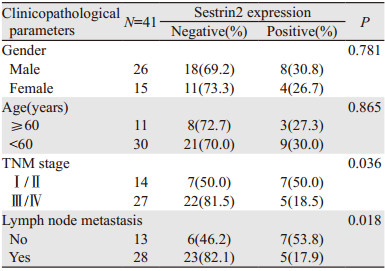
Sestrin2的低表达与TNM分期(P=0.036)、淋巴结转移(P=0.018)相关,而与性别(P=0.781)和年龄(P=0.865)无关,见表 1。
|
RT-PCR和Western blot法结果显示,转染组CNE-1细胞中Sestrin2 mRNA和蛋白表达明显高于未处理组和阴性对照组,差异有统计学意义(均P=0.000),而未处理组和阴性对照组相比,差异无统计学意义(P > 0.05),见图 2、表 2。

|
| 1: Control group; 2: Negative control group; 3: Transfection group 图 2 Western blot法检测转染后Sestrin2蛋白水平 Figure 2 Sestrin2 protein level after transfection detected by Western blot |

|
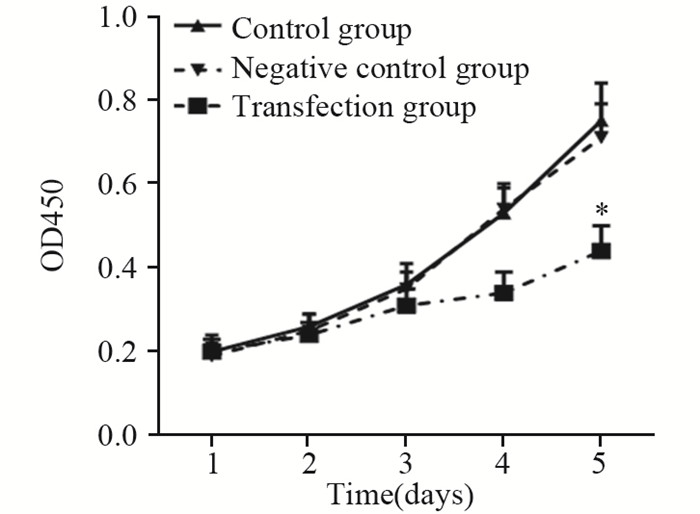
CCK-8实验结果显示,Sestrin2转染组细胞生长速度明显低于未处理组和阴性对照组,差异有统计学意义(P=0.000),而未处理组和阴性对照组相比,差异无统计学意义(P > 0.05),见图 3。
|
| *: P<0.05, compared with Control and Negative control groups 图 3 CCK-8法检测Sestrin2过表达对人鼻咽癌细胞增殖能力的影响 Figure 3 Effect of Sestrin2 overexpression on proliferation of human nasopharyngeal carcinoma cells detected by CCK-8 assay |
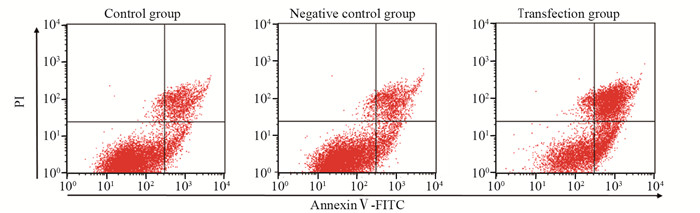
流式细胞术检测结果显示Sestrin2转染组细胞凋亡率((45.6±4.24)%)显著高于未处理组((11.8±1.35)%)和阴性对照组((10.3±1.26)%),差异有统计学意义(P=0.000),而未处理组和阴性对照组相比,差异无统计学意义(P > 0.05),见图 4。
|
| 图 4 流式细胞术检测CNE-1细胞凋亡情况 Figure 4 Apoptosis of nasopharyngeal carcinoma cells detected by flow cytometry |
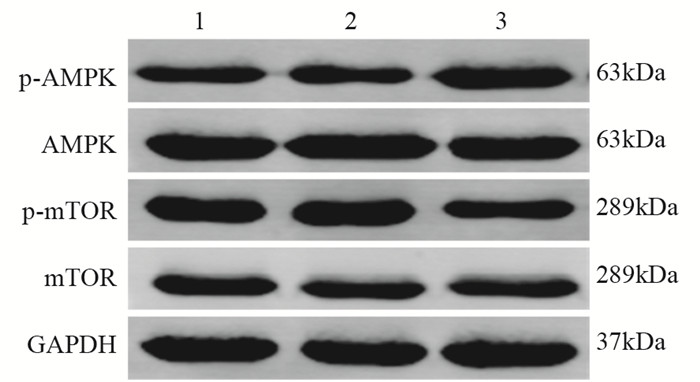
Western blot法检测Sestrin2过表达对AMPK和mTOR通路的影响,结果显示相较于未处理组和阴性对照组,Sestrin2转染组细胞AMPK磷酸化水平显著升高,而mTOR磷酸化水平显著降低,差异均有统计学意义(均P=0.000)。而未处理组和阴性对照组相比,差异无统计学意义(P > 0.05),见表 3、图 5。

|
|
| 1: Control group; 2: Negative control group; 3: Transfection group 图 5 Western blot法检测转染后AMPK和mTOR蛋白水平 Figure 5 Expression levels of AMPK and mTOR proteins after transfection detected by Western blot |
鼻咽癌是头颈部最常见的恶性肿瘤之一,具有明显的种族差异和地域分布特点,患者病死率高且预后较差。因此,寻找新的治疗靶点和干预方式,对改进患者的治疗方式和改善预后具有重要意义。本研究首先检测了Sestrin2在鼻咽癌患者肿瘤和癌旁组织的表达,免疫组织化学结果提示Sestrin2在鼻咽癌组织表达降低,且Sestrin2低表达与TNM分期、淋巴结转移和肿瘤复发情况密切相关,这些结果表明,Sestrin2表达下调可能与鼻咽癌肿瘤的发生发展相关。继而我们选用经典鼻咽癌细胞系CNE-1细胞为研究对象,通过pcDNA3.1/Sestrin2转染鼻咽癌CNE-1细胞,RT-PCR和Western blot结果提示转染组细胞Sestrin2的mRNA和蛋白水平显著高于未处理组和阴性对照组,这些结果表明我们成功构建了稳定表达Sestrin2的鼻咽癌CNE-1细胞。
Sestrin2,又称为低氧诱导基因95(Hi95),其编码基因位于人类6号染色体的长臂21位点。2002年,Budanov等[8]首次将Sestrin2从人脑胶质母细胞瘤A172细胞中克隆出来,并证实其在多种组织中表达。Sesntrin2包含2个呈对称分布、在结构上类似的功能域,其N末端可还原烷基过氧化物,而C末端可抑制mTOR。既往研究提示Sestrin2在多种类型肿瘤的发生发展中起着重要的作用[6]。Seo等[9]证实5-氟尿嘧啶可通过上调Sestrin2的表达促进结肠癌细胞的凋亡。Tong等[10]的研究结果表明迷迭香酸提取物可通过上调Sestrin2的表达,抑制人肝癌HepG2细胞的增殖能力,进而促进HepG2细胞的凋亡。本研究中,我们利用CCK-8法观察Sestrin2过表达对鼻咽癌CNE-1细胞增殖能力的影响,流式细胞仪检测Sestrin2过表达对鼻咽癌CNE-1细胞凋亡水平的影响。和既往研究一致,本研究结果表明Sestrin2过表达可抑制鼻咽癌CNE-1细胞的增殖活性,诱导鼻咽癌CNE-1细胞的凋亡,这些结果提示Sestrin2可能是干预和治疗鼻咽癌的重要靶点。
我们进一步研究了Sestrin2过表达调控鼻咽癌细胞增殖和凋亡的下游信号分子。AMPK是一种由异源三聚体构成的蛋白复合物,包括α催化亚基、β和γ调节亚基。当AMP/ATP升高时,AMP与γ调节亚基结合引起构象改变,从而诱导AMPK磷酸化,调控能量物质代谢[11]。Wei等[12]研究表明,Sestrin2过表达可通过激活AMPK通路,抑制结直肠癌细胞的增殖,进而诱导结直肠癌细胞的凋亡。mTOR是一种相对分子质量为289 kD的丝/苏氨酸蛋白激酶,其编码蛋白由2 549个氨基酸组成。mTOR可通过整合多种细胞外信号,包括生长因子、能量、营养等,参与核糖体转录,蛋白质翻译和细胞凋亡等多种病理生理过程[13]。Wang等[14]表明,Sestrin2过表达可通过激活AMPK,抑制mTOR的活性,促进卵巢癌细胞的凋亡。本实验结果表明,Sestrin2过表达后的鼻咽癌中AMPK磷酸化水平升高,而mTOR磷酸化水平降低,提示过表达Sestrin2可通过激活AMPK通路,抑制mTOR通路,从而诱导鼻咽癌CNE-1细胞凋亡。
综上所述,Sestrin2在鼻咽癌组织表达下调,且Sestrin2低表达与TNM分期、淋巴结转移和肿瘤复发情况密切相关。上调Sestrin2的表达通过激活AMPK磷酸化,抑制mTOR磷酸化,抑制鼻咽癌细胞生长,促进鼻咽癌细胞的凋亡。本研究为防治鼻咽癌提供了新的靶点和实验基础。然而,Sestrin2调控AMPK和mTOR信号通路的具体机制还有待进一步研究。此外,本研究没有在多种鼻咽癌细胞中进行验证,也没有进行体内实验,下一步我们将就此继续探讨。
作者贡献
桂超:负责标本收集、实验及论文撰写
邓万凯、刘细国:提供实验思路、设计实验路线、指导和参与论文撰写
| [1] | 万刚, 徐鹏, 郎锦义. 局部晚期鼻咽癌新辅助化疗研究进展[J]. 肿瘤防治研究, 2016, 43(2): 93–9. [ Wan G, Xu P, Lang JY. Research Progress of Neoadjuvant Chemotherapy for Locally Advanced Nasopharyngeal Carcinoma[J]. Zhong Liu Fang Zhi Yan Jiu, 2016, 43(2): 93–9. DOI:10.3971/j.issn.1000-8578.2016.02.001 ] |
| [2] | Chua MLK, Wee JTS, Hui EP, et al. Nasopharyngeal carcinoma[J]. Lancet, 2016, 387(10022): 1012–24. DOI:10.1016/S0140-6736(15)00055-0 |
| [3] | Chan KCA, Chu SWI, Lo YMD. Ambient Temperature and Screening for Nasopharyngeal Cancer[J]. N Engl J Med, 2018, 378(10): 962–3. DOI:10.1056/NEJMc1800433 |
| [4] | 王建玲, 周慧芳, 杨东. 鼻咽癌治疗新进展[J]. 临床耳鼻咽喉头颈外科杂志, 2011, 25(21): 1005–8. [ Wang JL, Zhou HF, Yang D. Research Progress of Nasopharyngeal Carcinoma[J]. Lin Chuan Er Bi Yan Hou Tou Jin Wai Ke Za Zhi, 2011, 25(21): 1005–8. ] |
| [5] | 王丽雪, 祝筱梅, 卢中秋, 等. 应激诱导蛋白Sestrin2研究进展[J]. 生理科学进展, 2018, 49(2): 139–43. [ Wang LX, Zhu XM, Lu ZQ, et al. Research progress of stress induced protein Sestrin2[J]. Sheng Li Ke Xue Jin Zhan, 2018, 49(2): 139–43. DOI:10.3969/j.issn.0559-7765.2018.02.014 ] |
| [6] | Pasha M, Eid AH, Eid AA, et al. Sestrin2 as a Novel Biomarker and Therapeutic Target for Various Diseases[J]. Oxid Med Cell Longev, 2017, 2017: 3296294. |
| [7] | Wang M, Xu Y, Liu J, et al. Recent Insights into the Biological Functions of Sestrins in Health and Disease[J]. Cell Physiol Biochem, 2017, 43(5): 1731–41. DOI:10.1159/000484060 |
| [8] | Budanov AV, Shoshani T, Faerman A, et al. Identification of a novel stress-responsive gene Hi95 involved in regulation of cell viability[J]. Oncogene, 2002, 21(39): 6017–31. DOI:10.1038/sj.onc.1205877 |
| [9] | Seo K, Ki SH, Park EY, et al. 5-Fluorouracil inhibits cell migration by induction of Sestrin2 in colon cancer cells[J]. Arch Pharm Res, 2017, 40(2): 231–9. DOI:10.1007/s12272-016-0878-6 |
| [10] | Tong XP, Ma YX, Quan DN, et al. Rosemary Extracts Upregulate Nrf2, Sestrin2, and MRP2 Protein Level in Human Hepatoma HepG2 Cells[J]. Evid Based Complement Alternat Med, 2017, 2017: 7359806. |
| [11] | Monteverde T, Muthalagu N, Port J, et al. Evidence of cancer-promoting roles for AMPK and related kinases[J]. FEBS J, 2015, 282(24): 4658–71. DOI:10.1111/febs.13534 |
| [12] | Wei JL, Fang M, Fu ZX, et al. Sestrin 2 suppresses cells proliferation through AMPK/mTORC1 pathway activation in colorectal cancer[J]. Oncotarget, 2017, 8(30): 49318–28. |
| [13] | Rad E, Murray JT, Tee AR. Oncogenic Signalling through Mechanistic Target of Rapamycin (mTOR): A Driver of Metabolic Transformation and Cancer Progression[J]. Cancers (Basel), 2018, 10(1). pii: E5. https://www.ncbi.nlm.nih.gov/pubmed/29301334 |
| [14] | Wang X, Liu W, Zhuang D, et al. Sestrin2 and sestrin3 suppress NK-92 cell-mediated cytotoxic activity on ovarian cancer cells through AMPK and mTORC1 signaling[J]. Oncotarget, 2017, 8(52): 90132–43. |
 2019, Vol. 46
2019, Vol. 46


