文章信息
- 阿帕替尼通过抑制糖酵解途径对乳腺癌MDA-MB-231细胞增殖抑制及凋亡的作用
- Apatinib Suppresses Proliferation and Induced Apoptosis of Human Breast Cancer Cell Line MDA-MB-231 Through Glycolytic Inhibition
- 肿瘤防治研究, 2019, 46(5): 401-405
- Cancer Research on Prevention and Treatment, 2019, 46(5): 401-405
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.18.1422
- 收稿日期: 2018-09-28
- 修回日期: 2018-12-05
2. 250117 济南,济南市第三人民医院外科;
3. 250117 济南,济南市第三人民医院肝胆外科
2. Department of Surgery, The Third People's Hospital of Ji'nan, Ji'nan 250117, China;
3. Department of Hepatobiliary Surgery, The Third People's Hospital of Ji'nan, Ji'nan 250117, China
乳腺癌是威胁女性生命健康的最常见恶性肿瘤类型,其发病率及死亡率均居女性恶性肿瘤首位。据最新全球肿瘤数据统计分析结果,2018年预计全球将有210万乳腺癌新发患者,约占女性新发恶性肿瘤数的四分之一[1-2]。我国乳腺癌患者数量以每年2%~3%的增长速率递增,同时发病年龄日趋年轻化,已成为当前社会的重大公共卫生问题[3],寻找潜在的乳腺癌治疗药物对于乳腺癌的防治具有重要的临床意义。从临床已使用的药物中发现其新的适应证是一种高效的药物筛选策略,可避免因生物利用度差、不良反应高等原因导致的成药性困难问题。阿帕替尼(Apatinib)是一种小分子靶向的血管内皮生长因子受体(vascular endothelial growth factor receptor, VEGFR)酪氨酸激酶抑制剂,目前已获批用于晚期胃腺癌或胃-食管结合部腺癌患者三线及三线以上临床治疗,可显著延长晚期胃癌患者的生存期。经检索得知目前有关阿帕替尼对乳腺癌细胞体内外抗肿瘤作用的研究报道十分有限。本实验拟通过研究阿帕替尼对乳腺癌细胞凋亡的影响及其潜在的分子机制,为阿帕替尼应用于乳腺癌的临床治疗提供理论依据和实验基础。
1 材料与方法 1.1 细胞株人乳腺癌MDA-MB-231细胞购自中科院上海细胞库,细胞培养于含10%胎牛血清的DMEM培养液中。常规培养时细胞置于37℃、5%CO2的培养箱中。
1.2 主要试剂阿帕替尼(Apatinib, CAS: 1218779-75-9)购自大连美仑生物技术有限公司;DMEM培养基、胎牛血清、青-链霉素双抗溶液及胰蛋白酶购自美国Gibco公司;CCK-8试剂盒(货号:C0037)购自碧云天生物科技有限公司(上海,中国);Annexin V-FITC/PI双染细胞凋亡检测试剂盒(货号:KGA108-1)购自江苏凯基生物科技有限公司(南京,中国);乳酸含量检测试剂盒(货号:MAK064)购自Sigma公司(上海,中国);糖酵解压力试剂盒(货号:103020-100)购自安捷伦科技(上海)有限公司;其余试剂为国产分析纯。
1.3 CCK-8法检测阿帕替尼对乳腺癌MDA-MB-231细胞的增殖抑制作用将对数生长期的MDA-MB-231细胞接种于96孔板,接种浓度为4 000个/孔,待细胞贴壁后,每孔分别加入不同浓度(0~10 μmol/L)的阿帕替尼药液,继续培养48 h后,每孔加入10 μl的CCK-8溶液继续于培养箱孵育2 h,随后于多功能酶标仪450 nm波长处测量各孔吸光度(OD值),并计算各组细胞的细胞活力:细胞活力=OD实验组/OD对照组×100%。每组设8个复孔,实验重复3次。
1.4 Annexin V-FITC/PI双染法检测阿帕替尼对乳腺癌MDA-MB-231细胞凋亡的影响将对数生长期的MDA-MB-231细胞接种于6孔板,接种密度为3×105个/孔,待细胞贴壁后,每孔分别加入不同浓度(0~10 μmol/L)的阿帕替尼药液,继续培养48 h后,胰蛋白酶消化收集细胞,冷的PBS洗涤细胞2次后,重悬于100 μl的1×Annexin缓冲液中。随后每100 μl细胞样品加入5 μl的Annexin V及1 μl的PI,37℃水浴锅中避光孵育30 min后,再加入400 μl的1×Annexin缓冲液稀释,流式细胞仪检测各样本的细胞凋亡率。每组设置3个复孔,实验重复3次。
1.5 Western blot实验检测阿帕替尼对乳腺癌MDA-MB-231细胞Bcl-2及Bax表达的影响将对数生长期的MDA-MB-231细胞接种于6孔板,密度为5×105个/孔,待细胞贴壁后,每孔分别加入不同浓度(0~2.5 μmol/L)的阿帕替尼药液,继续培养48 h后采用RIPA裂解液裂解细胞,高速离心获得蛋白样品。随后采用Western blot法常规检测不同处理组Bcl-2及Bax的表达差异,通过计算灰度值计算各组中Bcl-2及Bax蛋白的相对表达情况。
1.6 阿帕替尼对乳腺癌MDA-MB-231细胞乳酸产量的影响不同浓度(0~10 μmol/L)的阿帕替尼药液作用于MDA-MB-231细胞24 h后,消化收集对数生长期的各组MDA-MB-231活细胞1×106万个,离心得到细胞沉淀。各组细胞样品分别加入150 μl的乳酸实验专用缓冲液后,对各组细胞样品进行超声破碎。参照试剂盒说明书对各组样品中的乳酸含量采用比色法检测,并根据标准曲线计算各组细胞样品中乳酸含量的绝对值。每组设置3个复孔,实验重复3次。
1.7 阿帕替尼对乳腺癌MDA-MB-231细胞外酸化速率的影响将对数生长期的MDA-MB-231细胞接种于24孔板,接种浓度为5×104个/孔,待细胞贴壁后,每孔分别加入不同浓度(0~10 μmol/L)的阿帕替尼药液,继续培养4 h后,将糖酵解压力试剂盒中的3种药物诱导剂分别加入加药板上的各加药孔中,其中葡萄糖、寡霉素及2-脱氧葡萄糖的使用浓度分别为10 mmol/L、1 μmol/L及50 mmol/L。随后采用细胞代谢分析仪检测各组细胞的细胞外酸化速率,并计算糖酵解能力值及糖酵解保留值。每组设置3个复孔,实验重复3次。
1.8 统计学方法采用SPSS19.0对数据进行分析,数据以均数±标准差(x±s)表示。组间数据差异性比较采用One-Way ANOVA法,P < 0.05为差异有统计学意义。
2 结果 2.1 阿帕替尼浓度依赖性地抑制乳腺癌MDA-MB-231细胞的增殖CCK-8法结果表明,阿帕替尼可浓度依赖性地抑制乳腺癌MDA-MB-231细胞的体外增殖(P=0.003),作用于MDA-MB-231细胞48 h时,阿帕替尼对MDA-MB-231细胞的半数抑制浓度IC50值约为1.56 μmol/L。此外,10 μmol/L的阿帕替尼作用于MDA-MB-231细胞48 h时,MDA-MB-231细胞存活率小于5%,见图 1。表明阿帕替尼是一种高效的乳腺癌细胞杀伤药物。
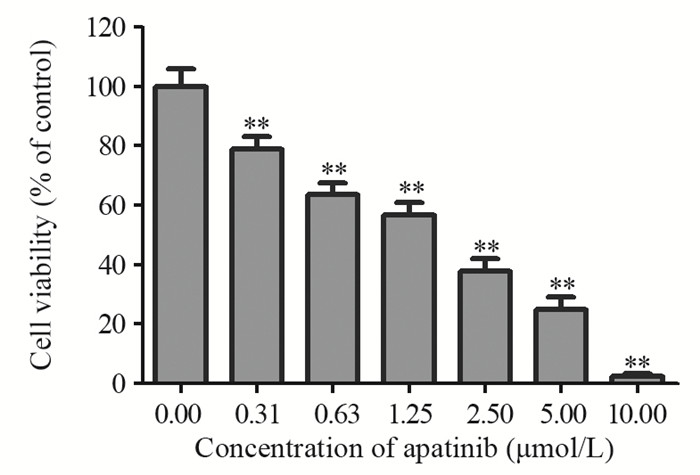
|
| **: P<0.05, compared with control group 图 1 阿帕替尼剂量依赖性地抑制人乳腺癌MDA-MB-231细胞增殖 Figure 1 Apatinib suppressed proliferation of breast cancer cell line MDA-MB-231 in a does-dependent manner |
AnnexinⅤ-FITC/PI双染结果表明,阿帕替尼可浓度依赖性地诱导乳腺癌MDA-MB-231细胞凋亡(P=0.001),见图 2、3。同时Western blot结果表明,阿帕替尼可增加MDA-MB-231细胞内促凋亡蛋白Bax的表达水平,下调抑凋亡蛋白Bcl-2的表达水平,见图 4。上述结果进一步验证了阿帕替尼体外抗乳腺癌的作用。
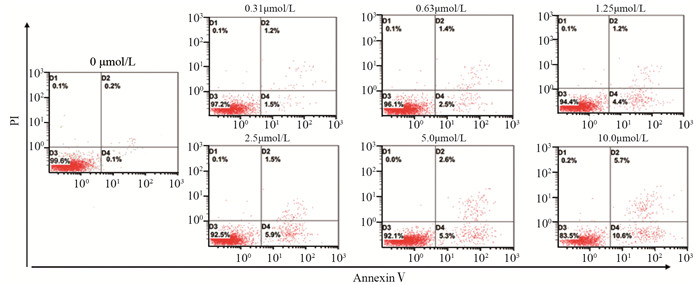
|
| 图 2 流式细胞术证实阿帕替尼诱导人乳腺癌MDA-MB-231细胞凋亡 Figure 2 Flow cytometry assay indicated that apatinib could induce apoptosis of breast cancer cell line MDA-MB-231 |
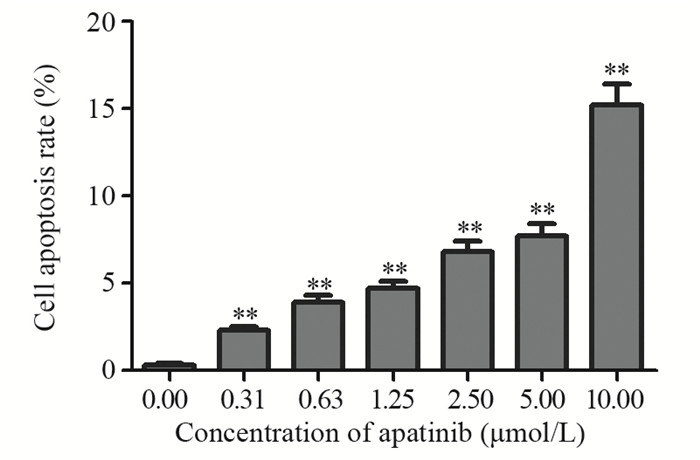
|
| **: P<0.05, compared with control group 图 3 阿帕替尼剂量依赖性地诱导人乳腺癌MDA-MB-231细胞的凋亡 Figure 3 Apatinib induced apoptosis of breast cancer cell line MDA-MB-231 in a does-dependent manner |

|
| 图 4 Western blot实验表明阿帕替尼诱导人乳腺癌MDAMB-231细胞的凋亡 Figure 4 Western blot assay indicated that apatinib could induce apoptosis of breast cancer cell line MDA-MB-231 |
比色法结果显示,阿帕替尼可浓度依赖性地降低乳腺癌MDA-MB-231细胞内乳酸产量(P=0.004),见图 5。
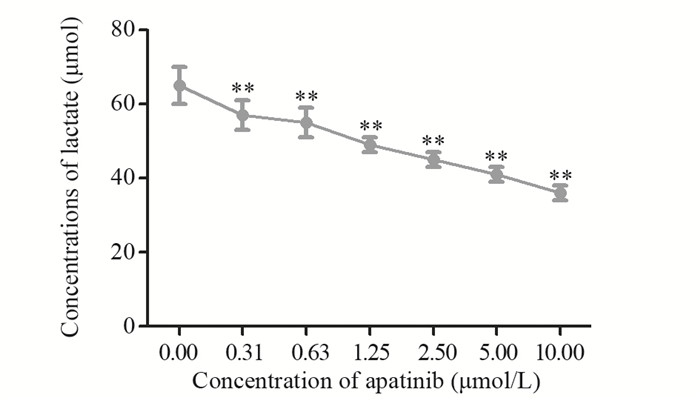
|
| **: P<0.05, compared with control group 图 5 阿帕替尼浓度依赖性地降低乳腺癌MDA-MB-231细胞内的乳酸产量 Figure 5 Apatinib significantly decreased lactate production in MDA-MB-231 cells in a does-dependent manner |
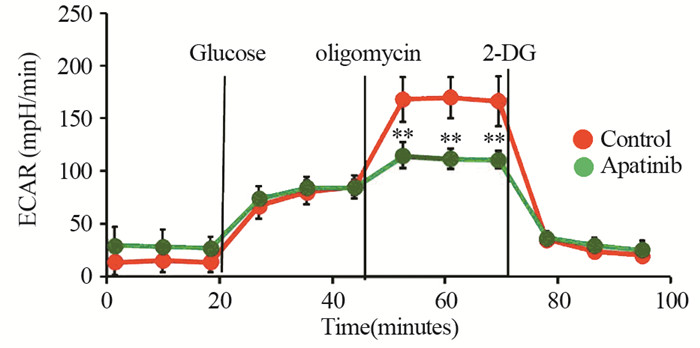
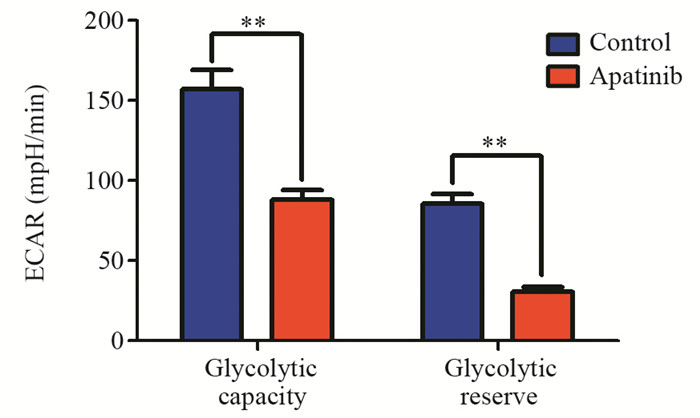
为进一步证实阿帕替尼对乳腺癌MDA-MB-231细胞有氧糖酵解活性的抑制作用,本研究进一步考察了阿帕替尼对乳腺癌MDA-MB-231细胞外酸化速率的影响,细胞代谢分析仪检测结果显示阿帕替尼可抑制由寡霉素激活的MDA-MB-231细胞的有氧糖酵解活性(P=0.006),见图 6。进一步对各糖酵解参数进行计算,阿帕替尼可抑制乳腺癌MDA-MB-231细胞糖酵解能力值及糖酵解储备值(P=0.003),见图 7。
|
| **: P<0.05, compared with control group 图 6 阿帕替尼抑制乳腺癌MDA-MB-231细胞酸化速率 Figure 6 Apatinib significantly decreased extracellular acidification rate (ECAR) in MDA-MB-231 cells |
|
| **: P<0.05, compared with control group 图 7 阿帕替尼抑制乳腺癌MDA-MB-231细胞糖酵解能力值及糖酵解储备值 Figure 7 Apatinib significantly decreased glycolytic capacity and glycolytic reserve of MDA-MB-231 cells |
乳腺癌的发病率及死亡率均居女性恶性肿瘤首位,严重威胁女性生命健康。据美国癌症协会估计,美国女性一生中罹患乳腺癌的概率约为八分之一。尽管自上世纪90年代起,乳腺癌早期筛查技术的发展、辅助化疗方案的应用、靶向药物和激素疗法联合干预,以及综合治疗体系的进步,乳腺癌死亡率下降了39%,但仍仅次于肺癌居女性肿瘤病因死亡率第二位[4]。因此,开发新的乳腺癌治疗药物或治疗策略对于乳腺癌的防治具有重要的临床意义及紧迫性。
阿帕替尼是一种小分子的、靶向血管内皮细胞生长因子受体的抗血管生成药物,已获批用于晚期胃癌的临床治疗。此外,药物临床试验结果表明阿帕替尼对于乳腺癌患者也具有较好的抗癌活性,且不良反应可控[5],因此有必要对阿帕替尼抑制乳腺癌的作用机制进一步深入研究。本研究发现阿帕替尼可浓度依赖性地抑制三阴性乳腺癌MDA-MB-231细胞的增殖,且起效浓度较低、活性较强,作用于MDA-MB-231细胞48 h时的半数抑制浓度约为1.56 μmol/L。此外,阿帕替尼可浓度依赖性地诱导乳腺癌MDA-MB-231细胞的凋亡,进一步验证了阿帕替尼的抗乳腺癌活性。能量代谢是肿瘤细胞各种恶性生物学行为改变的基础。为进一步考察阿帕替尼抗乳腺癌作用的分子机制,本研究首先证实了阿帕替尼可抑制乳腺癌MDA-MB-231细胞内糖代谢产物乳酸的产量。因乳酸产量增加是肿瘤细胞代谢表型有氧糖酵解效应的主要特征,本研究进一步通过实时检测乳腺癌MDA-MB-231细胞的细胞外酸化速率,证实了阿帕替尼可降低乳腺癌的糖酵解能力值及糖酵解储备值,进而抑制MDA-MB-231细胞的有氧糖酵解活性。肿瘤细胞主要特征之一为增殖加速,该过程意味着肿瘤细胞需要更多的能量供应以满足快速增殖的需要。因此,有异于正常细胞的主要供能方式线粒体呼吸,肿瘤细胞的能量代谢特征主要表现为糖酵解效应,即使在有氧条件下,肿瘤细胞也主要通过糖酵解的方式供能,以满足快速增殖所需的能量及中间代谢物[6]。鉴于正常细胞及肿瘤细胞能量代谢模式的差异性,调节肿瘤细胞的糖酵解表型可作为靶向肿瘤细胞治疗的潜在策略[7-8]。已有研究报道糖酵解抑制剂3-溴丙酮酸体内外水平均具有抗乳腺癌活性[9-10]。本研究结果表明阿帕替尼可能是一种潜在的糖酵解抑制剂,可能通过抑制乳腺癌细胞的糖酵解过程,进而发挥抗乳腺癌增殖的作用。
综上所述,阿帕替尼可能通过抑制乳腺癌MDA-MB-231细胞的有氧糖酵解活性,进而抑制细胞增殖,诱导细胞凋亡,发挥体外水平抗乳腺癌的作用,是一种有潜力的乳腺癌治疗药物。
作者贡献
张化芝:负责本实验实施及数据分析、论文写作
李晓双、郭晓烨、赵明池:参与实验实施及数据分析
| [1] | Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394–424. DOI:10.3322/caac.v68.6 |
| [2] | Siegel R L, Miller KD, Jemal A. Cancer statistics, 2016[J]. CA Cancer J Clin, 2016, 66(1): 7–30. DOI:10.3322/caac.21332 |
| [3] | Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115–32. DOI:10.3322/caac.21338 |
| [4] | DeSantis C, Ma J, Bryan L, et al. Breast cancer statistics, 2013[J]. CA Cancer J Clin, 2014, 64(1): 52–62. DOI:10.3322/caac.21203 |
| [5] | Hu X, Cao J, Hu W, et al. Multicenter phase Ⅱ study of apatinib in non-triple-negative metastatic breast cancer[J]. BMC Cancer, 2014, 14: 820. DOI:10.1186/1471-2407-14-820 |
| [6] | Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation[J]. Cell, 2011, 144(5): 646–74. DOI:10.1016/j.cell.2011.02.013 |
| [7] | Berthe A, Zaffino M, Muller C, et al. Protein N-glycosylation alteration and glycolysis inhibition both contribute to the antiproliferative action of 2-deoxyglucose in breast cancer cells[J]. Breast Cancer Res Treat, 2018, 171(3): 581–91. DOI:10.1007/s10549-018-4874-z |
| [8] | Jia L, Huang S, Yin X, et al. Quercetin suppresses the mobility of breast cancer by suppressing glycolysis through Akt-mTOR pathway mediated autophagy induction[J]. Life Sci, 2018, 208: 123–30. DOI:10.1016/j.lfs.2018.07.027 |
| [9] | Liu Z, Sun Y, Hong H, et al. 3-bromopyruvate enhanced daunorubicin-induced cytotoxicity involved in monocarboxylate transporter 1 in breast cancer cells[J]. Am J Cancer Res, 2015, 5(9): 2673–85. |
| [10] | Buijs M, Vossen JA, Geschwind JF, et al. Specificity of the anti-glycolytic activity of 3-bromopyruvate confirmed by FDG uptake in a rat model of breast cancer[J]. Invest New Drugs, 2009, 27(2): 120–3. DOI:10.1007/s10637-008-9145-0 |
 2019, Vol. 46
2019, Vol. 46
