文章信息
- 基因干预后胶质瘤A172细胞中HIF-1α和VEGF的表达
- Expression of HIF-1α and VEGF in Glioma A172 Cells After Gene Intervention
- 肿瘤防治研究, 2019, 46(6): 509-514
- Cancer Research on Prevention and Treatment, 2019, 46(6): 509-514
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.18.1401
- 收稿日期: 2018-09-26
- 修回日期: 2019-03-20
恶性肿瘤的增殖速度与新生血管的生成速度并不完全同步,导致恶性肿瘤内部存在缺氧环境[1]。缺氧是实体肿瘤的主要生长特性之一,与肿瘤的血管生成及侵袭转移等多种生物学行为密切相关[2]。缺氧诱导因子-1α(hypoxia induction factor-1α, HIF-1α)在肿瘤的缺氧调节中起着重要的纽带作用[3];血管内皮生长因子(vascular endothelial growth factor, VEGF)是血管内皮细胞特异性有丝分裂原,对血管的生成有着无可替代的作用,同时其受多种因素调控,缺氧组织的转录活化主要受HIF-1α调节。学者普遍认为:抑制肿瘤血管生成是颅内恶性肿瘤(如脑胶质瘤等)的分子治疗策略之一[4]。因此,应用精准医学原理,探索人脑胶质瘤基因治疗途径成为热点。本研究以胶质瘤A172细胞系为对象,通过体外构建CoCl2缺氧诱导模型,用基因抑制技术干预HIF-1α表达,进而观察胶质瘤A172细胞中,HIF-1α和VEGF表达的变化,探讨HIF-1α在缺氧激活胶质瘤血管生成调节中的作用。
1 材料与方法 1.1 材料胶质瘤A172细胞购于沈阳尚耀试剂公司,小牛血清购于MRC公司(产地:澳洲),CoCl2购于Macklin公司(上海),DAPI染料购于BOSTER公司(武汉),真核表达载体SpilencerTMnerU6 2.1购于Ambion公司(美国)。脂质体LipofectamineTM购于Invitrogen公司(美国),qPCR试剂盒购于TaKaRa公司(日本),HIF-1α抗体及VEGF抗体购于Abcam公司(美国)。
1.2 方法 1.2.1 细胞的培养传代将A172细胞株按要求进行复苏后接种于含10%小牛血清的DMEM培养基(37℃、5%CO2培养箱)培养,当细胞增殖至90%时,收集处于对数生长期的细胞进行传代,胰酶消化并PBS水洗三次,每次5 min。
1.2.2 建立细胞体外缺氧培养条件用生长良好、传代至3~5代的A172细胞,于含10%小牛血清的DMEM培养基(37℃、5%CO2培养箱)中培养,至细胞密度达60%加入CoCl2,终浓度为150 μmol/L构建体外缺氧培养模型。
1.2.3 荧光定量聚合酶链式反应(qPCR)检测mRNA表达A172细胞置于缺氧条件下培养,收集不同缺氧时相的培养细胞(0、8、16和24 h),TRIzol法提取总RNA。反转录反应体系(20 μl)组成为:RNA模板2 μl、ACCURT4×2 μl、DEPC水10 μl、ACCURT5×2 μl、5x-ALL-in-one Mix 4 μl。42℃ 50 min、85℃ 5 min灭活反转录酶。PCR引物序列由苏州吉玛基因公司构建,见表 1。PCR反应条件:50℃ 2 min、95℃ 2 min、95℃ 15 s、60℃ 40 s,循环40次。融解曲线:95℃ 15 s、60℃ 15 s、95℃ 15 s。2%琼脂糖凝胶电泳鉴定PCR产物。数码照相并行灰度值比色分析(Gel-pro Analyzer4.0分析软件)。
在GenBank上查找HIF-1α mRNA序列,参照文献[5]设计出针对HIF-1α进行RNAi作用的靶点:AAAGAGGTGGATATGTCTG GG,进行Blast基因同源性分析,以保证基因沉默的特异性,RNA Draw软件分析mRNA二级空间结构。根据siRNA靶位点,人工合成一对互补并编码短发夹状siRNA的寡核苷酸链(苏州吉玛基因公司)。将2 μl(1 μg/μl)正、反义寡核苷酸链等比混合,90℃ 3 min,缓慢冷却至37℃,培养1 h,退火形成发夹状siRNA DNA双链,双链两端含有BamHⅠ和HindⅢ酶切位点。用T4DNA连接酶将siRNA目的片段插入到Ambion公司提供的线性载体SpilencerTMnerU6 2.1的BamHⅠ和HindⅢ之间。重组体转化大肠杆菌DH5a,筛选Amp抗性克隆。提取质粒,测序法鉴定重组质粒。将构建的重组质粒命名为Psilencer2.1 HIF-1α。测序分析进行重组载体的鉴定。
1.2.5 免疫荧光(IF)法检测HIF-1α和VEGF蛋白表达胶质瘤A172细胞接种于6孔板中,每孔加500 μl细胞混液,待细胞长至60%时缺氧处理(0、8、16和24 h),每步操作中间均需PBS洗三次,每次5 min。4%多聚甲醛固定15 min,0.3%曲通打孔15 min,羊血清封闭2 h,HIF-1α一抗(0.1%)孵育过夜,兔二抗孵育2 h,VEGF一抗孵育2 h,鼠二抗孵育2 h,DAPI染核染料孵育2 h,荧光照相分析。
1.2.6 脂质体转染A172细胞转染前一天无双抗培养液接种细胞到6孔板中,待细胞长至50%开始转染。重组质粒经脂质体LipofectamineTM介导转染至A172细胞,经G418(200 u/ml)筛选得到抗性克隆,同时转染Psilencer2.1作为阴性对照。将重组质粒和阴性对照质粒转染筛选到的抗性克隆细胞,分别命名为A172/shRNAs-HIF和A172/shRNAs-HIF(neg)。转染完成5 h换正常培养液,缺氧培养24 h后,收集细胞做相关检测。
1.2.7 基因抑制效应测定未转染组、转染组和转染阴性组A172细胞缺氧培养24 h后分别进行免疫荧光检测、照相,并进行图像分析。如上述TRIzol法提取各组总RNA,行qPCR检测VEGF mRNA的表达情况。分别提取蛋白,Western blot法检测各组HIF-1α蛋白表达情况:Bradford法测定蛋白浓度,电泳样本以Loading Buffer:样品=1:3比例配制,于95℃~100℃水中煮沸5 min。样品离心,备用。浓缩胶的浓度为5%(丙烯酰胺(Acr)g/ml),分离胶的浓度为11%(丙烯酰胺(Acr)g/ml)。加入5 μl蛋白Marker,连通电极,调整电压80 V直到蛋白Marker的前沿到达分离胶与浓缩胶分界处。调整电压为120 V,电泳1 h,转膜(PVDF膜),BSA封闭液封闭2 h,加HIF-1α一抗4℃孵育过夜,PBS漂洗,兔二抗孵育2 h,TBST摇动洗膜3次,每次5 min或更长,去除残留的二抗。ECL化学发光试剂发光后,ECL检测系统(UVP, LLC, Upland, CA, USA)照相。同时采用qPCR法和ELISA双抗体夹心法检测VEGF蛋白表达情况。HIF-1α表达抑制率=(灰度值未转染组-灰度值转染组)/灰度值未转染组×100%;VEGF表达抑制率=(吸光度值未转染组-吸光度值转染组)/吸光度值未转染组×100%。
1.3 统计学方法采用SPSS13.0统计分析软件,配对组间比较采用t检验,多组间比较采用单因素方差分析。P < 0.05为差异有统计学意义。
2 结果 2.1 缺氧培养后A172细胞HIF-1α、VEGF mRNA的表达缺氧培养0、8、16和24 h后,qPCR检测结果显示,A172细胞内HIF-1α mRNA在常氧条件下有较高表达,并且与缺氧培养时间的长短无明显关系(P > 0.05),见图 1A;VEGF mRNA在常氧条件下有少量表达,而在缺氧后显著升高,与常氧组(0 h)相比,缺氧8、16和24 h后,VEGF mRNA的表达分别提高了4.65、6.86和8.72倍(P=0.002),各缺氧组之间VEGF mRNA的表达差异有统计学意义(P=0.032),见图 1B,表明缺氧诱导VEGF转录水平持续升高。
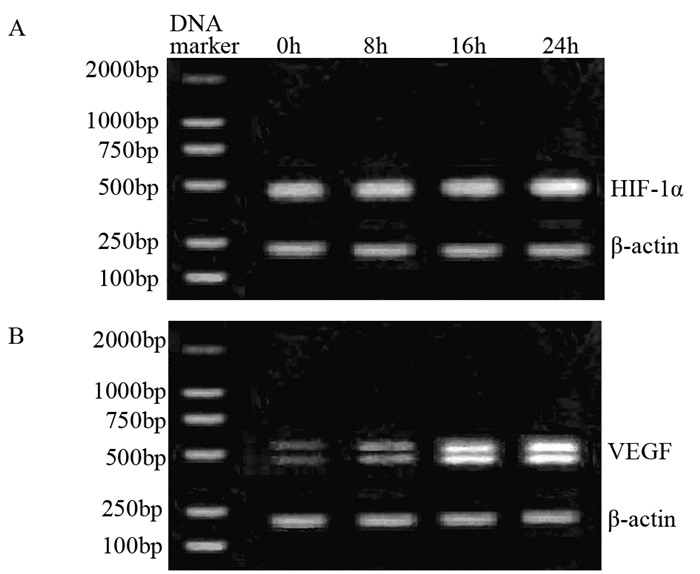
|
| 图 1 qPCR法检测缺氧环境下A172细胞HIF-1α(A)和VEGF(B) mRNA表达情况 Figure 1 HIF-1α(A) and VEGF(B) mRNA expression in A172 cells under hypoxia detected by qPCR |
荧光显微镜下可见常氧环境下(0 h)A172细胞HIF-1α蛋白极其少量表达,缺氧状态下HIF-1α蛋白表达则显著增多,可见强阳性的绿色颗粒定位于细胞核;同时,常氧条件下A172细胞VEGF蛋白表达为弱阳性。缺氧作用8、16和24 h后,VEGF蛋白表达量也明显增强,可见棕红色颗粒定位于细胞质,见图 2。

|
| 图 2 免疫荧光染色检测缺氧培养后A172细胞HIF-1α和VEGF蛋白表达情况(SP ×200) Figure 2 Expression of HIF-1α and VEGF proteins in A172 cells cultured in hypoxia detected by immunofluorescence staining (SP ×200) |
结果表明,将重组质粒Psilencer2.1 HIF-1α进行测序分析,证实已将针对HIF-1α mRNA序列设计的寡核苷酸双链克隆入Psilencer2.1真核表达载体,重组质粒构建成功,符合预期设计,能够表达短发夹状siRNA。
2.4 基因干预后VEGF mRNA表达水平的变化以qPCR目的产物与内参照的灰度值比值进行比较分析,结果显示:A172细胞转染重组质粒Psilencer2.1 HIF-1α之后(转染组),缺氧培养24 h,细胞中VEGF mRNA表达水平明显受到抑制,抑制率为81.5%(P=0.033),而转染阴性组(shRNAs-HIF(neg))与未转染组之间差异无统计学意义(P > 0.05),见图 3。
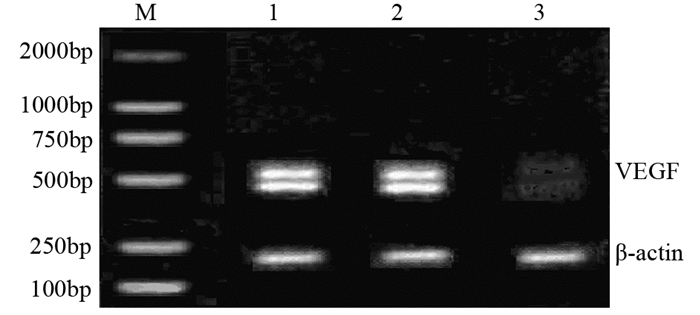
|
| M: DNA marker; 1: untransfected group; 2: Transfection negative group (shRNAs-HIF(neg)); 3: Transfection group(shRNAs-HIF) 图 3 qPCR法检测基因干预后A172细胞VEGF mRNA表达量变化 Figure 3 VEGF mRNA expression in A172 cells detected by qPCR after gene intervention |
与未转染组比较,转染组缺氧处理24 h后,HIF-1α和VEGF蛋白表达显著减少,而未转染组和转染阴性组之间差异无统计学意义,见图 4。
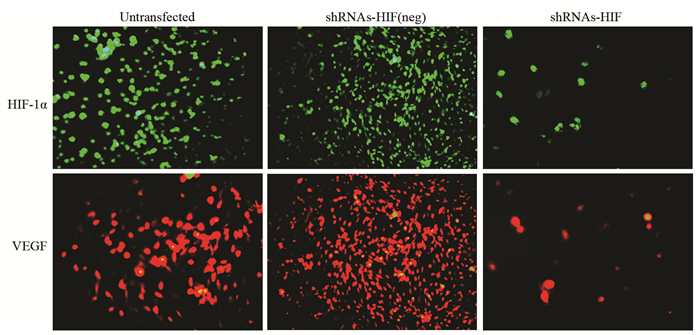
|
| 图 4 免疫荧光染色检测基因干预后A172细胞HIF-1α、VEGF蛋白表达量变化(SP×200) Figure 4 Changes of HIF-1α and VEGF protein expression in A172 cells after gene intervention detected by immunofluorescence staining (SP×200) |
基因干预后缺氧培养24 h,HIF-1α蛋白表达量明显下调,与未转染组灰度值比较其表达抑制率为86.3%(P=0.030),而未转染组和转染阴性组之间差异无统计学意义,见图 5。
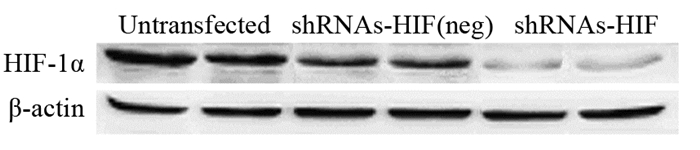
|
| 图 5 Western blot法检测基因干预后A172细胞HIF-1α蛋白表达量变化 Figure 5 HIF-1α protein expression in A172 cells after gene intervention detected by Western blot |
未转染组、转染阴性组和转染组细胞培养上清液中VEGF蛋白检测吸光度值分别为:1.85±0.07、1.90±0.05和0.40±0.04,蛋白表达抑制率为78.9%(P=0.002),说明转染组细胞培养上清液中VEGF蛋白表达量明显下调。
3 讨论人脑胶质瘤是神经外科最常见的恶性肿瘤,也是血管化程度最高的实体肿瘤之一,其可呈浸润生长,与正常脑组织界限不清难以完全切除,且对放、化疗不敏感,极易复发,具有典型的“三高一低”(高发病率、高复发率、高病死率、低治愈率)的特征[6]。目前胶质瘤的临床治疗仍以外科手术结合放、化疗的综合治疗为主,但治疗效果并不理想,其中位生存期不超过一年[7]。随着分子生物医学技术的迅猛发展,生物靶向治疗正逐步成为胶质瘤治疗的主要研究方向。作为生长迅速的实体肿瘤,胶质瘤生长到一定体积时,肿瘤细胞内便处于缺氧微环境,为了维持肿瘤的持续生长,必须依赖新生血管的形成,抑制肿瘤血管生成则可有利于阻止肿瘤的生长与侵袭转移。因此,利用基因干预靶向抑制肿瘤血管生成治疗或可为临床胶质瘤治疗开辟一条新途径。
在血管生成的过程中,VEGF被认为是一个最主要的调节因子,能促进内皮细胞的增殖和转移。有研究表明,缺氧环境中肿瘤细胞VEGF的合成可以增加十余倍。Liu等[8]研究最早表明缺氧导致肿瘤VEGF高表达,主要是通过一种被称为缺氧诱导因子(HIF-1)的核转录因子实现的。缺氧诱导因子自1992年发现至今,已被证实广泛存在于人和哺乳动物细胞内,为介导细胞缺氧环境下适应性变化的细胞因子[9],是一种DNA结合蛋白,是在所有缺氧转录过程中缺氧信息传递的共同通路[10]。HIF-1生物结构上是由HIF-1α和HIF-1β两个亚单位组成,其中HIF-1α是其功能亚基,决定其转录活性的表达水平和稳定性,其表达受氧分压调控。氯化钴模拟缺氧的机制是钴可替代亚铁螯合于血红蛋白中,损伤细胞对氧的感受,能在体外培养的细胞中产生类似缺氧状态,细胞对氯化钴刺激和缺氧刺激具有相同的氧感受、信号转导和转录调节机制,因此氯化钴模拟的体外实验与体内缺氧状态下的研究结果具有很强的可比性[11]。
缺氧是肿瘤微环境的一种病理生理特征,是肿瘤血管生成的主要刺激因子。对于HIF-1α激活的分子机制,虽然有部份学者认为缺氧在转录水平调控HIF-1α[12],但大多数学者认为缺氧是转录后蛋白水平对HIF-1α进行调控,本研究结果显示:在体外缺氧条件下,胶质瘤A172细胞HIF-1α mRNA水平的表达无论是缺氧还是常氧下差异无显著性,而蛋白水平表达在缺氧后显著提高,证明缺氧是在转录后蛋白水平对HIF-1α进行调控的。
VEGF是促进肿瘤血管生成的关键刺激因子,几乎参与了肿瘤血管生成的每个环节[13]。VEGF是HIF-1α的下游调控基因,是促进新生血管生成重要的细胞因子之一。VEGF自1989年发现以来,已被证实与血管生成密切相关,高度保守的同源二聚体糖蛋白,由两条分子量各为24 kDa的单链以二硫键组成二聚体。VEGF分解的单体无活性,去除N2糖基对生物效应无影响,但可能在细胞分泌中起作用。目前已知VEGF至少有VEGF121、VEGF145、VEGF165、VEGF185、VEGF206五种蛋白形式,其中VEGF121、VEGF145、VEGF165是分泌型可溶性蛋白,能直接作用于血管内皮细胞促进血管内皮增殖,增加血管通透性[14]。正常情况下VEGF表达状态平衡,与其他相关因子共同调控血液供应,恶性肿瘤高速生长,导致内部缺氧环境刺激HIF-1α表达,促进VEGF表达上调,打破血管生成因子与抑制因子的平衡,使肿瘤血管增多。符黄德等[15]对VEGF的表达与肿瘤血管密度的相关性进行了报道,本研究免疫荧光染色结果也证实:HIF-1α与VEGF的表达具有一致性。同时,qPCR和免疫荧光染色结果显示:缺氧处理后VEGF在mRNA和蛋白水平的表达都有显著提高,提示缺氧是促进胶质瘤中VEGF生成、肿瘤血管网新生的重要因素。胶质瘤必然存在一种转录水平的激活机制来调控VEGF生成,本实验结果显示:HIF-1α蛋白水平表达明显被抑制,抑制率达86.3%,基本达到基因抑制效果。同时通过qPCR和ELISA法检测发现在HIF-1α抑制后,A172细胞VEGF mRNA表达明显抑制,抑制率为81.5%、VEGF蛋白表达水平也显著下调。反过来说明HIF-1α是通过转录激活途径参与缺氧诱导A172细胞VEGF的生成。
综上所述,本文的各项实验结果初步证实:(1)与许多实体肿瘤一样,胶质瘤细胞也存在缺氧耐受的分子机制,提高了肿瘤在缺氧环境中的生存能力和新生血管的生成;(2)HIF-1α为调控VEGF分泌的重要因素,且是在蛋白表达水平进行调控。
目前,针对肿瘤的治疗方法有不少报道,尤其是抑制VEGF基因表达的研究,作为抗血管生成基因治疗,HIF-1α应该是最佳基因位点之一[16]。但是肿瘤血管生成是一个复杂的过程,调控因素甚多,尚需进行深入研究以明确其他一些血管生成因子在肿瘤血管形成中的作用,以便于针对HIF-1α/VEGF通路的抗癌基因治疗策略的实现。
作者贡献
李钦:实验设计与实施,相关资料、数据的收集和统计分析,论文撰写与修改
邱建武:指导实验设计和实施,审核相关数据和资料,指导论文撰写与修改
| [1] | Louis DN, Perry A, Reifenberger G, et al. The 2016 world health organization classification of tumors of the central nervous system: a summary[J]. Acta Neuropathol, 2016, 131(6): 803–20. DOI:10.1007/s00401-016-1545-1 |
| [2] | 王理, 施维, 薛均, 等. 缺氧诱导因子1α异常表达对肝细胞癌血管生成的调控作用[J]. 临床肝胆病杂志, 2017, 33(2): 369–74. [ Wang L, Shi W, Xue J, et al. Regulatory effect of abnormal expression of hypoxia-inducible factor-1α on angiogenesis in hepatocellular carcinoma[J]. Lin Chuang Gan Dan Bing Za Zhi, 2017, 33(2): 369–74. DOI:10.3969/j.issn.1001-5256.2017.02.037 ] |
| [3] | 邓碧凡, 廖敏, 邱荣敏, 等. 缺氧对喉癌Hep-2细胞HIF-1α、GLUT-1、MMP-2表达的影响[J]. 肿瘤防治研究, 2016, 43(8): 663–7. [ Deng BF, Liao M, Qiu RM, et al. Effect of hypoxia on expression of HIF-1α, GLUT-1 and MMP-2 in laryngeal carcinoma cell line Hep-2[J]. Zhong Liu Fang Zhi Yan Jiu, 2016, 43(8): 663–7. DOI:10.3971/j.issn.1000-8578.2016.08.003 ] |
| [4] | Weis SM, Cheres DA. Tumor angiogenesis:molecular pathways and theraeutic targets[J]. Nat Med, 2011, 17(11): 1359–70. DOI:10.1038/nm.2537 |
| [5] | Krishnamachary B, Breg-Dixon S, Kelly B, et al. Regulation of colon carcinoma cell invasion by hypoxia-inducible factor 1[J]. Cancer Res, 2003, 63(5): 1138–43. |
| [6] | Omuro A, DeAngelis LM. Glioblastama and other malignant gliomas: a clinical review[J]. JAMA, 2013, 310(17): 1842–50. DOI:10.1001/jama.2013.280319 |
| [7] | 陈彩霞, 蔡军, 魏晓霞, 等. 人脑胶质瘤中Smad-1、Smad-2和Smad-4的表达及意义[J]. 肿瘤防治研究, 2014, 41(1): 22–6. [ Chen CX, Cai J, Wei XX, et al. Expression and significance of Smad-1, Smad-2 and Smad-4 in human glioma[J]. Zhong Liu Fang Zhi Yan Jiu, 2014, 41(1): 22–6. DOI:10.3971/j.issn.1000-8578.2014.01.006 ] |
| [8] | Liu Y, Cox SR, Morita T, et al. Hypoxia regulates vascular endothelial growth factor gene expression in endothelial cells.Identification of a 5, enhancer[J]. Circ Res, 1995, 77(3): 638–43. DOI:10.1161/01.RES.77.3.638 |
| [9] | 谢韬, 金法, 姜晓丹, 等. 缺氧微环境对胶质瘤细胞U251迁移性的影响[J]. 医学分子生物学杂志, 2016, 13(1): 21–6. [ Xie T, Jin F, Jiang XD, et al. Effect of hypoxic microenvironment on the invasiveness of U251 human glioma cell[J]. Yi Xue Fen Zi Sheng Wu Xue Za Zhi, 2016, 13(1): 21–6. DOI:10.3870/j.issn.1672-8009.2016.01.005 ] |
| [10] | 姚青, 李筠, 张鹏, 等. 缺氧诱导因子-1和缺氧诱导因子-2:结构、功能及调节[J]. 生命科学, 2011, 23(8): 753–61. [ Yao Q, Li J, Zhang P, et al. Hypoxia inducible factor(HIF)-1 and -2: structure, function, and regulation[J]. Sheng Ming Ke Xue, 2011, 23(8): 753–61. ] |
| [11] | Goldberg MA, Schneider TJ. Similarities between the oxygerrsensing mechanisms regulating the expression of vascular endothelial growth factor and erythropoietin[J]. J Biol Chem, 1994, 269(6): 4355–9. |
| [12] | Zhong H, Agani F, Baccala AA, et al. Increased expression of hypoxia inducible factorlalpha in rat and human prostate cancer[J]. Cancer Res, 1998, 58(23): 5280–4. |
| [13] | Shibuya M. Vascular endothelial growth factor and its receptor system: physiological functions in angiogenesis and pathological roles in various diseases[J]. J Biochem, 2013, 153(1): 13–9. DOI:10.1093/jb/mvs136 |
| [14] | 李良, 董勤, 王茂春. VEGF与肿瘤关系研究进展[J]. 内蒙古医学杂志, 2010, 42(9): 1072–5. [ Li L, Dong Q, Wang MC. The relationship between VEGF and Tumor research[J]. Neimenggu Yi Xue Za Zhi, 2010, 42(9): 1072–5. DOI:10.3969/j.issn.1004-0951.2010.09.019 ] |
| [15] | 符黄德, 罗起胜, 邓元央, 等. 肝癌衍生生长因子和血管内皮生长因子在脑胶质瘤中的表达及其与肿瘤微血管密度的相关性研究[J]. 中国全科医学, 2016, 19(17): 2019–23. [ Fu HD, Luo QS, Deng YY, et al. Expression of hepatoma-derived growth factor and vascular endothelial growth factor and their correlation with tumor microvessel density in gliomas[J]. Zhangguo Quan Ke Yi Xue, 2016, 19(17): 2019–23. DOI:10.3969/j.issn.1007-9572.2016.17.011 ] |
| [16] | 曾伟, 张建国. siRNA沉默Hif-1α在缺氧状态下对鼻咽癌细胞VEGF表达的影响[J]. 现代中西医结合杂志, 2009, 18(21): 2499–502, 505. [ Zeng W, Zhang JG. Influence of silencing HIF-1α by siRNA on expression of vascular endothelial growth factor in nasopharyngeal carcinoma cell under hypoxia[J]. Xiandai Zhong Xi Yi Jie He Za Zhi, 2009, 18(21): 2499–502, 505. DOI:10.3969/j.issn.1008-8849.2009.21.005 ] |
 2019, Vol. 46
2019, Vol. 46



