文章信息
- 不同表观扩散系数对前列腺癌盆腔转移性淋巴结的定性诊断价值
- Qualitative Diagnostic Value of Different Apparent Diffusion Coefficients on Metastatic Pelvic Lymph Nodes in Prostate Cancer
- 肿瘤防治研究, 2019, 46(3): 248-252
- Cancer Research on Prevention and Treatment, 2019, 46(3): 248-252
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.18.1393
- 收稿日期: 2018-09-25
- 修回日期: 2018-12-14
前列腺癌患者行根治性切除术时,往往需要进行盆腔淋巴结清扫,以达到有效清除盆腔内淋巴结转移灶、减少术后不良预后风险的目的[1-4]。因此,术前准确判断前列腺癌盆腔肿大淋巴结的性质,能为前列腺癌临床分级以及手术清扫范围提供参考依据,有效避免不必要的手术创伤,减少手术时间和手术并发症,改善患者预后水平。磁共振扩散加权成像(diffusion weighted imaging, DWI)可以通过监测活体组织水分子的扩散受限情况,并通过表观扩散系数(apparent diffusion coefficient, ADC)值进行定量分析,继而进一步反映组织细胞的致密性及增殖情况,对宫颈癌[5]、子宫内膜癌[6]、直肠癌[7]等盆腔肿瘤的淋巴结转移情况具有较高的诊断价值。然而,DWI对前列腺癌盆腔淋巴结的应用鲜有文献报道,且不同测量方法获取到的ADC值对淋巴结的定性诊断效能又不尽一致。因此,本研究试图探讨不同ADC值对前列腺癌盆腔转移淋巴结的诊断价值,为ADC值的最优化应用提供参考依据。
1 资料与方法 1.1 盆腔转移性淋巴结与炎性淋巴结前列腺癌患者的基线资料本研究入组的前列腺癌患者共计58例,年龄54(45~81)岁;以血清PSA、Gleason评分进行前列腺癌危险因素分级,分为低危组9例、中危组16例、高危组33例;以术后盆腔清扫淋巴结病理结果为金标准,包括炎性淋巴结22枚、转移性淋巴结47枚。
1.2 入组标准对2012年1月—2018年1月湖北医药学院附属人民医院收治的前列腺癌患者进行回顾性分析。纳入标准:(1)患者磁共振扫描序列中包括MR-DWI;(2)患者行前列腺癌根治术并进行盆腔淋巴结清扫;(3)磁共振检查时间与手术时间间隔不超过14天。排除标准:(1)患者术前行前列腺癌放化疗等;(2)患者合并其他恶性肿瘤;(3)影像学资料不齐全或质量不合格。
1.3 磁共振扫描采用1.5T磁共振进行前列腺及盆腔扫描。检查开始时,患者取仰卧位,使用腹部相控线圈,扫描范围从腹主动脉分叉处至耻骨联合下缘。常规MR进行冠状位与轴位扫描,扫描参数如下:FOV=20 cm×20 cm,层厚/层间距=3 mm/0.5 mm,NEX=4。轴位FSE T1WI,TE/TR=12 ms/460 ms;FRFSE T2WI,TE/TR=86 ms/3500 ms。MR-DWI扫描:FOV 24 cm×24 cm,层厚/层间距=3 mm/1 mm,TE/TR=50 ms/3 000 ms;b值取0、800 s/mm2。
1.4 盆腔淋巴结定位及清扫前列腺癌患者行扩大分区盆腔淋巴结清扫术,将盆腔淋巴结划分为5个组9分区:髂内组(右侧为Ⅲ区,左侧为Ⅷ区);髂外组(右侧为Ⅰ区,左侧为Ⅵ区);髂总组(右侧为Ⅱ区,左侧为Ⅶ区);闭孔组(右侧为Ⅳ区,左侧为Ⅸ区);骶前组(即Ⅴ区)[8]。手术清扫过程中参照术前磁共振扫描获得的盆腔淋巴结图谱,并进行同号标记,以确保术前磁共振淋巴结图谱与手术清扫淋巴结的一致性。
1.5 ADC值的测量所有图像自动导入系统后,生成ADC图。分别由两名10年以上盆腔影像学诊断经验的放射科医师在ADC图上进行测量,测量淋巴结的短径范围限定在 > 1 cm,以减少MR-DWI部分容积效应造成的几何失真。测量方法主要包括:(1)局部测量法(partial measurement),即取一个大小为15 mm2的感兴趣区(Region of interest, ROI),在淋巴结上进行3次随机放置,每次放置保持ROI大小一致,以3次ROI均值作为ADCpartial值;(2)整体测量法(overall measurement),对照常规MR,选取最佳测量层面,沿着淋巴结边缘进行ROI勾画,以获取ADCoverall值,见图 1、2。以上操作过程均由两名高年资放射科医师在不同的时间段完成,以避免回忆偏倚,取两名医师测量的均值作为最终研究所需的ADCpartial或ADCoverall值。
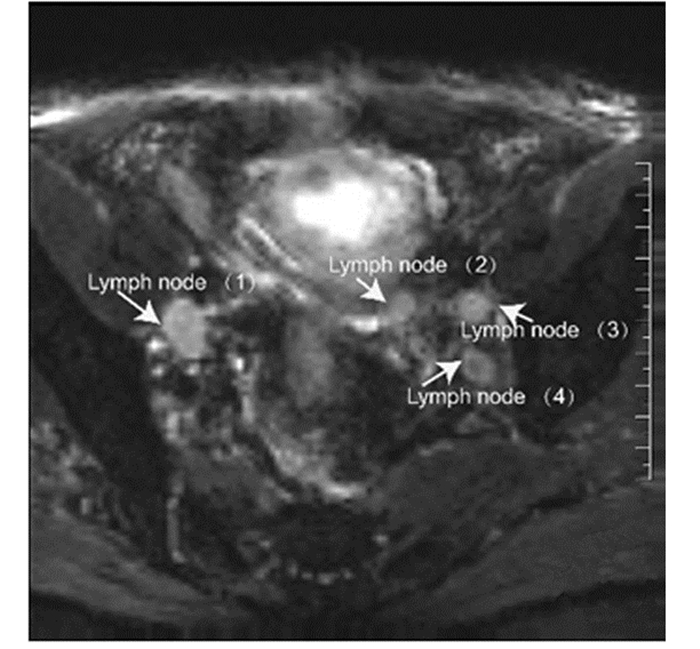
|
| Pathological findings suggest that lymph node (1) was metastatic lymph node and Lymph node (2-4) were inflammatory lymph node 图 1 前列腺癌盆腔淋巴结磁共振扩散加权成像(DWI)图 Figure 1 DWI image of pelvic lymph nodes in prostate cancer |
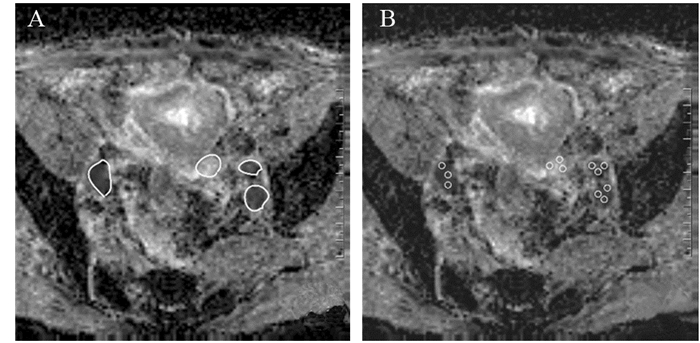
|
| A: the method of ADCoverall; B: the method of ADCpartial 图 2 前列腺癌盆腔淋巴结表观扩散系数(ADC)图 Figure 2 ADC images of pelvic lymph nodes of prostate cancer |
计量资料用(x±s)表示。使用SPSS17.0软件包,以Kolmogorov-Smirnov D法对计量资料进行正态性分布检验;组内相关系数(intraclass correlation coefficient, ICC)对两名医师的测量结果进行重复性检验;独立样本t检验对良恶性淋巴结的ADCpartial或ADCoverall值进行差异性检验。使用MedCalc V13.0.2.0软件包,以Bland-Altman法对ADCpartial或ADCoverall值的测量结果进行一致性检验;受试者工作曲线(receiver operating curve,ROC)进行诊断效能分析,并进行非参数比较。以上均以P < 0.05为差异有统计学意义。
2 结果 2.1 两名医师测量结果的重复性分析ADCpartial值两名医师测量结果的ICC为0.925(P < 0.001);ADCoverall值两名医师测量结果的ICC为0.974(P < 0.001)。该结果显示,ADCpartial值与ADCoverall值测量结果具有较高的重复性,且ADCpartial值低于ADCoverall值,表明两种测量方法获取的测量结果较稳定。
2.2 ADCpartial值与ADCoverall值的一致性分析ADCpartial值与ADCoverall值的Bland-Altman结果见图 3。可以看出,ADCpartial值与ADCoverall值的差值均数为0.011×10-3 mm2/s,差值的标准差为0.098;两者的95%一致性界限(95% limits of agreement, 95%LoA)为(-0.180~0.203)×10-3 mm2/s;且存在8.7%(6/69)在95%LoA之外(超过5%),说明其一致性较差,提示ADCpartial与ADCoverall是淋巴结ADC值的两种不同测量方法,不能相互替代。
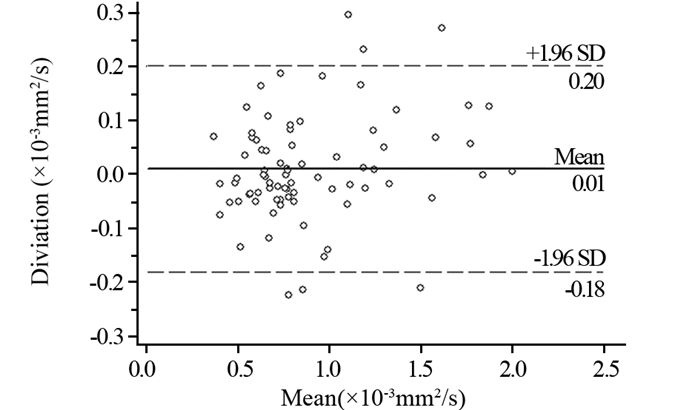
|
| Solid line: the mean difference between the two sets of data; Dotted line: the upper and lower limits of 95% LoA 图 3 ADCpartial值与ADCoverall值的Bland-Altman结果 Figure 3 Bland-Altman results of ADCpartial and ADCoverall values |
ADCpartial值与ADCoverall值均符合正态分布。转移性淋巴结的ADCpartial值与ADCoverall值均低于炎性淋巴结,差异均有统计学意义(t=7.164, P < 0.001; t=8.862, P < 0.001),见表 1。

|
ROC曲线分析结果显示:取ADCpartial值=0.836×10-3mm2/s作为最佳诊断阈值时,对应的敏感度、特异性以及曲线下面积分别为82.98%、90.91%以及0.927;取ADCoverall值=0.952×10-3 mm2/s作为最佳诊断阈值时,对应的敏感度、特异性以及曲线下面积分别为89.36%、95.45%以及0.962。两种测量方法的诊断效能对比分析表明:ADCpartial值对前列腺癌盆腔转移性淋巴结的诊断效能低于ADCoverall值(Z=2.013, P=0.044),见图 4。

|
| The diagnostic efficiency of ADCpartial value was lower than that of ADCoverall value 图 4 ADCpartial值与ADCoverall值对前列腺癌盆腔转移性淋巴结的ROC曲线分析 Figure 4 ROC curves of metastatic pelvic lymph nodes in prostate cancer with ADCpartial values and ADCoverall values |
前列腺癌具有较高的盆腔淋巴结转移倾向,当淋巴结转移高度可疑时,此时的治疗方案应选择前列腺癌根治性切除术加扩大分区盆腔淋巴结清扫术:若术中清扫出的淋巴结病理结果为转移性淋巴结,此类患者应辅以术后激素治疗;而不存在转移淋巴结患者则术后定期复查PSA即可[9-10]。有研究指出[11-12]:随着盆腔淋巴结清扫范围的扩大,清扫出转移性淋巴结的概率越高,患者的5、10年生存率及无瘤生存率等预后结局也将得到更大的改善。然而,盲目扩大术中淋巴结清扫范围,无疑会增加手术时间以及手术损伤范围,导致手术并发症增多,制约了患者的预后。有鉴于此,术前准确判断出前列腺癌患者盆腔淋巴结性质,提高对转移淋巴结的无创性影像学诊断,对患者治疗方案的制定以及术后并发症和不良预后的改善有着重要意义。
3.2 MR-DWI对淋巴结定性诊断的意义MR-DWI是近年来兴起的一项功能磁共振成像序列,能够反映组织细胞微观水分子扩散情况,并且通过ADC值进行定量分析。病理状态下水分子所处微环境发生变化时,活体水分子的扩散属性随之发生相应改变:淋巴结若存在癌细胞的转移侵袭时,由于肿瘤细胞的恶性增殖,使得细胞致密性更大、核质比更高,故而水分子受限更加显著,造成ADC值的降低。既往研究指出:ADC值对宫颈癌[4]、子宫内膜癌[5]、直肠癌[6]等盆腔肿瘤的淋巴结转移情况具有较高的诊断价值,且表现为转移性淋巴结ADC值低于非转移性淋巴结的趋势。
然而,在ADC值的实际测量过程中,由于测量者的主观性、ROI区域或大小的选择以及肿瘤异质性造成测量病灶的不均质等因素,都有可能造成测量结果的偏差,因此选择最佳的ADC值测量方法对提高ADC值的诊断价值是很有意义的[13-14]。本研究通过对淋巴结进行3个ROI平均局部取值获取的ADCpartial值以及沿病灶边缘整体取值获取的ADCoverall值进行一致性比较分析,Bland-Altman结果显示:两种测量方法的一致性较差,存在8.7%(6/69)在95%LoA之外(超过5%)。此研究结果可以从Bland-Altman的基本思想进行解释:Bland-Altman的基本思想在于计算两种定量测量结果差值的95%LoA,如果散点图中的点位于一致性范围内占比所有点的95%以内,少于5%的点在一致性范围外,则认为两种方法一致性较好,能够相互替换[15]。反之,本研究所得出的两种方法一致性较差,超过5%的点位于散点图界定范围外,故可以认为ADCpartial与ADCoverall是淋巴结ADC值的两种不同测量方法,不能相互替代。
本研究进一步对两者的诊断效能进行分析,结果显示,ADC值对鉴别前列腺癌盆腔转移性淋巴结与非转移性淋巴结有较高的诊断价值,接近于ADC值在宫颈癌、子宫内膜癌、直肠癌等其他恶性肿瘤盆腔转移淋巴结定性诊断的报道[4-6]。此外,在探讨具体的ADC值测量方法时,ADCoverall值对前列腺癌盆腔转移性淋巴结的检出价值优于ADCpartial值,与之前类似文献报道结果相仿,即整体层面法测量ADC值的诊断效能优于传统3点局部法[13-14]。我们对既往文献[4, 13-14]进行综合分析,认为其原因可能是:(1)由于转移淋巴结肿瘤细胞的生物学异构性,可能造成淋巴结组织结构上并非完全被肿瘤组织所替代,尚有残存淋巴结的存在。因此,在实际测量此类淋巴结ADC值时,传统的3点法选取ROI(即ADCpartial)难以准确反映淋巴结受肿瘤转移部位、造成测量结果的偏差;(2)转移性淋巴结的肿瘤细胞生物学异构性、病变区域的坏死、黏液等因素均容易导致ADC值分布不均匀,不同区域ADC值存在一定的差异性,干扰了ADCpartial值;(3)鉴于以上存在的客观因素,测量者用ADCpartial值难以准确反映转移淋巴结肿瘤细胞真实聚集区域,造成测量结果不够客观,降低了转移性淋巴结与非转移性淋巴结的可比性;而测量者通过对整个淋巴结最佳层面进行ROI勾画时(即ADCoverall),能够很好地避免人为主观因素的干扰,更接近于反映淋巴结整体的水分子受限情况。本研究结果亦表明,ADCpartial的ICC值低于ADCoverall,更进一步证明了ADCoverall值的稳定性,重复性更强。
3.3 小结综上所述,MR-DWI对前列腺癌盆腔淋巴结转移的定性诊断具有较大的应用价值,并且能够通过ADC值对病变淋巴结水分子扩散受限程度进行定量分析。ADCpartial与ADCoverall是淋巴结ADC值的两种不同测量方法,以病灶最佳层面整体法测量的ADCoverall值具有可重复性强、稳定性好的优势,故而能进一步反映组织病理状态,鉴别前列腺癌盆腔转移性淋巴结与非转移性淋巴结的诊断效能更优。
本研究的局限性在于:为减少MR-DWI部分容积效应造成的几何失真,本研究所纳入的淋巴结短径在1 cm以上,可能会导致选择偏倚;此外,为追求临床实用性,本研究引入的ADCpartial与ADCoverall均是在病灶二维层面进行ADC值的测量,尚缺乏对全容积层面淋巴结的进一步研究。最后,本研究入组的病例数较少,且为单中心研究,在其他机构进行类似研究时,其结果可能存在小范围的偏差。
作者贡献
周 霖:病例收集、数据整理、分析与论文撰写
曾 蕾:临床实验构思与设计,论文整理与修改
| [1] | Kryvenko ON, Gupta NS, Virani N, et al. Gleason score 7 adenocarcinoma of the prostate with lymph node metastases:analysis of 184 radical prostatectomy specimens[J]. Arch Pathol Lab Med, 2013, 137(5): 610–7. DOI:10.5858/arpa.2012-0128-OA |
| [2] | Chen MK, Luo Y, Zhang H, et al. Laparoscopic radical prostatectomy plus extended lymph nodes dissection; for cases with non-extra node metastatic prostate cancer:5-year; experience in a single Chinese institution[J]. J Cancer Res Clin Oncol, 2013, 139(5): 871–8. DOI:10.1007/s00432-013-1395-3 |
| [3] | Tollefson MK, Karnes RJ, Rangel LJ, et al. The impact of clinical stage on prostate cancer survival following radical prostatectomy[J]. J Urol, 2013, 189(5): 1707–12. DOI:10.1016/j.juro.2012.11.065 |
| [4] | 朱再生, 叶敏, 施红旗, 等. 前列腺癌淋巴结转移的特点及其临床意义[J]. 中华泌尿外科杂志, 2014, 35(11): 829–32. [ Zhu ZS, Ye M, Shi HQ, et al. Characters of lymphatic metastasis and their significance in radical prostatectomy[J]. Zhonghua Mi Niao Wai Ke Za Zhi, 2014, 35(11): 829–32. DOI:10.3760/cma.j.issn.1000-6702.2014.11.010 ] |
| [5] | 张洁, 任翠, 薛华丹, 等. 弥散加权成像对宫颈癌淋巴结转移的诊断价值[J]. 中国医学科学院学报, 2014, 36(1): 73–8. [ Zhang J, Ren C, Xue HD, et al. Value of Diffusion-weighted Imaging in Diagnosis of Lymph Node Metastasis in Patients with Cervical Cancer[J]. Zhongguo Yi Xue Ke Xue Yuan Xue Bao, 2014, 36(1): 73–8. DOI:10.3881/j.issn.1000-503X.2014.01.014 ] |
| [6] | 郭靖, 汪俊萍, 李威. 扩散加权成像在鉴别诊断子宫内膜癌盆腔淋巴结性质中的应用[J]. 中国医学影像学杂志, 2013, 21(3): 227–30. [ Guo J, Wang JP, Li W. Diffusion-weighted Imaging in Qualitative Diagnosis of Pelvic Lymph Nodes in Patients with Endometrial Cancer[J]. Zhongguo Yi Xue Ying Xiang Xue Za Zhi, 2013, 21(3): 227–30. ] |
| [7] | 程亚丽, 史大鹏. 磁共振扩散加权成像对直肠癌淋巴结转移的诊断价值[J]. 山东医药, 2018, 58(2): 43–5. [ Cheng YL, Shi DP. Diagnostic value of diffusion weighted imaging in lymph node metastasis of rectal cancer[J]. Shandong Yi Yao, 2018, 58(2): 43–5. ] |
| [8] | Heidenreich A, Varga Z, Von Knobloch R. Extended pelvic lymphadenectomy in patients undergoing radical prostatectomy:high incidence of lymph node metastasis[J]. J Urol, 2002, 167(4): 1681–6. DOI:10.1016/S0022-5347(05)65177-4 |
| [9] | Steuber T, Budäus L, Walz J, et al. Radical prostatectomy improves progression-free and cancer-specific survival in men with lymph node positive prostate cancer in the prostate-specific antigen era:a confirmatory study[J]. BJU Int, 2011, 107(11): 1755–61. DOI:10.1111/bju.2011.107.issue-11 |
| [10] | 马潞林, 邓绍晖. 腹腔镜前列腺癌根治术相关进展(附光盘)[J]. 现代泌尿外科杂志, 2016, 21(1): 1–3. [ Ma LL, Deng SH. The research progress of laparoscopic radical prostatectomy[J]. Xian Dai Mi Niao Wai Ke Za Zhi, 2016, 21(1): 1–3. DOI:10.3969/j.issn.1009-8291.2016.01.001 ] |
| [11] | Godoy G, Von Bodman C, Chade DC, et al. Pelvic Lymph Node Dissection for Prostate Cancer:Frequency and Distribution of Nodal Metastases in a Contemporary Radical Prostatectomy Series[J]. J Urol, 2012, 187(6): 2082–6. DOI:10.1016/j.juro.2012.01.079 |
| [12] | von Bodman C, Godoy G, Chade DC, et al. Predicting biochemical recurrence-free survival for patients with positive pelvic lymph nodes at radical prostatectomy[J]. J Urol, 2010, 184(1): 143–8. DOI:10.1016/j.juro.2010.03.039 |
| [13] | Lambregts DM, Beets GL, Maas M, et al. Tumour ADC measurements in rectal cancer:effect of ROI methods on ADC values and interobserver variability[J]. Eur Radiol, 2011, 21(12): 2567–74. DOI:10.1007/s00330-011-2220-5 |
| [14] | 张卫, 苏丹柯, 罗宁斌, 等. MR表观扩散系数不同测量方法对乳腺良恶性病变的鉴别诊断价值[J]. 实用放射学杂志, 2015, 31(2): 215–8. [ Zhang W, Su DK, Luo NB, et al. Diagnostic value of analysis on ADCs in different measuring methods in breast lesion[J]. Shi Yong Fang She Xue Za Zhi, 2015, 31(2): 215–8. DOI:10.3969/j.issn.1002-1671.2015.02.011 ] |
| [15] | 萨建, 刘桂芬. 定量测量结果的一致性评价及Bland-Altman法的应用[J]. 中国卫生统计, 2011, 28(4): 409–11. [ S J, Liu GF. Assessing the Agreement of Quantitative Measurement Data and the Application of Bland-Altman Method[J]. Zhongguo Wei Sheng Tong Ji, 2011, 28(4): 409–11. DOI:10.3969/j.issn.1002-3674.2011.04.018 ] |
 2019, Vol. 46
2019, Vol. 46


