文章信息
- DWI在直肠癌术前同步放化疗疗效预测中的作用
- Role of Diffusion-weighted Magnetic Resonance Imaging in Forecasting Curative Effect of Preoperative Chemoradiotherapy on Locally Advanced Rectal Cancer
- 肿瘤防治研究, 2019, 46(4): 333-337
- Cancer Research on Prevention and Treatment, 2019, 46(4): 333-337
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.18.1385
- 收稿日期: 2018-09-21
- 修回日期: 2018-12-10
2. 830011 乌鲁木齐,新疆医科大学附属肿瘤医院核磁室;
3. 830011 乌鲁木齐,新疆医科大学附属肿瘤医院病理科
2. Department of Magnetic Resonance, Affiliated Tumor Hospital of Xinjiang Medical University, Urumqi 830011, China;
3. Department of Pathology, Affiliated Tumor Hospital of Xinjiang Medical University, Urumqi 830011, China
近年来,多学科综合治疗模式的开展明显改善了直肠癌患者的预后,其中局部进展期直肠癌的标准治疗模式——新辅助放化疗(neoadjuvant chemoradiotherapy, NCRT)后行根治性手术,使患者的局部复发率由20%~30%降低至7%~10%[1]。尽管取得了这些进展,肿瘤对NCRT的反应仍有很大差异,有54%~75%的肿瘤降期,也有一些对治疗无反应[2]。一些学者提出,对于NCRT后评价治疗有效的患者可行TME手术[3]; NCRT后获得pCR的患者“等待-观察”可作为一种治疗选择,即暂不行根治性手术,进入观察随访期[4]; 另外,若在早期阶段(NCRT开始后2~3周)发现对治疗不敏感的患者,可能有机会选择替代治疗,争取治疗时机。然而,目前尚没有一种精准的方法能够预测直肠癌患者对术前同步放化疗的反应。
磁共振弥散加权成像(diffusion-weighted magnetic resonance imaging, DWI)是根据水分子的扩散特性来评价组织生物学特性的一种非侵入性方法。其中,表观弥散系数(apparent diffusion coefficient, ADC)是组织中水弥散的定量评估参数,与组织的细胞数成反比,可以反映NCRT的反应[5]。本研究对局部进展期直肠癌(locally advanced rectal cancer, LARC)患者术前放化疗前后ADC值变化进行研究,意在探讨ADC在早期识别和筛选对NCRT敏感个体的潜力及其在术前同步放化疗疗效评价中的作用,使患者得到更精准的治疗。
1 资料与方法 1.1 临床资料2016年6月至2017年12月共44例患者符合条件纳入分析。纳入分析的44例直肠癌患者中,男34例、女性10例,年龄19~75岁,平均年龄54岁。汉族35例,其他民族9例(维吾尔族5例、回族3例、蒙古族1例)。纳入标准:(1)年龄18~75岁; (2)KPS评分≥70分; (3)经内镜活检后病理诊断为直肠腺癌的初治患者; (4)治疗前临床分期为Ⅱ~Ⅲ期的中低位直肠癌患者; (5)术前接受并完成盆腔调强放疗50 Gy/25 f; 与放疗同期口服卡培他滨825 mg/m2,每日2次(每周周一至周五); (6)NCRT前后均接受盆腔常规MRI检查并包括DWI序列; (7)NCRT后6~12周内行根治性手术治疗。排除标准:(1)既往接受过直肠手术或盆腔放疗者; (2)合并有严重心、肝、肾等内科疾病者; (3)未完成NCRT或中间长时间(> 2周)中断者; (4)伴第二原发肿瘤。
1.2 方法 1.2.1 临床治疗所有患者采用直线加速器放疗,6MV-X射线照射,膀胱充盈,体模固定,CT模拟定位,适形调强放疗。GTV包括肿瘤病灶及肉眼可见的肿大淋巴结。CTV包括肿瘤病灶、直肠系膜、髂内淋巴区、骶前淋巴引流区,低位直肠患者需包括肛门括约肌、肛周组织和坐骨直肠窝,T4病例还包括髂外淋巴结区。PTV为CTV外加上一定的安全边界,包括器官的移动和摆位误差。肿瘤量50 Gy/25 f,35天。同期化疗:卡培他滨片:825 mg/m2,每日2次,口服,与放疗同期服用(每周周一至周五)。
1.2.2 磁共振扫描以及图像采集、数据处理采用3.0T MRI扫描仪(SIEMENS VERIO MR),相控阵线圈。T2WI参数:TR 4000 ms, TE 96 ms,FOV 290 mm×290 mm,矩阵260×288,层厚=3 mm,间隔=0.5 mm。DWI序列:TR8100ms, TE 80 ms,FOV 290 mm×232 mm,矩阵106×160,扫描层厚=3 mm,间隔=0.5 mm,在b值为0、1000 s/mm2下采集图像数据。由两位MRI诊断经验丰富的副主任医师及以上职称的影像科医生盲法完成。经T2WI和DWI确定病变后,在ADC图上选取连续三个层面,并手动勾画各层面直肠肿瘤最大区域作为感兴趣区域(regions of interest, ROI),取三次测量的最小ADC值。
1.2.3 评估指标分期参照UICC第7版的TNM分期,T-降期定义为:术前同步放化疗前T为cT3降至术后ypT0~2或cT4降至术后ypT0~3或pCR者。
1.3 统计学方法整理数据并通过SPSS 22.0对数据进行统计学分析。采用独立样本t检验比较NCRT前后以及T-降期组与T-未降期组组间ADC水平差异。采用Mann-whiney检验比较治疗前后两组ΔADC以及ADC%的差异,P < 0.05为差异有统计学意义。根据ROC曲线(受试者工作特征曲线)获取的最佳临界ADC值预测疗效。
2 结果 2.1 患者的一般情况44例患者中,手术后病理分期为T0期7例、T1期2例、T2期9例、T3期18例、T4期8例。T-降期组24例(54.5%),其中获得pCR 7例(15.9%),T-未降期组20例(45.5%),见表 1。
44例患者治疗前后ADC值分别为(0.82±0.16)×10-3 mm2/s、(1.22±0.19)×10-3 mm2/s,差异有统计学意义(P=0.000),同步放化疗后的ADC值与治疗前比较明显升高,且纳入分析的每例直肠癌患者经过治疗后的ADC值均高于治疗前。
2.3 同步放化疗前T-降期组与T-未降期ADC值的比较T-降期组ADC值(0.76±0.09)×10-3 mm2/s,明显低于T-未降期组(0.90±0.20)×10-3 mm2/s,差异有统计学意义(P=0.007)。
2.4 治疗后T-降期组与T-未降期组ADC值的比较T-降期组ADC值(1.29±0.19)×10-3 mm2/s,T-未降期组ADC值(1.14±0.15)×10-3 mm2/s,差异有统计学意义(P=0.005)。
2.5 治疗前后两组之间ΔADC以及ADC%的比较T-降期组同步放化疗后ΔADC及ADC%均高于T-未降期组,差异有统计学意义(Z=−5.53, P=0.000; P=−5.09, P=0.000),见表 2。

|
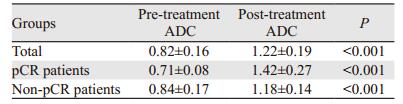
纳入分析的44例直肠癌患者有7例获得pCR,同步放化疗前pCR患者的平均ADC值为(0.71±0.08)×10−3 mm2/s,低于T-降期组(0.76±0.09)×10−3 mm2/s。治疗后pCR患者的平均ADC值为(1.42±0.27)×10−3 mm2/s,高于T-降期组(1.29±0.19)×10−3 mm2/s。所有患者、pCR与非pCR患者治疗前后ADC值之间的差异均有统计学意义,见表 3。
|
取治疗前ADC值0.87×10-3 mm2/s作为预测T分期是否降期的临界值,ROC曲线下面积为0.697(95%CI: 0.539~0.855),预测疗效的敏感度为87.5%,特异性为55.0%,见图 1。

|
| 图 1 治疗前平均ADC值的ROC曲线 Figure 1 ROC curve of mean ADC value before treatment |
术前同步放化疗是LARC患者的标准治疗方式,目前,评价直肠肿瘤对放化疗反应的金标准仍是术后病理。随着治疗模式的改变,我们急需寻找一种简单有效的生物学指标来预测和评价直肠癌患者对术前同步放化疗的反应,指导个体化方案的实施。常规MRI术前分期检查不能预测个体对治疗反应,近年来,DWI等功能性磁共振成像方法的应用,实现了形态与功能相结合,已成为国内外研究的热点之一。DWI的表观扩散系数ADC可以在解剖改变之前根据水的微观迁移率提供大分子和微结构改变的信息[6],反映治疗前后肿瘤微环境中的生物学变化。DWI已被证实在肿瘤良恶性的鉴别以及评价宫颈癌、肝癌等恶性肿瘤的化放疗疗效及预后预测中有一定价值[7-8]。
目前已有文献报道ADC可能反映直肠癌患者对NCRT的反应,结论尚无统一定论。Dzik-Jurasz等[9]首先报道了DWI能作为一种影像学生物指标来预测直肠癌患者对NCRT的反应,该研究表明,放化疗前患者的平均ADC值低于治疗后的平均ADC值,放化疗后直肠癌患者ADC值升高,无应答组在整个治疗过程中维持较高的ADC值。ADC在治疗开始后升高,表明对治疗有早期反应。Sun等[10]的研究显示,治疗前低ADC值与NCRT反应良好有关,治疗第一周ADC值的升高可作为预测肿瘤是否降期的指标。但Genovesi等[11]前瞻性的研究中,分析了28例LARC患者同步放化疗前后ADC值的差异,结论表明pCR组同步放化疗前平均ADC值低于非pCR组,但差异无统计学意义(P=0.33)。该研究将应答组定义为TRG1级,即完全应答,无残留肿瘤和纤维化,排除了部分应答者,且28例肿瘤中仅有10例(36%)为TRG1级,样本量较少,以上两点因素可能是该研究中应答组与非应答组ADC值之间没有差异的原因。本研究结果显示NCRT前,治疗效果好的T降期组患者ADC值明显低于治疗效果较差的T-未降期组,差异有统计学意义,获得pCR的患者治疗前具有更低的ADC值。因此,治疗前低ADC值可能预示着患者对NCRT有较高的敏感度。
ADC通过水的微观迁移率提供大分子和微结构改变的信息,肿瘤组织中水分子扩散受限时,属于低扩散区,在DWI上呈高信号,ADC值相对较低,但当细胞膜受到破坏,坏死组织增多时,水分子扩散增加,组织灌注不良、肿瘤细胞因乏氧而形成酸性微环境时,导致肿瘤组织对放化疗不敏感,肿瘤侵袭性较高,则ADC值较高。因此治疗前低ADC值可能预示着肿瘤组织对放化疗具有较高的敏感度,治疗效果越好,越容易降期或者获得pCR。本研究通过ROC曲线得出治疗前预测T分期降期的ADC临界值(0.87×10-3)mm 2/s,具有较好的敏感度和特异性,治疗前ADC值有预测肿瘤降期与pCR的潜在价值,根据ADC临界值可在初始治疗前对患者进行分组,为选择临床治疗方案提供参考。
本研究中,所有患者同步放化疗后的ADC值均高于治疗前,治疗后T-降期组的ADC值明显高于T-未降期组,治疗前后T-降期组ΔADC及ADC%均高于T-未降期组,获得pCR的患者治疗后ADC值更高。因此,治疗后较高ADC值可能预示着患者同步放化疗效果更好,更容易降期或者获得pCR。早期有研究表明,组织中ADC偏低主要是由于间质间隙减少和细胞密度增加所致,有效治疗抑制肿瘤细胞,细胞膜的完整性受损增加了细胞外空间,水分子扩散增加。ADC的增加与坏死组织区域细胞密度降低,不同程度的水肿、纤维化和炎症有关[6]。因此,在本研究中治疗后ADC的增加可能与治疗反应有关,是放化疗导致肿瘤细胞损伤、坏死的结果。目前对于ADC值能否预测pCR仍存在争议,在一些对LARC患者ADC值预测NCRT反应的研究中,Kim等[12]认为放化疗后CR组ADC值显著高于非CR组,ADC值可作为预测放化疗后CR的指标,而Curvo-Semedo等[13]的报道中认为ADC值对预测CR无意义。本研究中pCR组的ADC值显著高于非pCR组,这一结果与Kim等的研究结果相似。基于目前的研究,这些相互矛盾的结果可能与ROI、b值的选择、MRI参数不同、ADC的灌注效应、ADC值的测量技术与重复性、样本量的大小等均有关。因此目前,在临床实践中ADC值评估pCR的准确性较低,尚不能作为一个独立的指标来判断NCRT后pCR。
综上,本研究发现ADC值与NCRT的疗效有关,ADC值的定量分析有早期预测直肠癌患者对术前同步放化疗敏感度的价值,对同步放化疗疗效的判断也有一定的价值; 但限于样本例数较少、ADC值的测量可能受到成像质量、DWI图像空间分辨率等因素的影响,结论仅能为临床制定治疗决策提供参考。在未来的工作中应加大样本量进行研究,并筛选成像质量高,空间分辨率好的案例纳入分析。
作者贡献
肖楠:项目实施,分析总结,论文撰写
陆艳荣:项目实施与指导
朱丽娜、刘艳:MRI图像收集、测量与分析
曹燕珍:项目指导
张瑾熔:课题设计、项目指导
| [1] | Zeestraten EC, Kuppen PJ, van de Velde CJ, et al. Prediction in rectal cancerr[J]. Semin Radiat Oncol, 2012, 22(2): 175–83. DOI:10.1016/j.semradonc.2011.12.005 |
| [2] | Park IJ, You YN, Agarwa A, et al. Neoadjuvant treatment response as an early response indicator for patients with rectal cancer[J]. J Clin Oncol, 2012, 30(15): 1770–6. DOI:10.1200/JCO.2011.39.7901 |
| [3] | Renehan AG, Malcomson L, Emsley R, et al. Watch-and-wait approach versus surgical resection after chemoradiotherapy for patients with rectal cancer (the OnCoRe project): a propensity-score matched cohort analysis[J]. Lancet Oncol, 2016, 17(2): 174–83. DOI:10.1016/S1470-2045(15)00467-2 |
| [4] | Dossa F, Chesney TR, Acuna SA, et al. A watch-and-wait approach for locally advanced rectal cancer after a clinical complete response following neoadjuvant chemoradiation: a systematic review and meta-analysis[J]. Lancet Gastroenterol Hepatol, 2017, 2(7): 501–13. DOI:10.1016/S2468-1253(17)30074-2 |
| [5] | Barral M, Eveno C, Hoeffel C, et al. Diffusion-weighted magnetic resonance imaging in colorectal cancer[J]. J Visc Surg, 2016, 153(5): 361–9. DOI:10.1016/j.jviscsurg.2016.08.004 |
| [6] | 宋天彬, 卢洁. 磁共振扩散加权成像在直肠癌新辅助放化疗中的应用价值[J]. 协和医学杂志, 2017, 8(Z1): 100–5. [ Song TB, LU J. Diffusion-Weighted Imaging in Neoadjuvant Chemoradiotherapy for Rectal Cancer[J]. Xie He Yi Xue Za Zhi, 2017, 8(Z1): 100–5. ] |
| [7] | Gluskin JS, Chegai F, Monti S, et al. Hepatocellular carcinoma and diffusion-weighted MRI: detection and evaluation of treatment response[J]. J Cancer, 2016, 7(11): 1565–70. DOI:10.7150/jca.14582 |
| [8] | Gladwish A, Milosevic M, Fyles A, et al. Association of Apparent Diffusion Coefficient with Disease Recurrence in Patients with Locally Advanced Cervical Cancer Treated with Radical Chemotherapy and Radiation Therapy[J]. Radiology, 2016, 279(1): 158–66. DOI:10.1148/radiol.2015150400 |
| [9] | Dzik-Jurasz A, Domenig C, George M, et al. Diffusion MRI for prediction of response of rectal cancer to chemoradiation[J]. Lancet, 2002, 360(9329): 307–8. DOI:10.1016/S0140-6736(02)09520-X |
| [10] | Sun YS, Zhang XP, Tang L, et al. Locally advanced rectal carcinoma treated with preoperative chemotherapy and radiation therapy: preliminary analysis of diffusion-weighted MR imaging for early detection of tumor histopathologic downstaging[J]. Radiology, 2010, 254(1): 170–8. DOI:10.1148/radiol.2541082230 |
| [11] | Genovesi D, Filippone A, Ausili Cèfaro G, et al. Diffusion-weighted magnetic resonance for prediction of response after neoadjuvant chemoradiation therapy for locally advanced rectal cancer: preliminary results of a monoinstitutional prospective study[J]. Eur J Surg Oncol, 2013, 39(10): 1071–8. DOI:10.1016/j.ejso.2013.07.090 |
| [12] | Kim SH, Lee JM, Hong SH, et al. Locally advanced rectal cancer: added value of diffusion-weighted MR imaging in the evaluation of tumor response to neoadjuvant chemo- and radiation therapy[J]. Radiology, 2009, 253(1): 116–25. DOI:10.1148/radiol.2532090027 |
| [13] | Curvo-Semedo L, Lambregts DM, Maas M, et al. Rectal cancer: assessment of complete response to preoperative combined radiation therapy with chemotherapy-conventional MR volumetry versus diffusion-weighted MR imaging[J]. Radiology, 2011, 260(3): 734–43. DOI:10.1148/radiol.11102467 |
 2019, Vol. 46
2019, Vol. 46



