文章信息
- 下调Skp2表达抑制骨肉瘤U2OS细胞恶性表型的实验
- Downregulation of Skp2 Expression Inhibits Malignant Phenotype of Osteosarcoma U2OS Cells
- 肿瘤防治研究, 2019, 46(5): 395-400
- Cancer Research on Prevention and Treatment, 2019, 46(5): 395-400
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.18.1339
- 收稿日期: 2018-09-17
- 修回日期: 2019-01-31
2. 830011 乌鲁木齐,新疆医科大学第六附属医院关节外科;
3. 830011 乌鲁木齐,新疆医科大学附属肿瘤医院骨与软组织肿瘤科
2. Department of Joint Surgery, Sixth Affiliated Hospital, Xinjiang Medical University, Urumqi 830011, China;
3. Department of Bone and Soft Tissue, Tumor Hospital Affiliated to Xinjiang Medical University, Urumqi 830011, China
骨肉瘤(Osteosarcoma, OS)是骨中常见的原发性侵袭性肿瘤,好发于儿童和青少年[1-2]。像其他肉瘤一样,OS是一种间质细胞来源的恶性肿瘤[3],它通常是局部侵袭性的,早期有全身转移倾向[4]。目前的治疗策略包括术前化疗(新辅助化疗)、手术切除和术后(辅助)化疗。化疗后在无转移的局部性骨肉瘤患者中5年无瘤生存率达到60%~70%,但是中晚期骨肉瘤患者的5年生存率则低于50%[5]。研究表明,遗传变异在骨肉瘤发生与发展的不同阶段起着重要作用,肿瘤抑制基因突变与致癌基因活化与骨肉瘤密切相关[6]。因此,了解骨肿瘤发生的分子机制,以及验证骨肉瘤的新治疗靶点对于制定骨肉瘤的治疗有着重要意义。
本研究通过转染siRNA的方法敲低U2OS细胞中Skp2的表达,研究骨肉瘤中Skp2对细胞生长、凋亡以及细胞周期的影响;同时探讨Skp2对骨肉瘤细胞迁移和侵袭的调控作用。进一步检测沉默Skp2是否影响E-cadherin、Akt及周期蛋白p21和p27。初步探讨Skp2对骨肉瘤细胞生物学行为的影响,阐明Skp2作为骨肉瘤治疗靶点的意义。
1 材料与方法 1.1 细胞及试剂人骨肉瘤U2OS购自中国科学院上海生科院细胞资源中心。细胞培养在含10%胎牛血清的DMEM培养液中,将其置于37℃、5%CO2细胞培养箱中培养。MTT(3-(4, 5-二甲苯并噻唑-2-基)-2, 5-二苯基四唑溴化物)为美国Sigma公司产品。抗-p21、抗p27、抗-E-cadherin、抗-Akt和抗-pAkt多克隆抗体购自美国Cell Signaling Technology公司。Tubulin及Skp2多克隆抗体均购自美国Santa Cruz Biotechnology公司。Lipofectamine 2000购自美国Thermo Fisher Scientific公司。Annexin V/PI双染试剂盒购自北京碧云天试剂有限公司,钙黄绿素乙酰甲酯(Calcein-AM)染色试剂盒购自美国Invitrogen公司。
1.2 细胞转染将生长状态良好的U2OS细胞接种于6孔板中,培养大约24 h,待细胞融合度达到70%~80%后,用Lipofectamine 2000分别转染Skp2 siRNAs及对照siRNA。Skp2 siRNA由上海吉玛制药技术有限公司合成。转染5~8 h后弃培养液,再加入2 ml新鲜的完全培养基,继续培养48~72 h。收集细胞检测基因沉默效率用于后续实验。
1.3 RT-qPCR检测按照TRIzol试剂使用说明提取转染细胞的RNA并反转录合成cDNA。Skp2引物序列为:上游:5' -GCT GCT AAA GGT CTC TGG TGT-3' ,下游:5' -AGG CTT AGA TTC TGC AAC TTG-3;GAPDH引物序列为:上游:5' -ACC CAG AAG ACT GTG GAT GG-3' ,下游:5' -CAG TGA GCT TCC CGT TCA G-3' ,以GAPDH表达作内部参照。通过SDS软件分析Skp2基因表达,溶解曲线全部为单峰表明为特异性扩增,用2-ΔΔCt方法分析Skp2基因表达变化。
1.4 蛋白质印迹分析收集处理的细胞,加入适量的含蛋白酶抑制剂的细胞裂解液提取总蛋白,用Bradford法检测蛋白质浓度并制样。以相同的量将蛋白样品加载到每个泳道中,用SDS-PAGE凝胶电泳。将经SDS-PAGE分离的蛋白质转移到NC膜上。室温下用5%牛奶封闭NC膜1 h。洗NC膜3~5次,分别用Skp2、p-Akt(ser473)、p21、p27、E-cadherin和Tubulin等第一抗体进行孵育,4℃过夜。洗膜,然后再与辣根过氧化物酶标记的二级抗体进行室温孵育90 min左右。用ECL显影液将目的蛋白表达条带显影于X光片上。用Quantity One软件扫描目的蛋白表达条带进行灰度分析,对比Tubulin蛋白表达量获得目的蛋白的相对表达量,最后对结果进行统计分析。
1.5 MTT测定收集对数期U2OS细胞将细胞制成细胞悬液,以5×103个/孔接种到96孔板中,培养过夜。转染siRNA,每组设5个复孔,继续培养48和72 h。每孔加0.5%MTT溶液,继续培养4 h。加入150 µl DMSO,置摇床上室温低速振荡10 min,使结晶物充分溶解,利用酶标仪检测OD490 nm处各孔的吸光度。分别在48 h和72 h通过MTT测定细胞活力,确定Skp2对骨肉瘤细胞中细胞增殖的调节作用,从而评估Skp2 siRNA转染骨肉瘤细胞增殖的状况。
1.6 细胞凋亡测定将转染细胞培养至6孔板中,48 h后收集细胞并用PBS洗涤,加入500 μl结合缓冲液悬浮细胞,再先后加入5 μl Annexin V-FITC和5 μl(PI),避光反应15 min,用FACScan流式细胞仪检测细胞凋亡。
1.7 细胞周期分析将转染siRNA的U2OS细胞及对照细胞接种到培养皿中培养48 h。收集细胞在磷酸盐缓冲液中洗涤一遍,再用70%冷乙醇固定12 h。次日,用冷PBS洗涤细胞,以1×106个/毫升重悬于PBS中。用核糖核酸酶A(RNase A, 0.1 mg/ ml)于37℃下处理固定的细胞20~30 min。1 000 r/min离心5 min收集细胞,将细胞重新悬浮于荧光染料PI(50 μg/ml)中,使用FACScan流式细胞仪评估细胞周期分布并进行分析。
1.8 Transwell侵袭和迁移实验细胞侵袭实验:将转染细胞按5×105个/毫升悬浮于无血清DMEM培养基中,取0.2 ml细胞悬液加入到事先辅有Matrigel的Transwell上室中;下室中加入0.5 ml含有10%胎牛血清的DMEM培养基;将Transwell板放到培养箱内,培养24 h。用镊子取出Transwell小室,留在膜上层未穿膜的细胞用棉签轻轻擦去。将膜取出,底面朝上放到24孔板小孔内,加入适量Hanks缓冲液,再加入4 μg/ml Calcein-AM,将侵入Matrigel基质膜及侵入未铺Matrigel的Transwell小室膜的细胞在37℃下染色1 h。在荧光显微镜下进行拍照,各组细胞随机选取6个不同的视野,对穿过膜的侵袭细胞进行计数。
细胞迁移实验:将转染细胞铺在不加Matrigel的Transwell小室膜上,其余操作步骤与细胞侵袭实验相同。
1.9 统计学方法实验结果采用SPSS17.0统计软件进行处理,计量资料主要采用均数±标准差进行描述,用t-test分析比较Skp2 siRNA转染组和NC siRNA转染组之间的差异。以P < 0.05为差异有统计学意义。
2 结果 2.1 骨肉瘤细胞U2OS中转染Skp2 siRNA后对Skp2表达的影响RT-qPCR结果显示,Skp2 siRNA转染U2OS细胞48 h后,三条siRNA序列都显著下调Skp2 mRNA水平,其中siRNA3序列下调效果最为显著(0.21±0.03, P=0.0001),与对照组相比,Skp2在U2OS细胞中的敲除效率均达到70%左右,见图 1A。Western blot结果表明三条siRNA均能有效的敲低Skp2蛋白表达,而siRNA3在U2OS细胞中沉默效果为79%,强于siRNA1的59%和siRNA2的74%,见图 1B。因此,后续实验沉默Skp2的表达时均转染siRNA3。

|
| **: P<0.01, ***: P<0.001, compared with the control or NC siRNA group 图 1 骨肉瘤细胞U2OS中转染Skp2 siRNA后RT-qPCR和Western blot检测Skp2的表达 Figure 1 Skp2 expression in U2OS cells transfected with Skp2 siRNA measured by RT-qPCR and Western blot |
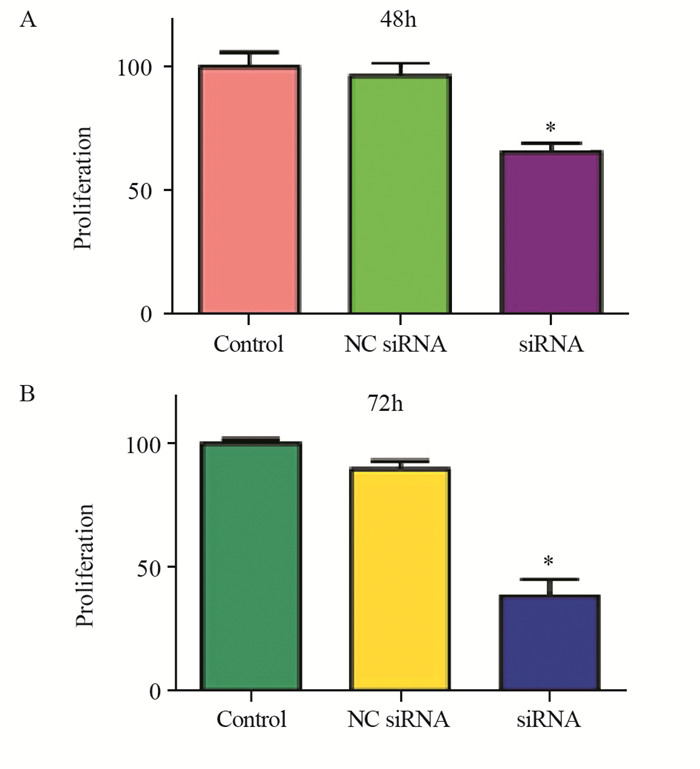
研究表明,通过降低Skp2水平可抑制多种癌细胞增殖。MTT结果表明,在转染Skp2 siRNA 48 h,U2OS细胞生长受到一定程度的抑制,抑制率为34%(P=0.0065),见图 2A;而72 h后U2OS细胞生长则被显著抑制,抑制率为64%(P=0.0003),见图 2B。
|
| *: P<0.05, compared with the control or NC siRNA groups 图 2 沉默Skp2表达抑制骨肉瘤细胞增殖 Figure 2 Downregulation of Skp2 expression inhibited proliferation of OS cells |
Annexin V-FITC/PI细胞凋亡检测结果显示,沉默Skp2表达可触发U2OS细胞凋亡。与对照组的凋亡率5.45%及转染NC siRNA对照组的5.50%相比,转染Skp2 siRNA的细胞凋亡率增加到18.56%,见图 3。

|
| 图 3 沉默Skp2对骨肉瘤细胞凋亡的影响 Figure 3 Depletion of Skp2 induced apoptosis of OS cells |
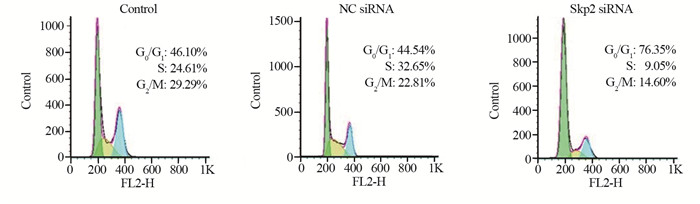
流式细胞术结果显示,Skp2 siRNA转染组细胞出现典型的G0/G1阻滞。沉默Skp2后,G0/G1期细胞比例从阴性对照组的44.54%,增加到U2OS细胞的76.35%,见图 4。结果表明沉默Skp2表达可诱导骨肉瘤阻滞在G0/G1期。
|
| 图 4 沉默Skp2对骨肉瘤细胞周期的影响 Figure 4 Depletion of Skp2 induced cell cycle arrest of OS cells |
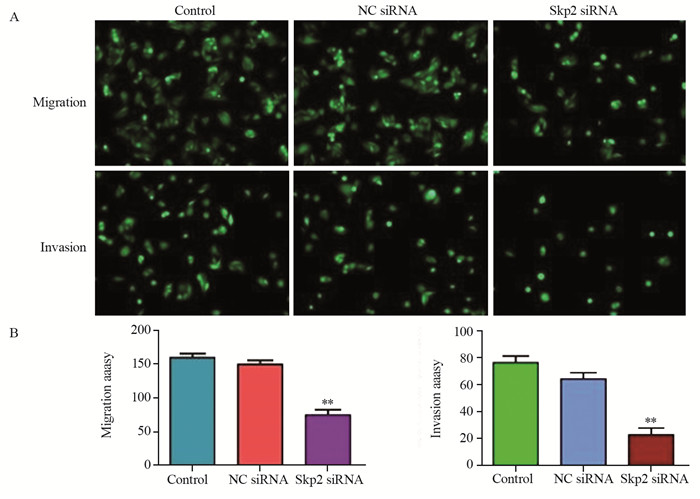
将转染Skp2 siRNA的细胞铺在含Matrigel胶的小室膜上,培养大约16 h后,将侵入Matrigel基质膜的细胞用4 μg/ml Calcein-AM在37℃下染色1 h。荧光显微镜拍照,对随机选择的6个视野进行统计,Transwell实验结果表明沉默Skp2显著削弱了U2OS细胞的侵袭能力(23.33±4.71, P=0.0002);将转染Skp2 siRNA的细胞铺在不含Matrigel胶的Transwell小室膜上时,迁移到膜背面的细胞明显减少,表明沉默Skp2同样会抑制U2OS细胞的迁移能力(74.71±8.82, P=0.0021)。结果表明,沉默Skp2的表达显著削弱了U2OS细胞的体外迁移和侵袭能力,见图 5。
|
| **: P<0.01, compared with the NC siRNA group 图 5 沉默Skp2表达抑制骨肉瘤细胞侵袭与迁移能力 Figure 5 Depletion of Skp2 inhibited migration and invasion of OS cells |
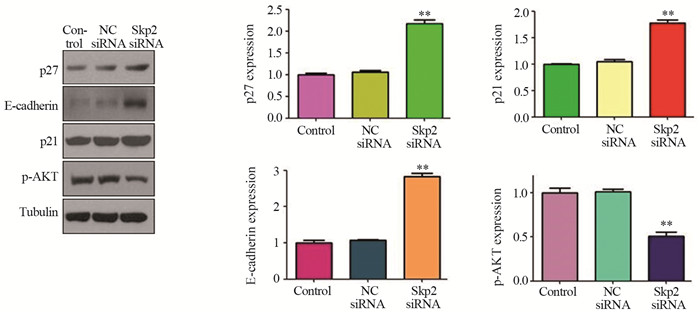
Western blot分析显示,沉默Skp2可增加骨肉瘤细胞中E-cadherin的表达,升高约2.86倍(2.86±0.07, P=0004)。而沉默Skp2后周期相关蛋白p21和p27的表达也显著升高,分别升高约1.79倍和2.16倍(1.79±0.06, P=0.0192; 2.16±0.05, P=0.0124),见图 6。表明Skp2在一定程度上可通过靶向p21与p27参与细胞周期调控。沉默Skp2降低了骨肉瘤细胞中p-Akt活性形式分子,p-Akt的表达下降约50%(0.5±0.04, P=0.0027),见图 6。
|
| **: P<0.01, compared with the NC siRNA group 图 6 沉默Skp2可升高p21、p27、E-cadherin的表达及降低p-Akt的表达 Figure 6 Depletion of Skp2 increased expression of p27, p27, E-cadherin while decreased p-Akt expression |
Skp2在多种肿瘤中都有高表达,如淋巴瘤、前列腺癌、胰腺癌、乳腺癌、鼻咽癌、胃癌等[7]。国内外大量研究发现,Skp2在多种人类肿瘤发生中主要发挥癌基因作用,Inuzuka等发现Skp2通过泛素化破坏E-钙黏素而增强细胞迁移[8]。Skp2蛋白促进泛素介导的Foxo1水解,在肿瘤发生中发挥关键作用[9]。而通过敲除小鼠肿瘤细胞中Skp2的表达则可逆转由p19 Arf或PTEN蛋白损失引起的肿瘤[10-11]。条件性敲除小鼠Skp2的下调可抑制T细胞谱系和B细胞谱系的淋巴瘤,还可以抑制骨髓、肝脏、乳腺和前列腺中肿瘤的生长[12-14]。鼻咽癌中Skp2高表达与预后不良相关,并且失活Skp2蛋白可通过p21cip/WAF和p27kip促进鼻咽癌细胞衰老[15]。抑制Skp2的表达有助于抑制肿瘤细胞的生长等癌细胞特性[16-17],但Skp2在骨肉瘤细胞中的作用仍相对模糊。有报道表明骨肉瘤U2OS细胞中Skp2与Cks1紊乱可导致FoxM1表达下调,从而抑制骨肉瘤U2OS细胞生长,进一步导致细胞生长周期阻滞与p21、p27表达水平增加[18]。同时,FoxM1可调节SCF/SKP2-CKS1泛素链接酶复合物等调节细胞周期基因的转录。此外,GLI2是Hedgehog信号通路中的一个关键驱动因子,通过siRNA敲低该分子可以抑制骨肉瘤细胞生长,并伴随细胞周期负调节分子p21的增加及细胞周期促进分子cyclin D1、Skp2和磷酸化Rb的减少而将细胞阻滞在G1期。相反,过表达GLI2则可通过上调骨肉瘤细胞中Skp2的表达,而促进细胞增殖、加速细胞周期进程。裸鼠移植瘤模型结果表明,敲低GLI2抑制了骨肉瘤在体内的生长[19]。使用环巴胺(Cyclopamine)特异性的抑制Hedgehog信号途径中另一关键分子Smoothened(SMO),可减缓骨肉瘤细胞生长,上调p21,下调cyclin D1、Skp2等细胞周期促进分子[20],并且使用SMO shRNA持续沉默SMO的表达,可抑制骨肉瘤细胞在体内和体外的生长[20]。当用γ-分泌酶抑制剂及阻断Notch信号通路后,由于cyclin D1、Skp2等细胞周期促进分子表达降低,从而抑制了骨肉瘤细胞体外及体内生长[21]。这些研究表明Skp2在调节骨肉瘤细胞生长中起关键作用。
本研究中我们观察到Skp2沉默后抑制了骨肉瘤细胞生长、促进凋亡、诱导周期阻滞,并抑制细胞侵袭和迁移能力。Skp2需要通过靶向其底物如p27、p21、p57与FOXO1等来体现其致癌功能,本研究还检测到Skp2沉默后显著上调了p21、p27和E-cadherin的表达。相关研究表明,Akt可直接结合Skp2,促进Skp2由细胞核向细胞质迁移,进而激活Skp2功能[22],并且研究发现Skp2可刺激人乳腺癌细胞中Akt活化[23]。本研究中,沉默Skp2降低了骨肉瘤细胞中活性形式分子p-Akt的表达,进一步地深入研究将有助于确定Skp2对骨肉瘤细胞中Akt活化的调节作用。本研究直接证实了Skp2在骨肉瘤细胞中的生物学功能,因此,失活Skp2基因将成为潜在的治疗骨肉瘤患者的有效方法。
作者贡献
丁 路:细胞实验、分子生物学实验和撰文
孙荣鑫:分子生物学实验
白靖平:实验设计及指导
| [1] | Anderson ME. Update on Survival in Osteosarcoma[J]. Orthop Clin North Am, 2016, 47(1): 283–92. DOI:10.1016/j.ocl.2015.08.022 |
| [2] | Siegel RL, Miller KD, Jemal A. Cancer statistics, 2017[J]. CA Cancer J Clin, 2017, 67(1): 7–30. DOI:10.3322/caac.21387 |
| [3] | Luetke A, Meyers PA, Lewis I, et al. Osteosarcoma treatment-Where do we stand? A state of the art review[J]. Cancer Treat Rev, 2014, 40(4): 523–32. DOI:10.1016/j.ctrv.2013.11.006 |
| [4] | Raymond AK, Jaffe N. Osteosarcoma multidisciplinary approach to the management from the pathologist's perspective[J]. Cancer Treat Res, 2009, 152: 63–84. DOI:10.1007/978-1-4419-0284-9 |
| [5] | Vos HI, Coenen MJ, Guchelaar HJ, et al. The role of pharmacogenetics in the treatment of osteosarcoma[J]. Drug Discov Today, 2016, 21(11): 1775–86. DOI:10.1016/j.drudis.2016.06.022 |
| [6] | Kushlinskii NE, Fridman MV, Braga EA. Molecular mechanisms and microRNAs in osteosarcoma pathogenesis[J]. Biochemistry(Mosc), 2016, 81(4): 315–28. |
| [7] | Wang Z, Gao D, Fukushima H, et al. Skp2: a novel potential therapeutic target for prostate cancer[J]. Biochim Biophys Acta, 2012, 1825(1): 11–7. |
| [8] | Inuzuka H, Gao D, Finley LW, et al. Acetylation-dependent regulation of Skp2 function[J]. Cell, 2012, 150(1): 179–93. DOI:10.1016/j.cell.2012.05.038 |
| [9] | Yuan C, Wang L, Zhou L, et al. The function of FOXO1 in the late phases of the cell cycle is suppressed by PLK1-mediated phosphorylation[J]. Cell Cycle, 2014, 13(5): 807–19. DOI:10.4161/cc.27727 |
| [10] | Chen K, Wu K, Jiao X, et al. The endogenous cell-fate factor dachshund restrains prostate epithelial cell migration via repression of cytokine secretion via a cxcl signaling module[J]. Cancer Res, 2015, 75(10): 1992–2004. DOI:10.1158/0008-5472.CAN-14-0611 |
| [11] | Li B, Lu W, Yang Q, et al. Skp2 regulates androgen receptor through ubiquitin-mediated degradation independent of Akt/mTOR pathways in prostate cancer[J]. Prostate, 2014, 74(4): 421–32. DOI:10.1002/pros.v74.4 |
| [12] | Wei Z, Jiang X, Qiao H, et al. STAT3 interacts with Skp2/p27/p21 pathway to regulate the motility and invasion of gastric cancer cells[J]. Cell Signal, 2013, 25(4): 931–8. DOI:10.1016/j.cellsig.2013.01.011 |
| [13] | Delogu S, Wang C, Cigliano A, et al. SKP2 cooperates with N-Ras or AKT to induce liver tumor development in mice[J]. Oncotarget, 2015, 6(4): 2222–34. |
| [14] | Zheng N, Schulman BA, Song L, et al. Structure of the Cul1-Rbx1-Skp1-F boxSkp2 SCF ubiquitin ligase complex[J]. Nature, 2016, 416(6882): 703–9. |
| [15] | Wang J, Huang Y, Guan Z, et al. E3-ligase Skp2 predicts poor prognosis and maintains cancer stem cell pool in nasopharyngeal carcinoma[J]. Oncotarget, 2014, 5(14): 5591–601. |
| [16] | Xu D, Li CF, Zhang X, et al. Skp2-macroH2A1-CDK8 axis orchestrates G2/M transition and tumorigenesis[J]. Nat Commun, 2015, 6: 6641. DOI:10.1038/ncomms7641 |
| [17] | Lee SW, Li CF, Jin G, et al. Skp2-dependent ubiquitination and activation of LKB1 Is essential for cancer cell survival under energy stress[J]. Mol Cell, 2015, 57(6): 1022–33. DOI:10.1016/j.molcel.2015.01.015 |
| [18] | Wang IC, Chen YJ, Hughes D, et al. Forkhead box M1 regulates the Transcriptional network of genes essential for mitotic progression and genes encoding the SCF (Skp2-Cks1) ubiquitin ligase[J]. Mol Cell Biol, 2005, 25(24): 10875–94. DOI:10.1128/MCB.25.24.10875-10894.2005 |
| [19] | Chen F, Mo J, Zhang L. Long noncoding RNA BCAR4 promotes osteosarcoma progression through activating GLI2-dependent gene transcription[J]. Tumor Biol, 2016, 37(10): 13403–12. DOI:10.1007/s13277-016-5256-y |
| [20] | Bernardini G, Geminiani M, Gambassi S, et al. Novel smoothened antagonists as anti-neoplastic agents for the treatment of osteosarcoma[J]. J Cell Physiol, 2018, 233(6): 4961–71. DOI:10.1002/jcp.v233.6 |
| [21] | Ongaro A, Pellati A, Bagheri L, et al. Characterization of Notch Signaling During Osteogenic Differentiation in Human Osteosarcoma Cell Line MG63[J]. J Cell Physiol, 2016, 231(12): 2652–63. DOI:10.1002/jcp.25366 |
| [22] | Gao D, Inuzuka H, Tseng A, et al. Phosphorylation by Akt1 promotes cytoplasmic localization of Skp2 and impairs APCCdh1-mediated Skp2 destruction[J]. Nat Cell Biol, 2009, 11(4): 397–408. DOI:10.1038/ncb1847 |
| [23] | Liu X, Wang H, Ma J, et al. The expression and prognosis of Emi1 and Skp2 in breast carcinoma: associated with PI3K/Akt pathway and cell proliferation[J]. Med Oncol, 2013, 30(4): 735. DOI:10.1007/s12032-013-0735-0 |
 2019, Vol. 46
2019, Vol. 46


