文章信息
- 阴茎癌腹腔镜下腹股沟淋巴结清扫术与开放手术的临床疗效比较
- Clinical Effect of Laparoscopic Inguinal Lymph Node Dissection Versus Open Surgery for Penile Cancer
- 肿瘤防治研究, 2019, 46(4): 355-357
- Cancer Research on Prevention and Treatment, 2019, 46(4): 355-357
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.18.1285
- 收稿日期: 2018-09-07
- 修回日期: 2018-11-15
阴茎癌是一种罕见的恶性肿瘤,约占男性恶性肿瘤的1%~3%[1]。阴茎癌绝大多数为鳞状细胞癌,最常见的转移区域是腹股沟淋巴结及髂血管旁淋巴结。腹股沟淋巴结清扫是阴茎癌的标准术式之一,手术方式包括开放性双侧腹股沟淋巴结清扫术及微创手术。开放性腹股沟淋巴结清扫术是二十世纪90年代阴茎癌伴区域淋巴结转移治疗的金标准。其治疗效果确切,很大程度地改善了患者的预后,但是传统的开放性腹股沟淋巴结清扫术术后并发症高达50%~100%[2],主要原因是清扫淋巴结时切口太大,导致术后易出现皮瓣坏死、淋巴瘘、淋巴囊肿、下肢水肿及伤口愈合延迟等等,严重影响患者生活质量。虽然改良的腹股沟淋巴结清扫术在一定程度上减少了术后并发症,但是术后并发症的发生率仍然较高[3]。随着科技的发展及微创技术的进步,越来越多的传统手术方式被腹腔镜手术替代,明显降低了术后并发症。本文比较了阴茎癌腹腔镜腹股沟淋巴结清扫术与传统开放手术的临床疗效,探讨腹腔镜腹股沟淋巴结清扫术的可行性。
1 资料与方法 1.1 临床资料收集我院经腹股沟淋巴结清扫术治疗的84例阴茎癌患者,术前均病理证实为阴茎鳞状细胞癌。按淋巴结清扫术方式将患者分为开放组和腹腔镜组。其中腹腔镜组36例,平均年龄60.3(44~73)岁;行阴茎全切12例、阴茎部分切除术24例;病理分级G1级20例、G2级16例;原发肿瘤分期T1期25例、T2期11例;36例患者均行双侧腹股沟淋巴结清扫。开放组48例,平均年龄58.8(43~73)岁;行阴茎全切16例、阴茎部分切除术32例;病理分级G1级28例、G2级20例;原发肿瘤分期T1期33例、T2期15例;48例患者均行双侧腹股沟淋巴结清扫。两组资料比较,差异无统计学意义(P > 0.05)。
1.2 方法腹腔镜组患者取仰卧位,双下肢分开外旋外展约45°,膝关节稍弯曲外展,术前记号笔标注股三角的体表投影。术者根据习惯坐于患者下肢右侧或下肢中间。在股三角顶点向下约4 cm处做一约2 cm切口,食指沿camper筋膜层钝性分离,尽可能的扩大操作空间。置入10 mm Trocar,接气腹机使压力达6 mmHg,建立潜在腔隙后引入腹腔镜。以卵圆窝为中心呈扇形展开,在距离腹腔镜Trocar两侧约5 cm处分别置入10 mm及5 mm Trocar。引入超声刀及吸引器,钝锐性结合分离皮下浅筋膜层和深筋膜层之间纤维脂肪组织。清扫范围上至腹股沟韧带上方约3 cm,下至股三角顶端,内侧达内收肌内侧缘,外侧至缝匠肌外侧缘。分离并解剖大隐静脉及其属支,保留大隐静脉主干,结扎其属支。打开股动静脉鞘清扫卵圆窝内的脂肪组织。将标本放入标本袋中连同10 mm Trocar一起拔出,留置22F负压引流管,缝合切口后穿医用防静脉曲张弹力绷带袜。同法清扫对侧淋巴结。
开放组患者取平卧位,双侧大腿稍外旋,暴露腹股沟及股三角区。沿髂前上棘内侧2 cm纵行切开皮肤,经腹股沟韧带中点达股三角水平。切开皮肤至浅筋膜,沿蜂窝状组织间隙清除腹股沟浅层淋巴结及脂肪,游离大隐静脉并尽可能保留大隐静脉主干,可减少术后下肢水肿的发生。沿大隐静脉主干向卵圆窝方向裸化大隐静脉,依次结扎大隐静脉属支(腹壁浅静脉、阴部外静脉、旋髂浅静脉、股外侧浅静脉、股内侧浅静脉),整块切除腹股沟浅组的淋巴结及脂肪组织。再打开股管的外鞘,分离出股动静脉,将股管内的脂肪组织及淋巴组织一并清除。移除标本后蒸馏水冲洗创面并留置22 F负压引流管一根,间断缝合皮肤并用弹力绷带加压包扎。
1.3 观察指标观察两组手术时间、术中出血量、平均住院时间、术后恢复情况、切除的淋巴结数量、并发症发生情况及术后阳性淋巴结例数。
1.4 统计学方法采用SPSS17.0统计软件对资料进行统计学分析,计量资料以(x±s)表示,组间比较采用独立样本t检验;计数资料采用构成比或率进行描述,组间比较采用χ2检验。P < 0.05为差异有统计学意义。
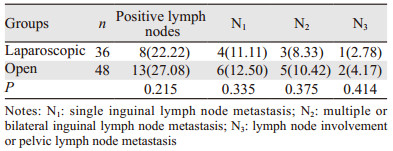
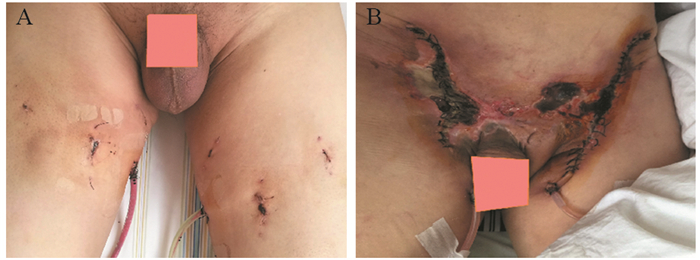
2 结果两组84例患者均顺利完成手术,腹腔镜组无一例中转开放手术。腹腔镜组与开放组患者在手术时间、术中失血量及清扫淋巴结数量上比较,差异无统计学意义(P > 0.05),但是腹腔镜组与开放组患者在住院时间及术后并发症上比较,腹腔镜组明显少于开放组,差异有统计学意义(P < 0.05),见表 1;腹腔镜组36例患者中出现1例淋巴瘘,1例患者出现皮肤坏死,术后并发症发生率为5.56%。开放组48例患者中有6例出现皮肤坏死,3例出现淋巴瘘,2例患者出现下肢水肿,1例患者出现下肢静脉血栓形成,1例患者出现局部包裹积液,1例患者因伤口感染导致愈合时间延长,术后并发症发生率为31.25%。两组患者术后并发症相比差异有统计学意义(P < 0.05)。术后病理检查结果显示两组相比差异无统计学意义(P=0.215),见表 2。腹腔镜组术后伤口恢复情况,见图 1A,开放组术后伤口愈合情况,见图 1B。两组患者术后随访3~24月,腹腔镜组出现2例腹股沟淋巴结肿瘤复发;开放组出现3例腹股沟淋巴结肿瘤复发,两组患者在随访中均无死亡病例。
|
| 图 1 腹腔镜(A)及开放性(B)腹股沟淋巴结清扫术后恢复情况 Figure 1 Recovery after laparoscopic(A) and open operation(B) of inguinal lymph node dissection |
阴茎癌最常发生在阴茎头或冠状沟。发展中国家发病率高于发达国家,主要见于40~60岁的男性[4-5]。临床上因为难以启齿或不愿意到医院检查常常延误治疗时机。阴茎癌主要通过淋巴结转移,而且淋巴结不会出现跳跃式转移,区域淋巴结主要转移至双侧腹股沟淋巴结,远处淋巴结转移主要转移至髂血管旁淋巴结。当阴茎癌患者出现远处淋巴结转移时,预后较差,因此区域淋巴结的彻底清扫显得尤为重要。临床发现,超过50%的腹股沟肿大淋巴结为炎性反应。因此,对腹股沟淋巴结肿大的阴茎癌患者是否行同期淋巴结清扫尚有争议[6-7]。最新研究显示,阴茎癌患者同期行双侧腹股沟淋巴结清扫可获得更好的长期生存率[8]。研究显示,接受预防性双侧腹股沟淋巴结清扫术的阴茎癌患者中,阳性淋巴结患者5年生存率超过90%,而在随访中发现,已发生肿大的淋巴结转移再行腹股沟淋巴结清扫术的患者5年生存率仅为30%~40%[9-10]。因此,阴茎癌患者同期行腹股沟淋巴结清扫术是非常有必要的,能明显提高患者5年生存率。
传统的阴茎癌腹股沟淋巴结清扫,主要并发症有皮瓣坏死、淋巴瘘、淋巴囊肿、下肢水肿及伤口愈合延迟等等,严重影响患者生活质量[11]。虽然,改良的腹股沟淋巴结清扫术降低了术后并发症的发生率,但却因为改良的腹股沟淋巴结清扫术缩小了淋巴结清扫范围,因此遗漏了某些隐匿的转移性淋巴结。因此研究如何在创伤更小的情况下清扫更多的淋巴结成为热点。2007—2008年间Tobias-Machado及Sotelo分别尝试了腹腔镜腹股沟淋巴结清扫术,均认为腹腔镜手术可明显减少术后并发症,却与开放手术的疗效相当[12-13],但该结果显示腹腔镜手术时间长,且出血量明显多于开放手术,这可能与当时的技术水平相关。
我院2012年1月开始使用腹腔镜技术清扫腹股沟淋巴结,所有患者均被随机分组。无论是腹腔镜组还是开放组均行一期淋巴结清扫。两组患者在年龄、临床分期及病理分级方面差异无统计学意义;在临床疗效方面,两组患者清扫的淋巴结数及N1、N2、N3计数比较差异均无统计学意义,说明腹腔镜手术与开放手术疗效相当。在手术时间与术中失血量方面,两组比较差异无统计学意义,但是腹腔镜组患者术后并发症明显较少(P < 0.01),且住院时间较开放组明显缩短(P < 0.01)。分析原因腹腔镜组患者术后并发症少可能与以下几个因素相关:(1)手术切口小,减少了细菌入侵的机会,降低了皮肤及皮下感染的发生率;(2)超声刀的高温碳化作用减少了术后淋巴瘘的机会;(3)因腹腔镜手术时保留了皮下血管网,可明显减少皮肤坏死概率;(4)腹腔镜的放大作用,可更好的保留大隐静脉及其属支,可明显减少下肢水肿及血栓形成的概率;(5)腹腔镜手术可在较低的气腹压下操作,避免了开放手术需要长期牵拉皮肤造成的机械损伤。术后,我们常规使用医用防静脉曲张弹力袜,可减少术后出血及术后组织水肿。所有患者均随访3~24月,腹腔镜组中有2例复发,开放组3例复发,两组均无死亡病例,差异无统计学意义。
综上所述,阴茎癌患者同期行腹股沟淋巴结清扫术能明显改善患者预后,且腹腔镜下腹股沟淋巴清扫术与开放手术相比,在不增加肿瘤种植或复发风险的同时能达到相同的临床疗效,且腹腔镜手术具有创伤小、恢复快、住院时间短等优点,更重要的是术后皮瓣坏死及切口感染发生率低,淋巴瘘发生率低,是值得临床推广的一种手术方式。
作者贡献
黄雷: 收集患者资料、参与临床试验、术后随访及撰写文章
魏少忠: 临床试验,指导论文写作
崔殿生: 临床试验
贾全安: 辅助临床试验
刘三河: 收集患者资料
邓康俐: 研究的统计学分析
| [1] | Chipollini J, Necchi A, Spiess PE. Outcomes for Patients with Node-positive Penile Cancer: Impact of Perioperative Systemic Therapies and the Importance of Surgical Intervention[J]. Eur Urol, 2018, 74(2): 241–2. DOI:10.1016/j.eururo.2018.04.025 |
| [2] | Baiocchi G, Cestari FM, Rocha RM, et al. Does the count after inguinofemoral lymphadenectomy in vulvar cancer correlate with outcome?[J]. Eur J Surg Oncol, 2013, 39(4): 339–43. DOI:10.1016/j.ejso.2013.02.012 |
| [3] | Micheletti L, Bogliatto F, Massobrio M. Groin lymphadenectomy with preservation of femoral fascia: total inguinofemoral node dissection for treatment of vulvar carcinoma[J]. World J Surg, 2005, 29(10): 1268–76. DOI:10.1007/s00268-005-7745-9 |
| [4] | Colberg C, van der Horst C, Jünemann KP, et al. Epidemiology of penile cancer[J]. Urologe A, 2018, 57(4): 408–12. DOI:10.1007/s00120-018-0593-7 |
| [5] | Júnior PFM, Silva EHV, Moura KL, et al. Increased Risk of Penile Cancer among Men Working in Agriculture[J]. Asian Pac J Cancer Prev, 2018, 19(1): 237–41. |
| [6] | Elsamra SE, Poch MA. Robotic inguinal lymphadenectomy for penile cancer: the why, how, and what[J]. Transl Androl Urol, 2017, 6(5): 826–32. DOI:10.21037/tau |
| [7] | Chipollini J, Tang DH, Manimala N, et al. Evaluating the accuracy of intraoperative frozen section during inguinal lymph node dissection in penile cancer[J]. Urol Oncol, 2018, 36(1): 14.e1–14.e5. |
| [8] | Singh A, Jaipuria J, Goel A, et al. Comparing Outcomes of Robotic and Open Inguinal Lymph Node Dissection in Patients with Carcinoma of the Penis[J]. J Urol, 2018, 199(6): 1518–25. DOI:10.1016/j.juro.2017.12.061 |
| [9] | Ornellas AA, Kinchin EW, Nóbrega BL, et al. Surgical treatment of invasive squamous cell carcinoma of the penis:Brazilian National Cancer Institute long-term experience[J]. J Surg Oncol, 2008, 97(6): 487–95. DOI:10.1002/(ISSN)1096-9098 |
| [10] | Leone A, Diorio GJ, Pettaway C, et al. Contemporary management of patients with penile cancer and lymph node metastasis[J]. Nat Rev Urol, 2017, 14(6): 335–47. DOI:10.1038/nrurol.2017.47 |
| [11] | Tsaur I, Biegel C, Gust K, et al. Feasibility, complications and oncologic results of a limited inguinal lymph node dissection in the management of penile cancer[J]. Int Braz J Urol, 2015, 41(3): 486–95. DOI:10.1590/S1677-5538.IBJU.2014.0304 |
| [12] | Sotelo R, Sánchez-Salas R, Carmona O, et al. Endoscopic lymphadenectomy for penile carcinoma[J]. J Endourol, 2007, 21(4): 364–7. DOI:10.1089/end.2007.9971 |
| [13] | Tobias-Machado M, Tavares A, Silva MN, et al. Can video endoscopic inguinal lymphadenectomy achieve a lower morbidity than open lymph node dissection in penile cancer patients?[J]. J Endourol, 2008, 22(8): 1687–91. DOI:10.1089/end.2007.0386 |
 2019, Vol. 46
2019, Vol. 46