文章信息
- FH检测在直肠恶性肿瘤早期筛查中的诊断价值
- Diagnostic Value of FH Test for Early Screening of Rectal Cancer
- 肿瘤防治研究, 2019, 46(4): 350-354
- Cancer Research on Prevention and Treatment, 2019, 46(4): 350-354
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.18.1236
- 收稿日期: 2018-08-29
- 修回日期: 2019-03-15
2. 050011 石家庄, 河北中医学院附属医院肛肠科;
3. 050011 石家庄, 河北中医学院附属医院急诊科
2. Department of Anorectum, Affiliated Hospital of Hebei University of Chinese Medicine Anorectum Section, Shijiazhuang 050011, China;
3. Department of Emergency, Affiliated Hospital of Hebei University of Chinese Medicine, Shijiazhuang 050011, China
直肠恶性肿瘤(rectal cancer)是消化道一种常见恶性肿瘤,其发病率排中国肿瘤发病率第四位,死亡率居第五位[1]。近年来由于城市化的加剧及居民饮食结构的改变,我国直肠恶性肿瘤的发病率逐年升高,严重威胁人民的生命健康。由于其早期无明显症状,极易漏诊,待发现时多处于中晚期,预后不良,因此早发现、早诊断、早治疗可有效提高直肠癌的5年生存率和治愈率[2]。
目前我国直肠恶性肿瘤筛查方式主要包括:直肠指诊、电子结肠镜检查、肿瘤标志物基因检测、大便潜血试验、粪便-DNA检测等。这些检查手段各有优劣,其中直肠指诊经济、便捷,但对于直肠中上段病变的漏诊率较大,只适用于病变部位较低的直肠恶性肿瘤中晚期患者,特异性及敏感度均较低。电子结肠镜检查适用于高危人群,精确度及费用均较高,但其为侵入性检查,且受肠道准备情况、医者操作技术等影响较大,易并发肠道穿孔、出血等[3];肿瘤标志物基因检测属于广谱性肿瘤标志物,常用于胃肠道恶性肿瘤的诊断、判断预后、检测疗效、肿瘤复发等[4],费用较高,检测时间长;大便潜血试验特异性及敏感度相对较低;粪便-DNA检测特异性高但敏感度低,价格高,在我国经济贫困地区仍难以推广。
因此,本研究以病理组织学诊断为金标准,以电子结肠镜检查为辅助,将300例受试者分别进行直肠上皮细胞稳定性细胞游离亚铁原卟啉,即细胞内游离血红素(cell free ferrous protoporphyrin, FH)检测、癌胚抗原(CEA)检测、糖类抗原19-9(CA19-9)检测,并进行对比分析,评价直肠上皮细胞稳定性FH检测诊断直肠恶性肿瘤的临床意义。
1 资料与方法 1.1 研究对象研究对象来源于2017年9月—2018年3月在河北省中医院肛肠科就诊及住院的患者。所有患者均行肛门指诊及结直肠镜检查,发现异常者行组织病理学及影像学检查,按照中华医学会消化病学分会《中国结直肠癌预防共识意见》[5]及《中国结直肠癌诊疗规范(2017版)》[6]制定诊断依据及纳入、排除标准进行筛选。筛选出300例,其中男性173例,女性127例,年龄17~89岁,平均(53.44±14.36)岁。结合患者病史,经电子结肠镜、组织病理学及影像学检查初次确诊为直肠肿瘤患者38例,年龄36~87岁,平均年龄(58.97±11.49)岁;确诊为直肠恶性肿瘤术后患者46例,包括44例未复发患者及2例复发患者(后并入直肠肿瘤组),年龄45~85岁,平均年龄(60.65±10.04)岁;结直肠息肉患者17例,年龄65~79岁,平均年龄(71.53±5.68)岁;结直肠炎患者49例,年龄17~80岁,平均年龄(51.86±14.11)岁。余患者共150人,其中肛窦炎患者24例;痔疮患者45例;肛瘘患者15例;肛周脓肿患者6例;肛裂患者25例;便秘患者32例;肛门及结直肠黑变病患者1例;骶前囊肿患者2例。所有患者签署知情同意书,且通过医院医学伦理委员会审查批准。
1.2 纳入标准及排除标准 1.2.1 纳入标准(1)符合西医诊断标准;(2)所有病例均为我院就诊及住院患者;(3)所有患者均进行病史询问、体格检查、肛门指检、血常规、结直肠镜检查;上述检查异常者自愿行病理学检查、腹部彩超、全身淋巴结彩超、上腹部CT+下腹部CT+盆腔MR扫描等以协助诊断;(4)被检人员依从性良好、自愿参加,并签订知情同意书。
1.2.2 排除标准(1)有精神病疾患者;(2)有自主意识但不愿意接受此项筛查者;(3)病情危重,无法进行相关检查的患者。
1.3 FH检测 1.3.1 直肠黏膜细胞稳定性FH检测试剂(医用型单人份) 1.3.1.1 试剂来源本产品来自于由青岛东孚美伦生物科技有限公司(备案号:鲁青械备20140008号生产备案号:鲁青食药监械生产备20160025号)。检测方法严格按照FH试剂盒的操作步骤进行。
1.3.1.2 样本收集及要求准备好一次性手套、液体石蜡油、一次性肛门镜、直肠黏膜细胞稳定性FH检测试剂,检查并确认本试剂包装完好;采样部位在取样前不得清洗、上药、搔刮;嘱患者取膝胸位或侧卧位,用液体石蜡润滑一次性肛门镜后,将其置入肛管齿状线处,持采样拭子,在齿状线附近轻柔的擦拭获取直肠黏膜渗液,充分蘸取后,将取样器头部放入C试剂(样本瓶)内充分搅动,使所采集标本与C试剂充分混匀,静置约10 s后,当即检验。
1.3.1.3 检测方法(1)将A试剂滴管管口两翼部顺时针旋转折断,把试剂准确滴入测试池;(2)将已空置的A滴管在C试剂内吸取样本液不少于1 ml滴入测试池;(3)旋转折断B试剂滴管,将试剂准确滴入测试池;(4)操作完毕后,120 s内将测试池的显色与比色板进行比对,获得检测结果。
1.3.1.4 观察指标判定标准阴性:试剂不变色;弱阳性:试剂呈淡蓝色或淡绿色;阳性:试剂呈淡绿色或蓝色;强阳性:试剂呈深蓝色。总阳性率=(弱阳性+阳性+强阳性)/总人数×100%。
1.3.1.5 注意事项若显示池内标本先显示上述某种颜色,后转为深黄色或棕红色,表明样本内混有血液,应按照先出现的颜色进行结果判读(深黄色或棕红色是混有血液的征象)。
1.3.2 肿瘤标志物(CEA)检测 1.3.2.1 检测过程被检测患者无需限制饮食,血液样本用一次性专用血液样本采集管抽取全血,送检验科检验。
1.3.2.2 判定标准阴性:CEA测定结果≤3.40 ng/L;阳性:CEA测定结果 > 3.40 ng/L。
1.3.3 糖类抗原19-9(CA19-9)检测 1.3.3.1 检测过程同1.3.2.1
1.3.3.2 判定标准阴性:CA19-9测定结果≤27.00 ng/L;阳性:CA19-9测定结果 > 27.00 ng/L。
1.4 统计学方法采用SPSS21.0统计学软件进行数据分析,计量资料用均数±标准差(x±s)表示,两组间比较采用t检验;计数资料用率表示,组间比较采用χ2检验,多样本比较采用秩和检验,等级分布比较采用秩和检验,P < 0.05为差异有统计学意义。
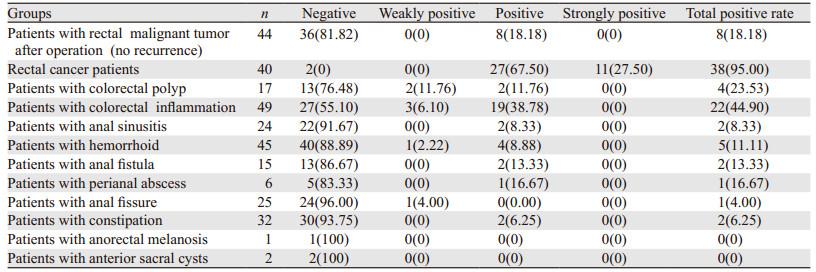
2 结果 2.1 FH检测结果直肠恶性肿瘤术后患者46例(此46例患者在本次检测前已行直肠恶性肿瘤切除术),FH检测10例阳性,后经病理学检查已确诊2例为肿瘤复发,此2例并入直肠恶性肿瘤组,故直肠恶性肿瘤术后未复发患者44例中,FH检测8例阳性,阳性率18.18%;此44例患者术后均进行化疗,且定期复查上腹部CT+下腹部CT+盆腔核磁,取造瘘口(造瘘患者)附近组织或直肠吻合口(保肛患者)附近组织送病理,未见肿瘤,定期随访(2月为一周期)未见异常,仍继续随访。最终确诊为直肠恶性肿瘤患者40例,(2例术后复发患者及38例首次发现肿瘤患者),FH检测38例阳性,阳性率95%,此40例直肠癌患者经病理学检查确诊早期直肠癌有30例,FH阳性28例,阳性率93.33%。中晚期10例,FH阳性10例,阳性率100%。由此可见,直肠黏膜细胞稳定性FH检测结果有较高的敏感度。结直肠息肉患者17例,FH检测4例阳性,阳性率23.53%,经病理学检查腺瘤样息肉12例,其中2例绒毛状腺瘤,2例绒毛状管状腺瘤,8例管状腺瘤,癌前病变检出率33.33%,见表 1。
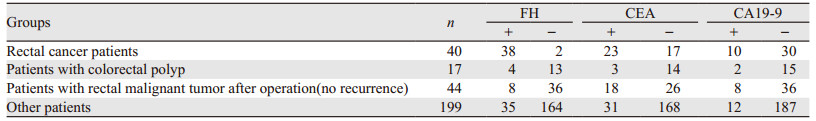
300例入组患者,分别进行FH、肿瘤标志物癌胚抗原(CEA)及糖类抗原19-9(CA19-9)测定,结果见表 2~4。
|
|
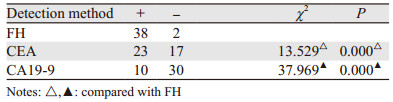
由表 1~3可得出FH检测直肠恶性肿瘤具有较CEA、CA19-9更高的阳性率。可以认为FH检测与CEA、CA19-9检测直肠恶性肿瘤受试者中检出率有差别。
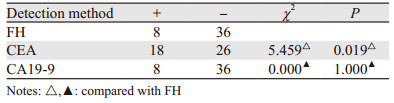
由表 4得出FH检测直肠恶性肿瘤术后未复发患者阳性率低于CEA,与CA19-9持平,可以认为FH检测与CEA检测此组患者有差异,FH检测与CA19-9检测此组患者检出率无差别。
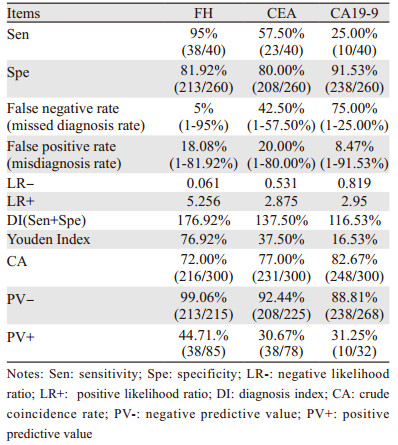
2.3 三种检测方法临床常用评价指标以所有受试者的病理检查诊断结果为金标准,以电子结肠镜检查为辅助,将三种方法的检测结果分别计算出敏感度、特异性、假阴性率(漏诊率)、假阳性率(误诊率)、阴性似然比(LR-)、阳性似然比(LR+)、诊断指数(DI)、Youden指数、粗符合率(CA)、阴性预测值(PV-)、阳性预测值(PV+)等指标,见表 5~6。

|
|
通过表 5~6可直观的看出,三种检测方法在直肠恶性肿瘤筛查中FH检测的敏感度、阳性似然比、诊断指数、约登指数、阴性预测值、阳性预测值均高于CEA和CA19-9检测,假阴性率和阴性似然比低于两者。CA19-9检测的特异性、假阴性率、阴性似然比、粗符合率最高,敏感度,假阳性率、诊断指数、约登指数及阴性预测值最低。CEA检测则假阳性率最高,特异性、阳性似然比、阳性预测值最低。
3 讨论CEA和CA19-9是消化道恶性肿瘤应用较为广泛的标志物,无显著脏器特异性,且在肿瘤早期诊断中CA19-9的敏感度较低,部分直肠恶性肿瘤患者未能被检出,但某些非癌性因素如糖尿病、结肠炎、肝炎等因素也会导致CEA、CA19-9轻度升高,会存在一定的假阳性率。
肠道未见肿瘤、息肉的非肿瘤术后患者,FH仍检出部分阳性患者,可能是由于此类患者因炎症性肠病、混合痔出血、或肛瘘分泌脓液等原因致使收集的直肠脱落细胞结构不稳定,易出现假阳性率。
广泛存在于细胞内的亚铁血红素参与多种酶的构成[7],生理状态下,其通常以结合蛋白的形式发挥作用[8],在致癌因子的作用下,抑癌基因(尤以是抑癌基因p53为主)发生突变或缺失,细胞内稳定结构被破坏,能量代谢紊乱,细胞内蛋白构象发生改变,使某类亲脂性物质进入含亚铁原卟啉蛋白的疏水核内,导致亚铁原卟啉脱落为游离状态,称之为FH物质。游离的FH物质作为一种可氧化损伤细胞的活性基团,结构极不稳定,会夺取邻近的组织(脂肪、蛋白质及DNA等)的电子,以稳定自己的状态,而被夺取电子的组织结构则形成自由基,去夺取新的的电子,似多诺米骨牌效应,随着细胞的损伤加重导致细胞稳态失衡,使细胞增生加速、凋亡减少、分化降低,最终恶变,促进溶酶体水解酶溢出引起细胞自溶加重,FH物质渗出增多,并且其渗出量与上皮细胞的恶性程度成正比[9]。综上所述,FH物质可作为癌前病变标志物对高危患者进行早期筛查[10-12]。
FH检测主要是通过FH与特定物质的氧化还原反应使直肠上皮细胞染色,根据着色的深浅分析患者病变程度[13]。它具有较高的敏感度,即使在早期肿瘤患者中也有较高的阳性率,阳性患者会提高警惕并在短时间内通过病理学检查以确诊,符合早发现、早诊断、早治疗的原则,癌前病变及早期肿瘤患者经积极治疗可有效提高直肠癌的5年生存率和治愈率。是自检型产品,检测结果可根据目测比色法[14]即查即得,简单易行,经济实用,具有临床可行性。在贫困、偏远地区及基层医院有较高的使用价值,可扩大直肠恶性肿瘤的筛查规模,降低直肠恶性肿瘤的患病率及死亡率,为我国直肠恶性肿瘤的筛查手段提供了新的思路。
作者贡献
马茜: 采集样本、收集患者资料、撰写论文
黄晓明、郭亚苹: 采集样本、收集患者资料
高记华: 指导试验及论文书写
高策、戚文月、郭虹君: 采集样本、收集患者资料
| [1] | 郑晓金, 李凯, 欧凤荣. 结直肠癌相关危险因素研究进展[J]. 实用药物与临床, 2018, 21(10): 116–9. [ Zheng XJ, Li K, Ou FR. Research progress on risk factors for colorectal cancer[J]. Shi Yong Yao Wu Yu Lin Chuang, 2018, 21(10): 116–9. ] |
| [2] | 亓云鹏. 消化内镜技术对消化道肿瘤的早期诊断与治疗价值[J]. 世界最新医学信息文摘, 2018, 18(A2): 209, 212. [ Qi YP. Value of digestive endoscopy in early diagnosis and treatment of gastrointestinal tumors[J]. Shi Jie Zui Xin Yi Xue Xin Xi Wen Zhai, 2018, 18(A2): 209, 212. ] |
| [3] | Waldmann E, Regula J, Ferlitsch M. How can screening colonoscopy be optimized?[J]. Dig Dis, 2015, 33(1): 19–27. DOI:10.1159/000366033 |
| [4] | 陈舒颖, 邱芳华, 李秋明, 等. 血清DCD、CA199、CA724和CEA联合检测对大肠癌的诊断价值[J]. 实用医学杂志, 2017, 33(15): 64–7. [ Chen SY, Qiu FH, Li QM, et al. Value of cobined detection of serum DCD, CA199, CA724, and CEA in diagnosis of colorectal cancer[J]. Shi Yong Yi Xue Za Zhi, 2017, 33(15): 64–7. ] |
| [5] | 房静远, 时永全, 陈萦晅, 等. 中国结直肠癌预防共识意见(2016年, 上海)[J]. 胃肠病学, 2016, 21(11): 668–86. [ Fang JY, Shi YQ, Chen YX, et al. Consensus on the prevention of colorectal cancer in China(Shanghai, 2016)[J]. Wei Chang Bing Xue, 2016, 21(11): 668–86. DOI:10.3969/j.issn.1008-7125.2016.11.006 ] |
| [6] | 孙燕, 顾晋, 汪建平. 中国结直肠癌诊疗规范(2017年版)[J]. 上海医学, 2018, 41(8): 449–63. [ Sun Y, Gu J, Wang JP. Standard for diagnosis and treatment of colorectal cancer in China(2017 edition)[J]. Shanghai Yi Xue, 2018, 41(8): 449–63. ] |
| [7] | Kühl T, Imhof D. Regulatory Fe(Ⅱ/Ⅲ) heme: the reconstruction of a molecule's biography[J]. Chembiochem, 2014, 15(14): 2024–35. DOI:10.1002/cbic.201402218 |
| [8] | 陈艳辉, 周训华, 赵莹. 子宫上皮细胞稳定性细胞游离亚铁原卟啉对宫颈癌的诊断意义[J]. 中国医药导报, 2018, 15(2): 79–82. [ Chen YH, Zhou XH, Zhao Y. The diagnostic significance of the uterine epithelial cells stability of the cells free ferrous protoporphyrin for cervical cancer[J]. Zhongguo Yi Yao Dao Bao, 2018, 15(2): 79–82. ] |
| [9] | Kim YJ, Munsell MF, Park JC, et al. Retrospective review of symptoms and palliative care interventions in women with advanced cervical cancer[J]. Gynecol Oncol, 2015, 139(9): 553–8. |
| [10] | 王小丹, 刘珊, 徐海滨, 等. 重组人乳铁蛋白对缺铁性贫血大鼠铁营养状况的改善作用[J]. 卫生研究, 2012, 41(1): 137. [ Wang XD, Liu S, Xu HB, et al. Effect of recombinant human lactoferrin on iron nutrition in rats with iron deficiency anemia[J]. Wei Sheng Yan Jiu, 2012, 41(1): 137. ] |
| [11] | 王永峰, 杜成林, 李保海, 等. COX-2和突变型p53在人胶质细胞瘤组织中的表达及意义[J]. 山东医药, 2014, 54(26): 80–1. [ Wang YF, Du CL, Li BH, et al. Expression and significance of COX-2 and mutant p53 in human Glioblastoma[J]. Shandong Yi Yao, 2014, 54(26): 80–1. DOI:10.3969/j.issn.1002-266X.2014.26.033 ] |
| [12] | 徐光. EGFR、p53、Fascin蛋白在鼻咽癌组织中表达[J]. 中国公共卫生, 2015, 31(10): 1356–8. [ Xu G. Protein expressions of EGFR, p53, and fascin in nasopharyngeal carcinoma tissue and their clinical significance[J]. Zhongguo Gong Gong Wei Sheng, 2015, 31(10): 1356–8. DOI:10.11847/zgggws2015-31-10-35 ] |
| [13] | Lehtinen M, Lagheden C, Luostarinen T, et al. Ten-year follow-up of human papillomavirus vaccine efficacy against the most stringent cervical neoplasia end-point-registry-based follow-up of three cohorts from randomized trials[J]. BMJ Open, 2017, 7(8): e015867. DOI:10.1136/bmjopen-2017-015867 |
| [14] | 姚前尹, 林绍强, 李囡, 等. 亚铁螯合酶抑制诱导细胞内原卟啉Ⅸ积聚的肿瘤荧光成像[J]. 暨南大学学报(医学版), 2011, 32(4): 387–92. [ Yao QY, Lin SQ, Li N, et al. Tumor fluorescence detection technique researches on accumulation of protoporphyrin-Ⅸ in cancer cells induced by FECH-siRNA[J]. Ji'nan Da Xue Xue Bao(Yi Xue Ban), 2011, 32(4): 387–92. ] |
 2019, Vol. 46
2019, Vol. 46