文章信息
- 18F-FDG PET/CT SUVmax与乳腺浸润性导管癌临床病理特征及新辅助化疗疗效的相关性
- Correlation Between 18F-FDG PET/CT SUVmax and Clinicopathological Features, Neoadjuvant Chemotherapy Response in Invasive Ductal Breast Carcinoma Patients
- 肿瘤防治研究, 2019, 46(2): 144-148
- Cancer Research on Prevention and Treatment, 2019, 46(2): 144-148
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.18.1230
- 收稿日期: 2018-08-29
- 修回日期: 2018-11-30
乳腺浸润性导管癌(invasive ductal carcinoma)是最常见的乳腺癌病理类型,约占乳腺癌的70%。18F-脱氧葡萄糖(18F-fluorodeoxy glucose, 18F-FDG)正电子发射计算机断层扫描(positron emission tomography/computed tomography, PET/CT)在乳腺癌诊断、预测疗效及预后中有重要的价值,能提供病灶的解剖学和生物学信息。有研究表明在乳腺癌新辅助化疗早期,病理完全缓解(pathological complete response, pCR)组最大标准摄取值(maximum standard uptake value, SUVmax)的下降率显著高于化疗无效组,能预测乳腺癌的病理反应[1-2]。本试验欲研究乳腺癌病灶治疗前18F-FDG摄取率与患者临床病理特征及新辅助化疗疗效的关系,以期指导临床实现个体化治疗。
1 资料与方法 1.1 研究对象回顾性分析2010年7月—2016年12月在佛山市第一人民医院进行18F-FDG PET/CT检查的初治乳腺患者272例,基线检查未见远处转移征象;化疗前行粗针穿刺确定原发肿瘤为浸润性导管癌,并行腋窝淋巴结细针穿刺明确有无淋巴结转移。患者术前行4~6周期新辅助化疗(完成4周期者185例、完成6周期者87例),末次化疗结束后2周左右在我院接受手术治疗,根据手术后病理诊断确定病理反应程度。排除标准:炎性乳腺癌及双侧乳腺癌患者。乳腺癌TNM分期按照第8版美国癌症联合委员会(American Joint Committee on Cancer, AJCC)癌症分期标准。
1.2 一般资料本组乳腺浸润性导管癌患者共272例,均为女性,年龄29~71岁,中位年龄49岁。TNM临床分期Ⅰ期52例、Ⅱ期156例、Ⅲ期64例;ER和(或)PR阳性165例、ER及PR均阴性107例;HER2阳性99例、HER2阴性173例;Ki-67≥14%者191例、Ki-67 < 14%者81例。不同分子亚型:Luminal A型50例、Luminal B/HER2-型71例、Luminal B/HER2+型44例、HER2过表达型55例和Basal-like型52例。有腋窝和(或)锁骨区淋巴结转移155例、无淋巴结转移117例;组织学分级:Ⅰ级12例、Ⅱ级230例、Ⅲ级30例。
1.3 方法 1.3.1 PET/CT检查采用Philips公司GEMINI型PET-CT扫描仪,18F-FDG由中国原子能科学研究院广州市同位素中心提供,放化纯度 > 95%。所有患者检查前均禁食≥6 h,控制血糖在正常范围;于肘静脉处注射18F-FDG,注射剂量为4.44~5.18 MBq/Kg;静卧60 min后行体部PET/CT显像。PET成像采用3D采集模式,3 min/床位,数据经Ramla 3D方法获得衰减校正图像;CT扫描参数:120 KV,130 mAs,螺距1.0,层厚6.5 mm。
1.3.2 图像分析由两名有经验的核医学医师单独阅片,根据PET/CT融合图像测定病灶最大径,沿乳腺癌病灶勾画感兴趣区(region of interest, ROI)获得病灶的SUVmax。
1.3.3 免疫组织化学及分子分型标准化疗前行粗针穿刺,并进行免疫组织化学测定雌激素受体(estrogen receptor, ER)、孕激素受体(progesterone receptor, PR)、人表皮生长因子受体2(human epidermal growth factor receptor 2, HER2)以及Ki-67的表达情况。分子分型标准参照2015年St. Gallens指南分为:(1)Luminal A型(ER+和(或)PR+,HER2-,Ki-67≤14%);(2)Luminal B/HER2+型(ER+和(或)PR+,HER2+,任意Ki-67);(3)Luminal B/HER2-型(ER+和(或)PR+,HER2-,Ki-67 > 14%);(4)HER2过表达型(ER-/PR-/HER2+);(5)Basal-like型(ER-/PR-/HER2-)五组分子亚型。
1.3.4 新辅助化疗方案患者行4~6疗程的新辅助化疗,其中采用TEC方案(多西他赛、表阿霉素和环磷酰胺)139例、CEF方案(环磷酰胺、表阿霉素和氟脲苷)61例、TC方案(多西他赛和环磷酰胺)72例。
1.3.5 病理疗效判断根据国内病理界常用Miller & Payne系统,将化疗前的粗针穿刺标本与化疗后的手术标本进行比较,根据肿瘤细胞消退情况,将病理学反应分为5级:1级(G1)浸润癌细胞无改变或仅个别癌细胞发生改变,癌细胞数量总体未减少;2级(G2)浸润癌细胞轻度减少,但总数量仍高,癌细胞减少不超过30%;3级(G3)浸润癌细胞减少介于30%~90%;4级(G4)浸润癌细胞显著减少超过90%,仅残存散在的小簇状癌细胞或单个癌细胞;5级(G5)原肿瘤瘤床部位已无浸润癌细胞,但可存在导管原位癌。本研究中把G1+G2归为病理无效组,而将G3+G4+G5归为病理有效组;G5且区域淋巴结阴性者为病理完全缓解(pCR)组。
1.4 统计学方法应用SPSS17.0统计软件进行数据分析;计量资料以均数±标准差(x±s),两样本资料比较使用t检验进行统计分析,多个样本资料均数比较使用方差分析;不同组间病理缓解率比较使用卡方检验或Fisher精确检验;P < 0.05为差异有统计学意义。
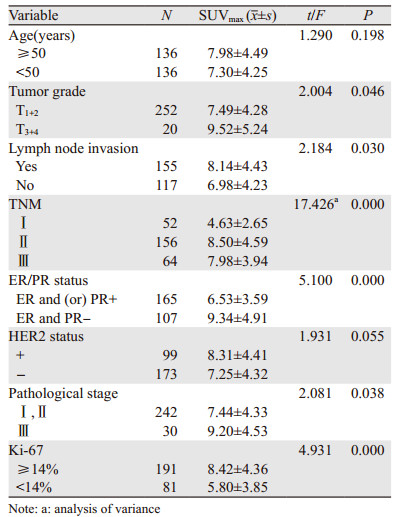
2 结果 2.1 乳腺癌原发灶SUVmax与患者临床病理特征的关系乳腺癌原发病灶SUVmax在不同T分期、不同组织学分级及有无淋巴结转移方面差异有统计学意义(t=2.004, 2.081, 2.184, 均P < 0.05),Ki-67表达阳性者(≥14%)乳腺癌病灶SUVmax更高,而ER和(或)PR表达阳性者SUVmax较低(t=5.100, P=0.000);不同临床分期乳腺癌患者SUVmax差异有统计学意义(F=17.426, P=0.000)。而不同年龄分组、HER2阳性组与阴性组之间SUVmax差异无统计学意义(P > 0.05),见表 1。
|
Luminal A型、Luminal B/HER2-型、Luminal B/HER2+型、HER2过表达型及Basal-like型的SUVmax平均值分别为4.74±2.59、7.30±3.77、7.34±3.61、9.09±4.85、9.61±5.01;Luminal A与其他四种分子亚型相比SUVmax最低,差异有统计学意义(t=4.428, 3.961, 5.810, 6.203, P=0.000);Luminal B/HER2-型与Luminal B/HER2+型两者SUVmax比较差异无统计学意义(t=0.051, P > 0.05),Luminal B/HER2-型SUVmax低于HER2过表达型和Basal-like型(t=2.263, 2.917, P=0.026、0.004),Luminal B/HER2+型SUVmax同样低于HER2过表达型和Basal-like型(t=2.065, 2.507, P=0.042、0.014);而HER2过表达型和Basal-like型两种亚型SUVmax差异无统计学意义(t=0.541, P > 0.05)
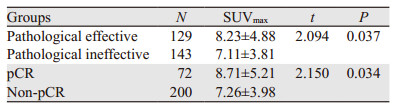
2.3 乳腺癌原发灶SUVmax与病理有效率、病理完全缓解率的关系272例新辅助化疗患者,达到pCR者72例(26.5%),病理有效者129例(47.4%);病理有效组原发病灶SUVmax基线明显高于病理无效组(t=2.904, P=0.037);pCR组病灶SUVmax高于未达到pCR者(t=2.150, P=0.034),见表 2。
|
Luminal A型、Luminal B/HER2-型、Luminal B/HER2+型、HER2过表达型及Basal-like型的新辅助化疗病理有效率分别为20.0%、42.3%、63.6%、58.1%、55.8%,病理完全缓解率分别为8.0%、18.3%、38.6%、34.5%、35.8%。Luminal A型病理有效率及病理完全缓解率均最低,病理有效率与其他亚组相比差异有统计学意义(χ2=6.565、18.504、15.909、13.810, 均P < 0.05);病理完全缓解率与Luminal B/HER2+型、HER2过表达型及Basal-like型比较差异有统计学意义(χ2=12.527、11.771、10.686、11.887, 均P < 0.05),而与Luminal B/HER2-型比较差异无统计学意义(χ2=2.561, P=0.121)。Luminal B/HER2+型、HER2过表达型及Basal-like型乳腺癌更容易获得病理完全缓解,见图 1,但这三种分子亚型乳腺癌新辅助化疗的病理有效率及病理完全缓解率差异无统计学意义(χ2=0.752、0.194, 均P > 0.05)。
|
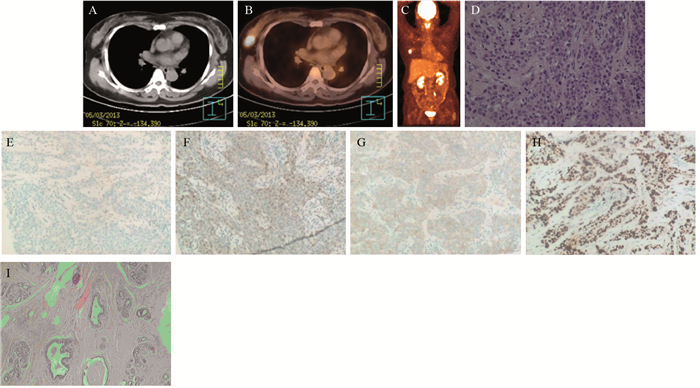
| Female, 48 years old, physical examination results showed a nodule in the right breast. A: a nodule in the right breast, nodule size was 2.6 cm×1.9 cm; B: fusion image of PET and CT, SUVmax 19.8; C: PET maximum intensity projection results showed there was no metastasis; D: pathological results: infiltrating ductal carcinoma gradeⅡ(HE ×10); E-H: ER(-), PR(-), HER-2(1+), Ki-67 60%(IHC ×10); I: pathological complete response after neoadjuvant chemotherapy(HE×40) 图 1 Basal-like型患者化疗后病理完全缓解 Figure 1 Pathological complete response in Basal-like patient after neoadjuvant chemotherapy |
18F-FDG PET/CT显像从分子水平检测肿瘤的代谢情况,通过观察病灶对18F-FDG的摄取率来反映其葡萄糖代谢水平,从而提供肿瘤的组织细胞功能及能量代谢信息。近年来,18F-FDG PET/CT显像已作为乳腺癌诊疗工作中重要的检查手段被广泛应用[3-4]。18F-FDG的摄取与肿瘤细胞的增殖活性、存活肿瘤细胞数量、分化程度以及微血管密度等均有关,因此可以反映肿瘤的生物学侵袭性、预后[5-6]。
SUVmax是目前18F-FDG PET/CT最常用的半定量分析指标。文献报道,原发乳腺癌的SUVmax与肿瘤的大小相关;另外,原发病灶的组织学分级、有无区域淋巴结转移也将影响肿瘤18F-FDG摄取[7-8]。本研究发现临床T1+2期的病灶SUVmax高于T3+4期者;组织学分级Ⅰ+Ⅱ级的病灶SUVmax低于Ⅲ级病灶的SUVmax,有区域淋巴结转移者18F-FDG的摄取率高于无淋巴结转移者,与文献报道结果一致。上述结果说明乳腺癌原发灶体积越大、肿瘤细胞分化程度越低以及出现淋巴结转移者,其恶性程度越高,病灶的SUVmax就越高,18F-FDG摄取情况间接地反映了肿瘤的生物学行为。
国外许多研究[9-10]对不同分子亚型乳腺癌FDG PET/CT SUVmax比较发现:HER2过表达型和Basal-like型的SUVmax明显大于Luminal A型,而Luminal B型乳腺癌SUVmax介于两者之间,而本研究亦发现Luminal A型SUVmax明显低于其他四种分子亚型乳腺癌,HER2过表达型和Basal-like型的SUVmax相对其他分子亚型明显增高。本研究发现ER和PR阴性组的SUVmax明显高于阳性组,差异有统计学意义(P < 0.05),说明FDG PET/CT所测得的SUVmax对区分Luminal型与非Luminal型乳腺癌有一定意义。
HER2表达阳性常常提示肿瘤的恶性程度增高、侵袭能力增强,被认为是预测乳腺癌预后的独立因子[11]。但HER2的表达情况是否与18F-FDG的摄取有关,研究结果存在争议:张月明等[12]研究发现HER2表达阳性者的SUVmax明显增高,这可能与HER2促进细胞分裂、蛋白水解酶分泌增多,从而导致癌细胞生长加快有关;但也有文献报道HER2的状态与18F-FDG的摄取无明显相关性[13],与本研究结果一致,可能因为:(1)乳腺癌原发病灶具有的异质性;(2)本研究把Luminal B/HER2+和HER2过表达两种分子亚型均纳入了HER2表达阳性组,而HER2的信号转导通路可能与ER、PR的表达存在联系[14],ER、PR阳性者会抑制HER2的表达。本研究入组患者均为浸润性导管癌,需要增加其他病理类型多中心、多因素分析。
Ki-67是反映肿瘤细胞增殖活性的指标,与肿瘤的预后相关[15]。Ki-67的表达水平越高则表明肿瘤增殖越快,对18F-FDG的摄取就会增加,本研究中,Ki-67阳性组的SUVmax高于Ki-67阴性组,与文献报道一致[16],说明SUVmax和Ki-67表达存在一定相关性,SUVmax在某种程度上能反映肿瘤细胞的增殖情况,与乳腺癌患者的治疗和预后密切相关。
新辅助化疗不仅能使局部晚期乳腺癌患者肿瘤缩小、降低分期,增加患者的保乳机会,并且有助于了解肿瘤对化疗的敏感程度;美国国立综合癌症网络(national committee on computer network, NCCN)指南提出原发病灶直径 > 1 cm的HER2表达阳性和Basal-like的早期乳腺癌患者可选择运用新辅助化疗,达到pCR的患者生存时间长、预后改善。研究表明,18F-FDG PET/CT显像可根据新辅助化疗早期标准摄取值的变化率来预测患者能否达到病理完全缓解[17],但是治疗前SUVmax基线水平与新辅助化疗疗效相关性的研究较少,本研究结果发现新辅助化疗后达到pCR者治疗前SUVmax高于未达到pCR者,与张立清等[18]报道一致。笔者发现HER2过表达型和Basal-like型乳腺癌患者SUVmax高于其他分子亚型乳腺癌,而HER2过表达型及Basal-like型乳腺癌则对化疗比较敏感,新辅助化疗病理完全缓解率较高,这也说明乳腺癌原发病灶SUVmax较高者应该积极采取新辅助化疗,患者能从中获益。另外本研究中发现Luminal A型乳腺癌新辅助化疗病理有效率及病理完全缓解率均最低,对化疗反应较差,而Luminal A型乳腺癌的18F-FDG的摄取率在5种分子亚型乳腺癌亦最低。对于Luminal B/HER2+型乳腺癌患者虽然18F-FDG摄取低于HER2过表达型和Basal-like型乳腺癌,但仍具有较高的pCR率,这表明ER/PR阳性者如果HER2表达阳性者除内分泌治疗外亦能从新辅助化疗者获益。以上结果说明18F-FDG PET/CT SUVmax对区分乳腺癌分子亚型、指导治疗有一定的意义。
综上所述,18F-FDG PET/CT可作为一种判断乳腺癌分子病理状态的无创检査手段,并能用于预测患者的疗效,能够在指导乳腺癌个体化治疗中发挥重要作用。
作者贡献
鲁胜男:研究实施者和论文执笔者 冯彦林:研究设计者和指导者 李 雯:收集本研究患者临床资料 王 颖:参与图像分析、测定PET/CT定量数据 冼伟均:参与图像分析及统计学分析
| [1] | Berruti A, Amoroso V, Gallo F, et al. Pathologic complete response as a potential surrogate for the clinical outcome in patients with breast cancer after neoadjuvant therapy:a meta-regression of 29 randomize prospective studies[J]. J Clin Oncol, 2014, 32(34): 3883–91. DOI:10.1200/JCO.2014.55.2836 |
| [2] | 李雯, 冯彦林. 乳腺癌分子生物学指标与18F-FDG PET-CT SUVmax的相关性研究[J]. 中国现代医学杂志, 2017, 27(23): 47–51. [ Li W, Feng YL. Correlations of 18F-FDG PET-CT SUVmax with molecular biological markers of breast cancer[J]. Zhongguo Xian Dai Yi Xue Za Zhi, 2017, 27(23): 47–51. DOI:10.3969/j.issn.1005-8982.2017.23.009 ] |
| [3] | Piva R, Ticconi F, Ceriani V, et al. Comparative diagnostic accuracy of 18F-FDG PET/CT for breast cancer recurrence[J]. Breast Cancer (Dove Med Press), 2017, 9: 461–71. |
| [4] | Tural D, Kivark Salim D, Mutlu H, et al. Is there any relation between PET-CT SUVmax value and prognostic factors in locally advanced breast cancer?[J]. J BUON, 2015, 20(5): 1282–6. |
| [5] | Kumar R, Halanaik D, Malhotra A. Clinical applications of positron emission tomography-computed tomography in oncology[J]. Indian J Cancer, 2010, 47(2): 100–19. DOI:10.4103/0019-509X.62997 |
| [6] | Ege Aktas G, Taştekin E, Sarikaya A. Assessment of biological and clinical aggressiveness of invasive ductal breast cancer using baseline 18F-FDG PET/CT-derived volumetric parameters[J]. Nucl Med Commun, 2018, 39(1): 83–93. DOI:10.1097/MNM.0000000000000779 |
| [7] | 徐巧玲, 尤徐阳, 郁春景, 等. 影响乳腺浸润性导管癌原发病灶摄取18F-FDG的相关因素分析[J]. 中华核医学与分子影像杂志, 2016, 36(5): 413–9. [ Xu QL, You XY, Yu CJ, et al. Analysis of relevant factors influencing 18F-FDG uptake in primary lesion of breast invasive ductal carcinoma[J]. Zhonghua He Yi Xue Yu Fen Zi Ying Xiang Za Zhi, 2016, 36(5): 413–9. DOI:10.3760/cma.j.issn.2095-2848.2016.05.008 ] |
| [8] | 汤泊, 张银, 周锦, 等. 18F-FDG PET-CT代谢参数与乳腺癌临床病理特征的关系[J]. 中华肿瘤杂志, 2017, 39(4): 280–5. [ Tang B, Zhang Y, Zhou J, et al. The relationship between 18F-FDG PET-CT metabolic parameters and clinicopathological features of breast cancer[J]. Zhonghua Zhong Liu Za Zhi, 2017, 39(4): 280–5. DOI:10.3760/cma.j.issn.0253-3766.2017.04.008 ] |
| [9] | Koo HR, Park JS, Kang KW, et al. 18F-FDG uptake in breast cancer correlates with immunohistochemically defined subtypes[J]. Eur Radiol, 2014, 24(3): 610–8. DOI:10.1007/s00330-013-3037-1 |
| [10] | Cokmert S, Tanriverdi O, Karapolat I, et al. The maximum standardized uptake value of metastasis site in 18F-FDG PET/CT predicts molecular subtypes and survival in metastasis breast cancer:An Izmir Oncology Group study[J]. J BUON, 2016, 21(6): 1410–8. |
| [11] | Palmieri D, Bronder JL, Herring JM, et al. Her-2 overexpression increases the metastatic outgrowth of breast cancer cells in the brain[J]. Cancer Res, 2007, 67(9): 4190–8. DOI:10.1158/0008-5472.CAN-06-3316 |
| [12] | 张月明, 周晔明, 徐海燕, 等. 18F-FDG PET/CT在复发转移性乳腺癌中的临床价值[J]. 肿瘤, 2018, 38(7): 704–10. [ Zhang YM, Zhou YM, Xu HY, et al. Clinical value of 18F-FDG-PET/CT in recurrent and metastatic breast cancer[J]. Zhong Liu, 2018, 38(7): 704–10. ] |
| [13] | 张倩, 辛军, 李红. 18F-FDG PET/CT显像半定量参数MTV、TLG联合SUV在乳腺癌诊断中的应用价值[J]. 中国临床医学影像杂志, 2016, 27(9): 620–4. [ Zhang Q, Xin J, Li H. Clinical value of 18F-FDG uptake, described by metabolic tumor volume, total lesion glycolysis and standard uptake values in breast cancer[J]. Zhongguo Lin Chuang Yi Xue Ying Xiang Za Zhi, 2016, 27(9): 620–4. ] |
| [14] | 周国江, 杨勇, 赵子龙, 等. 乳腺癌HER-2基因扩增与HER-2neu蛋白表达的一致性及其与临床病理特征的关系[J]. 实用癌症杂志, 2018, 33(5): 728–31. [ Zhou GJ, Yang Y, Zhao ZL, et al. Study on the relationship between the expression of HER-2 gene and the expression of HER2neu protein in breast cancer and its relationship with clinicopathological features[J]. Shi Yong Ai Zheng Za Zhi, 2018, 33(5): 728–31. DOI:10.3969/j.issn.1001-5930.2018.05.010 ] |
| [15] | Elkablawy MA, Albasri AM, Mohammed RA, et al. Ki67 expression in breast cancer.Correlation with prognostic markers and clinicopathological parameters in Saudi patients[J]. Saudi Med J, 2016, 37(2): 137–41. DOI:10.15537/smj.2016.2.12285 |
| [16] | 杨欢, 林美福, 陈晓耕. 乳腺癌18F-脱氧葡萄糖PET-CT标准化摄取值与Ki-67表达的关系及意义[J]. 南昌大学学报(医学版), 2012, 52(3): 52–5, 57. [ Yang H, Lin MF, Chen XG. Relationship between standardized uptake value of 18F-FDG PET/CT and Ki 67 expression in breast cancer[J]. Nan Chang Da Xue Xue Bao (Yi Xue Ban), 2012, 52(3): 52–5, 57. DOI:10.3969/j.issn.1000-2294.2012.03.016 ] |
| [17] | 冯彦林, 鲁胜男, 杨劼, 等. 18F-FDG PET/CT预测乳腺癌新辅助化疗病理反应的价值[J]. 肿瘤防治研究, 2012, 39(10): 1224–7. [ Feng YL, Lu SN, Yang J, et al. Valuation of 18F-FDG PET/CT in predicting pathological reaction of neoadjuvant chemotherapy with breast cancer[J]. Zhong Liu Fang Zhi Yan Jiu, 2012, 39(10): 1224–7. DOI:10.3971/j.issn.1000-8578.2012.10.015 ] |
| [18] | 张立清, 张喜平. 18F-FDG PET-CT与乳腺癌新辅助化疗疗效中的关联性分析[J]. 医学研究杂志, 2017, 46(1): 77–9. [ Zhang LQ, Zhang XP. Association between 18F-FDG PET-CT and curative effect of neoadjuvant chemotherapy for breast cancer[J]. Yi Xue Yan Jiu Za Zhi, 2017, 46(1): 77–9. ] |
 2019, Vol. 46
2019, Vol. 46


