文章信息
- RNA聚合酶Ⅰ抑制剂通过NF-κb调控鼻咽癌细胞系CNE-1的增殖、侵袭与凋亡
- RNA PolymeraseⅠInhibitor Regulates Proliferation, Invasion and Apoptosis of Nasopharyngeal Carcinoma Cell Line CNE-1 by NF-κb
- 肿瘤防治研究, 2019, 46(4): 294-300
- Cancer Research on Prevention and Treatment, 2019, 46(4): 294-300
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.18.1211
- 收稿日期: 2018-08-23
- 修回日期: 2018-11-15
鼻咽癌(Nasopharyngeal carcinoma, NPC)是一种独特的上皮恶性肿瘤。现今发病机制尚不明确。其发病具有明显的地理和民族分布特点,存在一定的遗传易感性,并且与EB病毒感染及环境中的致癌物质等多种因素共同作用有关[1]。随着放射疗法和化学疗法的不断进步,鼻咽癌患者的生存期较之前明显改善。但是不良反应较大,部分患者难以耐受。因此,研发不良反应小、治疗效果更为明显的鼻咽癌治疗药物成为了现今研究者和一线临床医生所面临的主要临床问题。
CX-5461作为一种RNA聚合酶Ⅰ抑制剂,能够有效阻碍真核细胞生物的核糖体rRNA合成,抑制核糖体正常功能,通过调控p53进而抑制肿瘤细胞的病理生理功能。因此,其是一种具有广阔前景的抗肿瘤药物,现于加拿大开展Ⅱ期临床试验(临床试验注册编号:NCT02719977)。本实验为了证实CX-5461在鼻咽癌治疗中的作用,以不同浓度的CX-5461处理CNE-1鼻咽癌细胞系,以观察其对于CNE-1增殖、迁移、凋亡的影响,并试图研究其分子机制,为未来的临床应用提供参考。
CX-5461作为一类靶向作用于polyⅠ的抑制剂,早期研究发现能通过激活p53导致细胞一系列生理病理变化,而p53与NF-κb同时作为细胞内一类极为重要的转录因子,两者存在一定的相互联系。因此我们猜想,CX-5461也可能通过影响NF-κb功能导致细胞增殖、细胞周期、细胞凋亡等病理生理过程的发生,进而起到抑制肿瘤发生、发展的作用。本实验将验证CX-5461是否通过抑制NF-κb功能活化,进而调控肿瘤细胞的发生发展。
1 材料与方法 1.1 实验材料 1.1.1 组织标本按每季度随机抽取2~3例的方法收集2016年1月至2018年2月湖北省肿瘤医院19例鼻咽癌手术患者。所有患者均经鼻咽镜行病理活检,于鼻咽镜下取距癌组织3~5 cm的鼻咽部黏膜9例作对照。所取组织均固定后石蜡包埋。患者活检前未接受放疗和化疗,均经组织活检病理报告确诊为鼻咽癌。排除标准:(1)年龄小于18岁或大于75岁; (2)合并其他部位的原发性肿瘤或转移癌; (3)罹患严重的感染性疾病及免疫功能障碍者; (4)妊娠期和哺乳期女性; (5)精神异常患者等。19例中因1例合并骨转移、1例合并肺转移排除,最终纳入17例患者; 所有标本的收集均获得患者的知情同意,并通过湖北省肿瘤医院伦理委员会审核批准(编号:LLHBCH2018LW-006)。
1.1.2 细胞培养与处理鼻咽癌细胞株CNE-1购自武汉大学细胞库,在含有10%特级胎牛血清(fetal bovine serum, FBS)(中国上海BBI公司)及1%青链霉素(美国Gibco公司)的RPMI 1640培养基中(美国Gibco公司),于37℃、5%CO2培养箱(德国Binder公司)进行培养。以0.25%含有EDTA的胰酶(美国Hyclone公司)进行消化、传代。
1.1.3 实验试剂CX-5461购自美国MCE公司; NF-κb激活蛋白(NF-κb activating protein, NKAP)购自上海生工公司; 免疫组织化学试剂盒购自武汉博奥森公司、山羊抗兔NF-κb一抗(Western blot 1:1 000稀释、免疫组织化学1:100稀释)、山羊抗兔磷酸化NF-κb(Ser536)(Western blot 1:1 000稀释)一抗、山羊抗鼠GAPDH一抗均购自美国Cell Signaling Technology公司。CCK-8试剂盒购自中国碧云天公司,流式周期试剂盒购自中国上海生工公司; Hoechst33342染色液购自上海生工公司,Transwell小室购自美国Costar公司。
1.2 实验方法 1.2.1 免疫组织化学染色法标本收集后石蜡包埋,切片置于烤箱65℃融蜡60 min。将融蜡后的玻片水化。随后将玻片放入枸橼酸修复液中,微波炉修复两次。修复液降至常温后,PBS洗3遍,0.2%Triton,10 min。3%H2O2溶液封闭内源性过氧化物酶10 min。山羊血清封闭10 min。一抗4℃孵育过夜。一抗孵育后PBS洗3遍,二抗孵育,37℃,40 min,PBS洗3遍。DAB显色。正置显微镜下观察。以十三点评分法对免疫组织化学结果进行评价:0分,没有阳性细胞; 1分,阳性细胞百分比 < 10%;2分,阳性细胞百分比≥10%~ < 50%;3分,阳性细胞百分比≥50%~80%;4分,阳性细胞百分比≥80%;染色强度按照阴性、弱、中、强分别评为0~3分。最终评分为两指标的乘积。0~1分为阴性,2~5分为弱阳性,6~9分为阳性,10~12分为强阳性。
1.2.2 细胞增殖-毒性检测实验取对数生长期的细胞,胰酶消化,用培养基稀释至2×104个/毫升,96孔板每孔移入100 μl的细胞混悬。设置5组药物浓度梯度,每组5个复孔,12 h后待细胞贴壁,移去96孔板中培养基,根据分组的不同加入不同药物浓度的细胞培养液,分别于药物处理12、24、36和48 h后每孔加入10 μl CCK-8,37℃培养箱温育1 h,酶标仪以450 nm波长分析各组吸光度数据。
1.2.3 细胞侵袭实验在待测细胞培养至对数生长期,消化细胞,用无血清培养基悬浮细胞,计数,调整浓度为2×105个/毫升; 在下室加入600~800 μl含10%FBS的RPMI 1640培养基,已经铺好Matrigel胶的上室中加入100~150 μl细胞悬液,在培养箱中培养24 h; 小心取出Transwell小室,吸干上室液体,移到甲醇配置的0.2%结晶紫染液中,室温染色15~30 min; 轻轻用清水冲洗浸泡数次,吸去上室液体,用湿棉棒轻轻擦去上室膜表面上的细胞; 显微镜下每组标本随机选取9个视野计数,统计结果,进行分析。
1.2.4 流式细胞仪检测细胞周期取处于对数生长期的细胞,胰酶消化,1 500 r/min离心5 min。弃培养基。PBS重悬细胞,1 500 r/min离心5 min,弃PBS,75%酒精固定并重悬细胞,-20℃冰箱过夜。10×染色缓冲液用双蒸水稀释成1×缓冲液,PBS洗涤细胞两次,1×缓冲液重悬细胞,每组细胞悬液中加入5 μl PI染色液至95 μl细胞悬液,混匀,室温避光孵育10~30 min,流式细胞仪检测。
1.2.5 Hoechst染色法检测凋亡细胞细胞铺于六孔板上,不同浓度CX-5461处理24 h,吸去培养基,PBS清洗,弃去PBS,每孔加入适量Hoechst染色液,避光染色5 min,其后弃去Hoechst染色液,加入培养基,于倒置显微镜下观察,每组细胞随机选取20个视野,统计视野下含有凋亡小体的细胞数目并进行统计分析。
1.2.6 Western blot检测目标蛋白的变化CX-5461处理细胞后,收集各组细胞,提取细胞总蛋白,每孔蛋白上样量为40~80 μg,电泳电压75 V,电流30 mA,以10%SDS-PAGE胶进行Western blot电泳。以电流200 mA,电压100 V进行电转。以GAPDH为内参,以羊抗鼠、羊抗兔荧光二抗显影,在Odessy荧光扫膜系统上进行半定量分析。
1.3 统计学方法应用SPSS20.0软件进行统计学处理。计量数据以均数±标准差表示,多组比较采用单因素方差分析。以P < 0.05为差异有统计学意义。
2 结果 2.1 NF-κb在鼻咽癌组织中表达明显升高免疫组织化学染色发现,NF-κb在鼻咽癌组织中较癌旁组织表达明显升高,十三点评分发现两者比较,差异具有统计学意义(P=0.000003),见图 1。
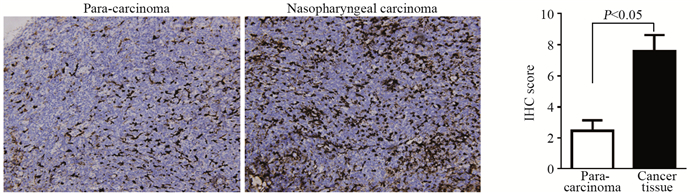
|
| 图 1 鼻咽癌与癌旁组织中NF-κb的表达 Figure 1 NF-κb expression in nasopharyngeal carcinoma and adjacent tissues |
将CX-5461以1.25 μmol/L处理CNE-1细胞系。发现从给药第2天起药物处理组增殖速率明显降低,与对照组相比,差异有统计学意义(P=0.0032); 在给药的同时加入NF-κb激活蛋白NKAP,发现CX-5461+NKAP组增殖能力较CX-5461组明显上调,增殖能力在给予NKAP后有所恢复,且具有统计学意义(P=0.0002)。而在单独给予NF-κb激活蛋白NKAP后对于细胞生长状态并无明显影响,见图 2。因此,CX-5461可能通过NF-κb调控细胞的增殖。
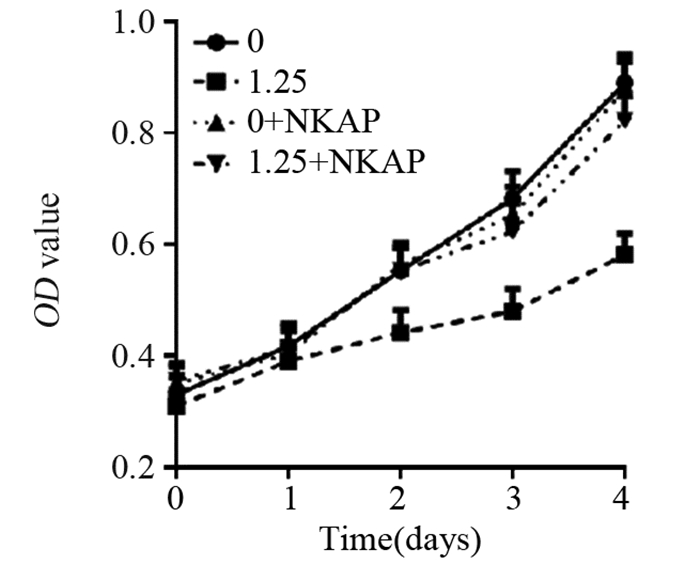
|
| 图 2 CCK-8检测CX-5461处理后鼻咽癌细胞CNE-1的增殖 Figure 2 Proliferation of nasopharyngeal carcinoma cells CNE-1 after CX-5461 treatment detected by CCK-8 |
在本实验中,CNE-1细胞系只加入CX-5461溶剂Na2HPO4作为对照组。发现CNE-1细胞系在1.25 μmol/L CX-5461单独处理后细胞透膜数量明显降低,细胞密度显著降低,细胞侵袭能力显著减弱,且差异有统计学意义(P=0.00011)。以上结果表明CX-5461对于CNE-1细胞系的侵袭、迁移能力具有明显的抑制作用。其后,在给予同浓度CX-5461的同时加入NF-κb激活蛋白NKAP,发现CX-5461+NKAP组较CX-5461给药组细胞透膜数目明显增多,细胞密度较CX-5461组显著增多,且差异有统计学意义(P=0.00007),见图 3。以上研究结果表明,在给予CX-5461的情况下,激活NF-κb对于CNE-1细胞系的侵袭、迁移能力的维持具有重要作用; 同时,CX-5461对鼻咽癌细胞系CNE-1的增殖、侵袭、转移具有极强的抑制作用,且其有可能是通过影响NF-κb的功能进而发挥影响。
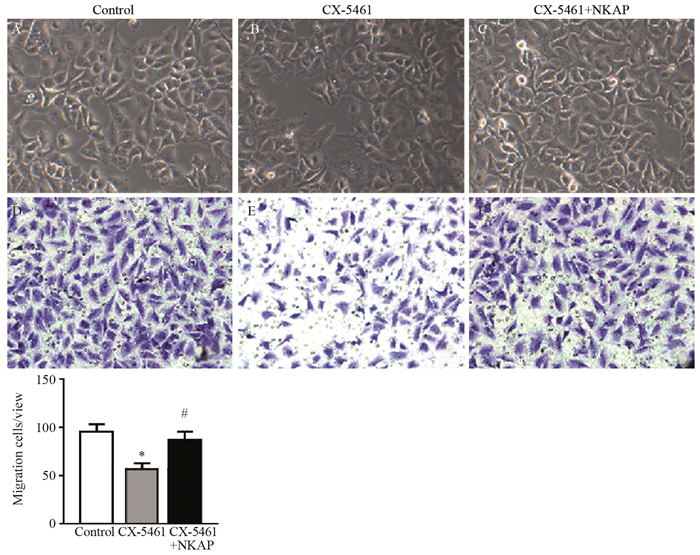
|
| *: P < 0.05, compared with control group; #: P < 0.05, compared with CX-5461 group 图 3 CX-5461处理后CNE-1细胞密度(A~C ×200)和侵袭能力(D~F ×200)的变化 Figure 3 Cell density(A-C ×200) and invasive ability(D-F ×200) of CNE-1 cell line after CX-5461 treatment |
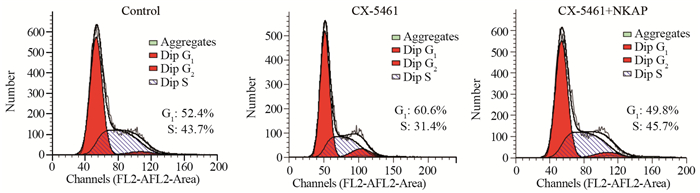
CNE-1鼻咽癌细胞系在1.25 μmol/L的CX-5461处理后24 h,CX-5461组与对照组相比,阻滞在G2期的细胞明显增多,且差异具有统计学意义(P=0.0008)。CNE-1鼻咽癌细胞系在CX-5461+NKAP重组蛋白联合处理24 h后,较对照组无明显周期阻滞(P=0.791),见图 4。表明CX-5461极可能通过抑制NF-κb活性进而引起CNE-1鼻咽癌细胞系周期阻滞。
|
| 图 4 CX-5461处理后CNE-1细胞系细胞周期的变化 Figure 4 Cell cycle of CNE-1 cell line after CX-5461 treatment |
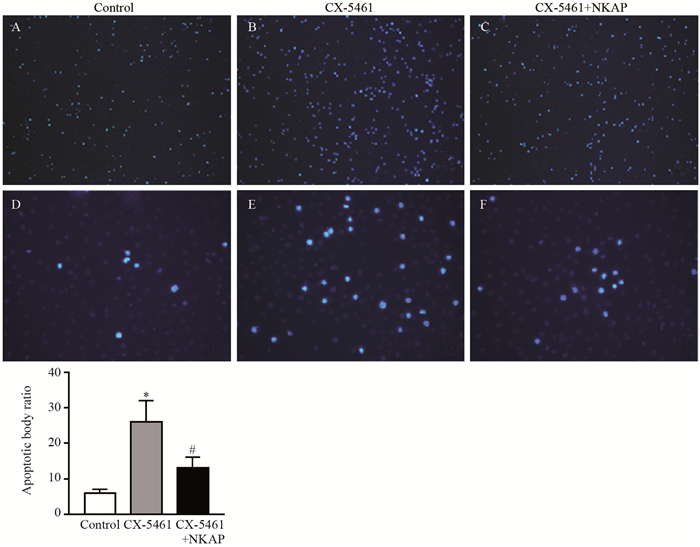
Hoechst 33342凋亡小体染色实验发现,CNE-1鼻咽癌细胞在1.25 μmol/L的CX-5461处理后,CX-5461组较对照组凋亡小体形成明显增多,差异具有统计学意义(P=0.00013)。在CX-5461处理的同时给予NF-κb激活蛋白NKAP,发现CX-5461+NKAP组较CX-5461组凋亡小体形成的细胞明显减少,且差异具有统计学意义(P=0.00024),见图 5。以上研究结果表明,适当浓度的CX-5461可以在一定程度上促进CNE-1的凋亡。
|
| *: P < 0.05, compared with Control group; #: P < 0.05, compared with CX-5461 group 图 5 Hoechst 33342凋亡小体染色实验检测鼻咽癌细胞系CNE-1的凋亡(A~C ×40; D~F ×200) Figure 5 Apoptosis of CNE-1 cell line detected by Hoechest apoptotic body fluorescence staining (A-C ×40; D-F ×200) |
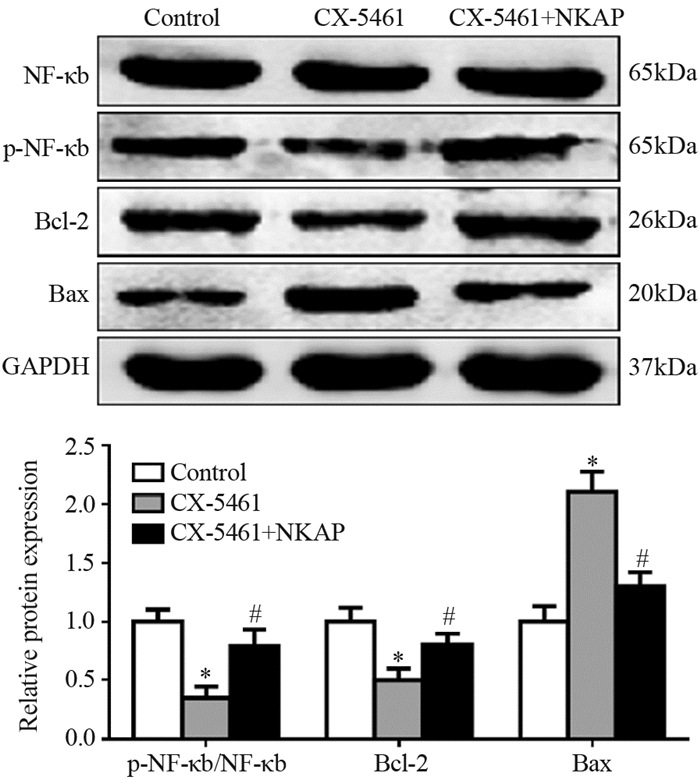
为了进一步确定CX-5461是通过何种途径、何种方式促进细胞凋亡,后期通过Western blot检测发现,CX-5461处理CNE-1细胞后NF-κb蛋白总体水平无明显变化(P=0.487),见图 6。进一步验证NF-κb在磷酸化水平的变化情况,发现CX-5461组NF-κb磷酸化水平较对照组明显降低(P=0.00003),CX-5461+NKAP组较CX-5461组蛋白磷酸化水平增高(P=0.00028)。与此同时,CX-5461组较CX-5461+NKAP组促凋亡蛋白Bax蛋白水平明显升高(P=0.000011); 抑凋亡蛋白Bcl-2明显降低,差异均具有统计学意义(P=0.0006),见图 6。因此,CX-5461可能通过抑制NF-κb磷酸化进而导致鼻咽癌细胞系CNE-1的凋亡。
|
| *: P < 0.05, compared with the Control group; #: P < 0.05, compared with the CX-5461 group 图 6 CX-5461处理后NF-κb磷酸化,Bax、Bcl-2变化情况 Figure 6 NF-κb phosphorylation, Bax and Bcl-2 expression after CX-5461 treatment |
鼻咽癌发病与EB病毒明显相关,且具有一定的遗传易感性。研究证实,核糖体除了参与蛋白质合成外,还对细胞周期的正常推进、细胞凋亡的发生以及肿瘤细胞的侵袭、迁移具有极大的影响[2]。因此,核糖体功能对于肿瘤细胞的增殖、迁移、侵袭等生理活动有着极其重要的意义。在真核生物细胞中,RNA聚合酶Ⅰ主要负责催化5.8s、18s和28s的rRNA合成,对于保证核糖体形成、维持核糖体功能稳定性具有极其重要的作用[3]。核糖体主要由rRNA及核糖体蛋白构成。rRNA约占机体RNA的82%,主要包括5srRNA、5.8srRNA、18srRNA和28srRNA。其单独存在时不存在功能,在核糖体蛋白装配后起到mRNA支架的作用,促进mRNA与核糖体的结合,保持翻译过程的稳定性。Zhou等早期研究证实,核糖体蛋白在游离状态下能够与MDM2结合,抑制MDM2功能,阻碍MDM2对p53的降解,进而调控细胞周期进展,促进细胞凋亡[4]。Yang等发现RPL22通过抑制CK2α底物磷酸化进而诱导肿瘤细胞增殖与凋亡[5]。因此,破坏核糖体稳定性,抑制rRNA合成,阻断肿瘤细胞内核糖体的合成,对于控制肿瘤的发生发展具有极其重要的作用[6]。
NKAP(NF-κb activator protein),于2003年生物化学及生物物理研究通讯(biochemical and biophysical research communications, BBRC)上首次报道,RIP(receptor -interacting protein)在TNF-α激活的NF-κb途径中具有重要的作用。后期以RIP为诱饵蛋白,研究者通过酵母双杂交手段,在人的cDNA文库中发现一种新蛋白,其能激活NF-κb途径,促进NF-κb的入核及磷酸化,因此根据其功能命名为NKAP[7]。
CX-5461作为一种新近研究出来的以RNA poly Ⅰ为靶点的抑制剂,对于核糖体的正常组装及rRNA的转录均具有极其重要的作用。其作为一种rRNA合成抑制剂,选择性抑制RNA PolⅠ驱动的rRNA转录,对RNA PolⅡ没有作用,对rRNA转录的抑制比对DNA复制和蛋白翻译的抑制选择性高出250到300倍。Li等[8]研究证实,CX-5461能够使骨肉瘤细胞的周期明显阻滞于G2期,使得细胞内p53及p21在mRNA水平及蛋白质水平显著升高,进而启动细胞凋亡进程,延缓肿瘤组织体积的增大与肿瘤的外部器官转移。且其与多柔比星联合用药时能够在一定程度上增强多柔比星对于肿瘤细胞的杀伤力[8]。Duo等发现以合适状态的药物载体装载CX-5461,给药后对于宫颈癌具有极明显的治疗作用及较小的药物毒副作用[9]。因此,CX-5461对于肿瘤疾病的控制具有明显的效果。但是关于其控制肿瘤发生发展的具体机制尚有待进一步研究。
早期关于CX-5461的研究发现,其通过调控p53的变化进而促进肿瘤细胞的凋亡。大量研究表明,p53与NF-κb在肿瘤细胞功能调节的作用上存在一定的上下游关系或者共调控作用[10-11]。因此,我们猜想CX-5461也极有可能通过抑制NF-κb的功能进而影响肿瘤细胞的发生发展。
NF-κb广泛存在于各种细胞中,并参与细胞内多种信号传递,调控多种基因的表达。异常激活磷酸化的NF-κb可促进肿瘤细胞增殖、抑制凋亡。因此,NF-κb也成为相关癌症药物作用的靶点。NF-κb是一种早期由Sen等[12]在成熟B淋巴细胞核中发现的一种细胞核转录因子,能与免疫球蛋白k链基因的增强子κb序列特异性结合。在正常情况下,NF-κb通常与其抑制蛋白Iκb相结合,以非活性状态贮存于细胞质中。其主要包括五位家族成员,c-Rel、NF-κb2(p52)、RelB、RelA(p65)和NF-κbI(p50)[12]。NF-κb在大部分癌组织中表达量明显高于对照组织,这也与其促进增殖,抑制凋亡的功能相符合。大量研究表明,当NF-κb被激活后,其发生磷酸化,并大量入核,通过RelA结合到相关癌基因的启动子或增强子,进而调控肿瘤的细胞周期进程、侵袭、凋亡及血管生成[13]。除此之外,Hinz等[14]发现,cyclinD1的启动子序列上存在NF-κb的结合位点。cyclinD1作为细胞G1期向G2期和S期转化的重要限速因子,其被抑制常导致细胞周期阻滞于G1期。而NF-κb激活后发生磷酸化,NF-κb大量入核,其结合到cyclinD1的启动序列上,调控cyclingD1的功能进而引起细胞周期阻滞于G1期,这也与本实验结果相吻合[14]。且相关研究发现核糖体蛋白RPL22功能的缺失对于激活NF-κb的功能具有极其重要的作用[15]。本研究观察在NKAP处理后肿瘤细胞相关功能是否得到恢复,结果也确实与我们预期较为一致。因此,我们认为,在CX-5461抑制核糖体的装配后,核糖体相关蛋白胞外功能激活,抑制NF-κb功能的活化进而促进细胞凋亡及迁移。
本研究证实,CX-5461可以通过影响NF-κb的磷酸化调控鼻咽癌细胞系CNE-1的周期进程、增殖、侵袭、凋亡,进而可能影响鼻咽癌的发生发展。但是NF-κb的活化调控细胞周期、细胞凋亡的具体机制尚需要进一步探索。
作者贡献
桂超:细胞实验的具体实施,文献的检索与查阅,论文撰写
邓万凯:课题构思与实验进展的整体审核及指导
刘细国:人体标本的收集与整理,论文后期修改
| [1] | Srivanitchapoom C, Sittitrai P. Nasopharyngeal Tuberculosis: Epidemiology, Mechanism of Infection, Clinical Manifestations, and Management[J]. Int J Otolaryngol, 2016, 2016: 4817429. |
| [2] | Wei F, Ding L, Wei Z, et al. Ribosomal protein L34 promotes the proliferation, invasion and metastasis of pancreatic cancer cells[J]. Oncotarget, 2016, 7(51): 85259–72. |
| [3] | 李敏, 周兴涛. 真核生物核糖体RNA基因的转录调控[J]. 江西农业学报, 2008, 20(11): 14–6. [ Li M, Zhou XT. Transcriptional regulation of ribosomal RNA genes in eukaryotes[J]. Jiangsu Nong Ye Xue Bao, 2008, 20(11): 14–6. DOI:10.3969/j.issn.1001-8581.2008.11.005 ] |
| [4] | Zhou X, Hao Q, Liao J, et al. Ribosomal protein S14 unties the MDM2-p53 loop upon ribosomal stress[J]. Oncogene, 2013, 32(3): 388–96. DOI:10.1038/onc.2012.63 |
| [5] | Yang M, Sun H, He J, et al. Interaction of ribosomal protein L22 with casein kinase 2α: a novel mechanism for understanding the biology of non-small cell lung cancer[J]. Oncol Rep, 2014, 32(1): 139–44. |
| [6] | Scala F, Brighenti E, Govoni M, et al. Direct relationship between the level of p53 stabilization induced by rRNA synthesis-inhibiting drugs and the cell ribosome biogenesis rate[J]. Oncogene, 2016, 35(8): 977–89. DOI:10.1038/onc.2015.147 |
| [7] | 何薇.鳜NKAP和VIP的初步功能研究[D].中山大学, 2009. [ He W. Preliminary functional study of Squid NKAP and VIP[D]. Sun Yat-Sen University, 2009. ] http://d.wanfangdata.com.cn/Thesis/Y1478064 |
| [8] | Li L, Li Y, Zhao J, et al. CX-5461 induces autophagy and inhibits tumor growth via mammalian target of rapamycin-related signaling pathways in osteosarcoma[J]. Onco Targets Ther, 2016, 9: 5985–97. DOI:10.2147/OTT |
| [9] | Duo Y, Yang M, Du Z, et al. CX-5461-loaded nucleolus-targeting nanoplatform for cancer therapy through induction of pro-death autophagy[J]. Acta Biomater, 2018, 79: 317–30. DOI:10.1016/j.actbio.2018.08.035 |
| [10] | Khan M, Shah SA, Kim MO. 17β-Estradiol via SIRT1/Acetyl-p53/NF-κb Signaling Pathway Rescued Postnatal Rat Brain Against Acute Ethanol Intoxication[J]. Mol Neurobiol, 2018, 55(4): 3067–78. DOI:10.1007/s12035-017-0520-8 |
| [11] | Zhang DX, Ma DY, Yao ZQ, et al. ERK1/2/p53 and NF-κB dependent-PUMA activation involves in doxorubicin-induced cardiomyocyte apoptosis[J]. Eur Rev Med Pharmacol Sci, 2016, 20(11): 2435–42. |
| [12] | Sen R, Baltimore D. Multiple nuclear factors interact with the immunoglobulin enhancer sequences[J]. Cell, 1986, 46(5): 705–16. DOI:10.1016/0092-8674(86)90346-6 |
| [13] | Helbig G, Christopherson KW, Bhat-Nakshatri P, et al. NF-kappaB promotes breastcancer cell migration andmetastasis by inducing the expression of thechemokine receptor CXCR4[J]. J Biol Chem, 2003, 278(24): 21631–8. DOI:10.1074/jbc.M300609200 |
| [14] | Hinz M, Krappmann D, Eichten A, et al. NF-κB Function in Growth Control: Regulation of Cyclin D1 Expression and G0/G1-to-S-Phase Transition[J]. Mol Cell Biol, 1999, 19(4): 2690–8. DOI:10.1128/MCB.19.4.2690 |
| [15] | Rao S, Lee SY, Gutierrez A, et al. Inactivation of ribosomal protein L22 promotes transformation by induction of the stemness factor, Lin28B[J]. Blood, 2012, 120(18): 3764–73. DOI:10.1182/blood-2012-03-415349 |
 2019, Vol. 46
2019, Vol. 46


