文章信息
- STAT1基因对胶质瘤细胞系U251细胞周期的影响及其机制
- Effect of STAT1 on Cell Cycle of Human Glioma U251 Cells and Related Mechanism
- 肿瘤防治研究, 2019, 46(3): 205-211
- Cancer Research on Prevention and Treatment, 2019, 46(3): 205-211
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.18.1201
- 收稿日期: 2018-08-21
- 修回日期: 2018-12-18
2. 010050 呼和浩特,内蒙古医科大学分子病理学实验室
2. Laboratory of Molecular Pathology, Inner Mongolia Medical University, Hohhot 010050, China
脑胶质瘤是中枢神经系统中最常见的恶性肿瘤,原发于神经上皮细胞,约占颅内肿瘤的40%~50%[1],脑胶质瘤具有广泛的侵袭性,其恶性程度高,发病机制尚不清楚,手术难以彻底切除,且生长速度快,术后易复发,预后差。
信号转导与转录激活因子(signal transducers and activators of transcription, STAT)是一种信号转导和转录活化因子蛋白,激活后可以转入细胞核内与特异性DNA结合[2],从多个方面调节细胞的生长、存活、分化和凋亡。STAT1是该家族的重要成员之一,在肿瘤形成过程中包括细胞周期进展、细胞凋亡、肿瘤血管生成以及肿瘤免疫监视中发挥重要的作用,但该基因与胶质瘤发生、发展的关系,以及如何调控并作用于神经上皮组织,目前国内外尚无系统的报道。本研究探讨STAT1与相关蛋白P53、P21、bcl-2、Caspase-8的相关性和变化趋势,进一步探讨STAT1对胶质瘤细胞系U251细胞周期的影响及可能的机制,为胶质瘤治疗的新策略提供理论基础。
1 材料与方法 1.1 细胞株人脑胶质瘤U251细胞由内蒙古医科大学分子病理学实验室提供,在含10%胎牛血清的DMEM/F-12培养基中培养,培养条件为5%CO2、37℃,实验时取对数生长期细胞。
1.2 主要试剂与仪器pcDNA3.1-STAT1质粒(内蒙古医科大学附属医院神经外科鞠海涛博士惠赠),DMEM/F-12(1:1)细胞培养液、胎牛血清、0.25%胰酶(美国Gibco公司),LipofectamineTM2000(美国Invitrogen公司),SDS-PAGE凝胶配制试剂盒(上海碧云天生物技术有限公司),STAT1 p84/p91多克隆抗体(美国Santa Cruz公司),P53、P21抗体(美国Santa Cruz公司),bcl-2、Caspase-8抗体(Abcam公司),人抗鼠IgG(H+L)(美国LI-COR公司); 荧光显微镜(中国Nikon公司),Western blot红外荧光扫描系统(奥德赛CLX),Thermo酶标仪(美国Thermo公司)。
1.3 细胞转染按LipofectamineTM2000脂质体转染试剂盒说明,制备LipofectamineTM2000复合物:每孔240 μl无血清无双抗培养基+10 μl LipofectamineTM2000(总体积250 μl),室温孵育5 min; DNA复合物:每孔246 μl无血清无双抗培养基+4 μg质粒(质粒浓度为1.0 μg/μl),总体积250 μl; 将两个复合物混合制成DNA-LipofectamineTM2000复合物,室温静置20 min; 将6孔板中的细胞用无血清无双抗的培养基清洗细胞2次,加入2 ml无血清培养基; 将复合物逐滴加入孔中,轻轻摇动6孔板,使其混匀,37℃、5%CO2的培养箱中保温6 h后,更换含血清无双抗的培养基,37℃、5%CO2的培养箱培养48 h后进行下一步检测。将细胞分为Mock组(无转染)、空载组(转染pcDNA3.1)和STAT1组(转染pcDNA3.1-STAT1)。
1.4 MTT法检测细胞增殖活性转染前一天,细胞换液,胰酶消化,计数,以1×105个/孔接种于96孔板中,每孔加入含血清无双抗的DMEM 200 μl,设置调零组和对照组,每组10个复孔,37℃、5%CO2的培养箱中培养24 h; 每孔加入1 μg/μl质粒0.2 μl,LipofectamineTM2000转染试剂0.5 μl; 分别在转染24、48 h后向每孔加入5 mg/ml MTT 20 μl,继续培养; 4 h后终止培养,去除培养液,每孔加入DMSO 150 μl,低速振荡10 min,充分溶解MTT试剂; 酶联免疫仪上选择490 nm波长测定吸光度值,并计算10个复孔的平均值。
1.5 流式细胞仪检测细胞周期取对数期细胞,倒去培养液,0.25%胰酶消化细胞,用完全培养液轻轻吹打,1 000 r/min,离心5 min去上清液; 加入4 ml PBS重悬细胞,吹打均匀后,再次1 000 r/min,离心5 min去上清液; 加入1.2 ml PBS重悬细胞后,再加入2.8 ml 70%(预冷)乙醇中,轻轻吹打均匀,封口膜封口。4℃固定过夜(可长至2周)。1 000 r/min,5 min收集固定细胞,加入4 ml PBS重悬细胞,轻轻吹打均匀后,再次1 000 r/min,离心5 min去上清液; 用0.4 ml PBS重悬细胞,轻轻吹打(防止细胞破碎); 加RNase-A约3 μl至终浓度约为50 μg/ml,37℃水浴消化30 min; 加PI约50 μl(此时终浓度为65 μg/ml),避光染色30 min。尼龙网过滤,上机检测。
1.6 划痕实验检测细胞迁移在6孔板背后划横线做标记,线与线间隔约1 cm,在每孔中加入约5×105个细胞; 细胞贴壁后,枪头划痕,PBS清洗细胞3次,加入无血清无双抗培养基; 然后进行质粒转染4~6 h后更换无血清无双抗培养基,并放入细胞培养箱培养,分别在0和24 h后取出拍照。
1.7 Western blot法检测转染后各组U251细胞中细胞周期相关蛋白P53、P21的表达情况按照蛋白提取试剂盒说明,提取转染48 h后细胞的总蛋白,利用BCA法测定蛋白浓度,加入蛋白上样缓冲液后,100℃煮沸制备蛋白样品。配置10%的分离胶,5%浓缩胶,胶凝固后进行上样,上样时应保证每孔蛋白量一致,浓缩胶电泳时间30~40 min,电压为90 V,分离胶电泳时间为60~90 min,电压为160 V,电泳至溴酚蓝到达玻璃板下缘时终止电泳,进行转膜,将膜放入平皿中(蛋白面朝上),倒入之前配好的封闭液,室温下脱色,摇床上摇动封闭1 h,加入一抗,4℃孵育过夜,TBST洗膜2次,10分钟/次,加入荧光二抗常温孵育1 h,TBST清洗PVDF膜3次,每次5 min。将PVDF膜进行扫描,拍照并记录。
1.8 统计学方法应用SPSS17.0软件对数据进行分析。计量资料以(x±s)表示,对数据采用单因素方差分析进行统计,P < 0.05为差异有统计学意义。
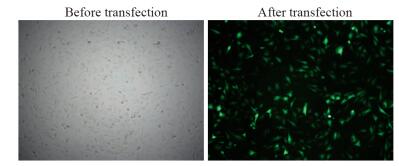
2 结果 2.1 pcDNA3.1-STAT1质粒转染U251细胞倒置相差显微镜下可见,Mock组转染48 h后细胞生长状态良好、形态均匀、细胞增殖旺盛且折光性好; 与Mock组相比,空载组有少量细胞碎片及死细胞漂浮,但细胞生长状态无明显差异; 与Mock及空载组相比,STAT1组培养液中可见较多死细胞漂浮及细胞碎片,贴壁细胞数量明显减少,且生长缓慢,形态不规则,伸长或皱缩,折光性较差,见图 1。荧光显微镜下观察转染效率,STAT1组可见较多绿色荧光蛋白表达,见图 2。

|
| 图 1 转染48 h后倒置相差显微镜下观察各组细胞的生长情况(×200) Figure 1 Growth of glioma U251 cells observed under inverted phase contrast microscope 48 h after transfection (×200) |
|
| 图 2 转染48 h后荧光显微镜观察pcDNA3.1-STAT1转染情况(×200) Figure 2 Glioma U251 cells observed under fluorescence microscopy 48h after transfection with pcDNA3.1-STAT1 (×200) |
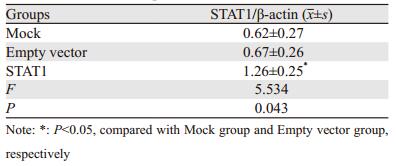
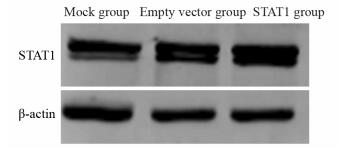
空载和pcDNA3.1-STAT1分别转染脑胶质瘤U251细胞48 h后,Western blot法检测各组STAT1蛋白表达,结果显示,与Mock组、空载组相比较,STAT1组的STAT1蛋白表达量明显增高(1.26±0.25),差异有统计学意义(P=0.043),而Mock组和空载组间差异无统计学意义,见表 1、图 3。
|
|
| 图 3 转染pcDNA3.1-STAT1 48h后STAT1在U251细胞中的表达 Figure 3 Expression of STAT1 in U251 cells 48h after transfection with pcDNA3.1-STAT1 |
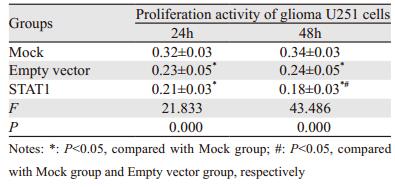
将转染的脑胶质瘤U251细胞培养48 h后,用MTT法检测各组的细胞增殖活性,以检测高表达的STAT1对U251细胞增殖活性的影响。结果显示,三组差别有统计学意义(P=0.000),见表 2。说明转染STAT1后明显的抑制脑胶质瘤U251细胞的增殖。
|
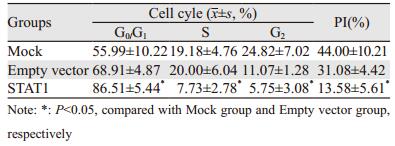
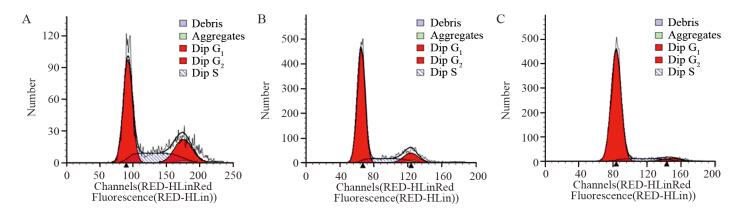
PI染色检测STAT1转染U251细胞48 h后时的细胞周期情况,结果显示:与Mock及空载组相比,STAT1组G0/G1期细胞比例明显升高,S期比例明显下降,差异均具有统计学意义(P=0.006; P=0.033)。结果显示,STAT1可抑制脑胶质瘤U251细胞的DNA合成及有丝分裂,导致细胞阻滞在G0/G1期,见表 3、图 4。
|
|
| A: Mock group; B: Empty vector group; C: STAT1 group 图 4 转染48h后STAT1对脑胶质瘤U251细胞周期的影响 Figure 4 Effect of STAT1 on cell cycle of glioma U251 cells 48h after transfection |
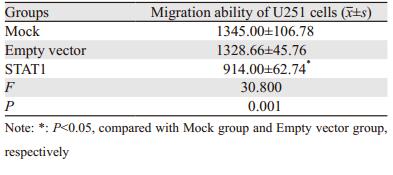
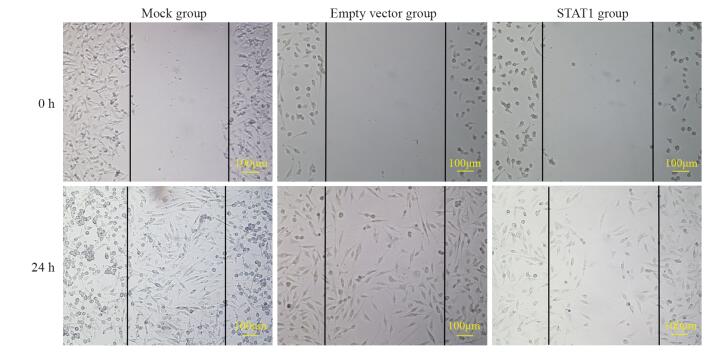
结果显示,24 h后Mock组细胞就已经迁移越过划痕范围,空载组迁移能力较Mock组细胞略差,而STAT1组进入空白处的细胞明显减少,细胞迁移能力受到抑制,见表 4、图 5。结果表明STAT1的高表达抑制了脑胶质瘤细胞的迁移能力(P=0.001)。
|
|
| 图 5 细胞划痕实验检测转染pcDNA3.1-STAT1后对胶质瘤U251细胞迁移能力的影响 Figure 5 Migration ability of U251 cells after transfection with pcDNA3.1-STAT1 detected by wound healing assay |
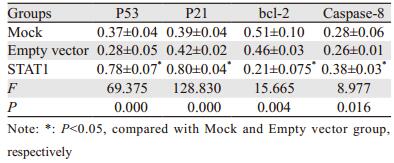
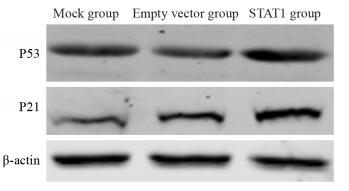
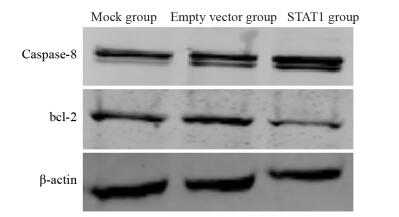
空载质粒和pcDNA3.1-STAT1分别转染脑胶质瘤U251细胞48 h后,Western blot检测各组蛋白表达。STAT1组与Mock和空载组相比,P53、P21、Caspase-8表达明显增强,bcl-2表达明显减弱,STAT1组与Mock组和空载组相比均有显著差异(均P < 0.05); 而上述蛋白表达在空载组和Mock组差异无统计学意义(P > 0.05),见表 5、图 6~7。
|
|
| 图 6 P53、P21在转染STAT1脑胶质瘤U251细胞中的表达 Figure 6 Expression of P53 and P21 in U251 cells after transfection with STAT1 |
|
| 图 7 bcl-2、Caspase-8在转染STAT1脑胶质瘤U251细胞中的表达 Figure 7 Expression of bcl-2 and caspase-8 in U251 cells after transfection with STAT1 |
胶质母细胞瘤是中枢神经系统中最具有破坏性与侵略性的肿瘤[3],约占胶质瘤的50%左右[4]。近年来脑胶质瘤的发病率呈年轻化趋势,以青壮年为主要发病人群[5]。据统计,脑胶质瘤患者手术后中位生存时间平均约12~18月,5年生存率 < 10%[6]。近年来,随着分子诊断概念的引入和精准医学的推广[7],胶质瘤患者术后的生存率较前有所提高,但平均生存期仍然低于15月。随着相关调控基因的发现与认识,基因治疗开始进入包括胶质瘤在内的各种恶性肿瘤的研究领域,并且被认为是目前除手术、放疗和化疗以外的“第四模式”。
STAT是一种信号转导和转录活化因子蛋白,是细胞因子/生长因子信号转导中重要的胞质转录因子,激活后可以转入细胞核内与特异性的DNA结合,从多个方面调节细胞的生长、存活、分化和凋亡。STAT1是该家族的重要成员之一,它不仅可被细胞因子激活,也可被生长因子激活,比如表皮生长因子、血小板衍生生长因子、胰岛素和胰岛素样生长因子1(IGF-1)[8]。目前已知STAT1在多种肿瘤细胞中表达,如白血病[9]、乳腺癌[10]、肝癌[11]等。STAT1在肿瘤形成过程中包括细胞周期进展、细胞凋亡、肿瘤血管生成以及肿瘤免疫监视中发挥重要的作用,并且已有相关研究证实STAT1基因在肿瘤细胞的生长、分化、转移、侵袭等方面发挥了关键的调节作用[12],同时国内学者已证实STAT1在脑胶质瘤缺氧时起肿瘤抑制作用[13]。但该基因与胶质瘤发生、发展的关系,以及如何调控并作用于神经上皮组织,目前国内外尚无系统的报道。
在前期实验中已证实,STAT1在胶质瘤组织中低表达,而在正常脑组织中高表达[14-15]。本研究中,Western blot结果显示在胶质瘤U251细胞系中STAT1蛋白为高表达; MTT结果显示,瞬时转染pcDNA3.1-STAT1质粒后,STAT1组U251细胞增殖明显受到抑制。由此可知,LipofectamineTM2000成功将pcDNA3.1-STAT1导入U251细胞中,并且转染后高表达的STAT1可抑制胶质瘤U251细胞的生长。此外,细胞周期阻滞是导致细胞凋亡重要的原因。本研究流式细胞技术结果显示,与Mock组和空载组相比,脑胶质瘤U251细胞系中高表达的STAT1可显著抑制细胞周期进程,使细胞周期停滞在G0/G1期,从而促进细胞凋亡发生; 因此,高表达的STAT1能够诱导胶质瘤细胞产生G0/G1期阻滞,从而减弱胶质瘤细胞体外的增殖能力; 划痕实验发现在STAT1转染24 h后,STAT1组迁移能力急剧下降。这一结果提示STAT1的高表达可直接抑制脑胶质瘤细胞的迁移能力。
P53是一种抑癌基因,在恶性肿瘤中,有超过50%的该基因发生突变。由这种基因编码的蛋白质是一种转录因子,它控制着细胞周期的启动,当细胞缺乏P53基因时,即使在不利条件下,细胞仍可以继续进行分裂。与所有其他的肿瘤抑制基因相同,P53基因可减慢正常细胞的分裂[16]。P21是CIP家族的成员,是位于P53基因下游的细胞周期素依赖性激酶抑制因子,它可以通过对细胞周期的作用,抑制某些细胞的有丝分裂活动,从而抑制细胞生长。P21可以和P53共同构成细胞周期G1/S检查站,参与细胞周期的调节[17]。有学者以siRNA-STAT1和pcDNA3.1-STAT1转染肝癌HepG2细胞,通过Western blot法检测转染细胞中P53、Cyclin E的表达水平,发现STAT1可以上调P53的表达,抑制Cyclin E的表达,从而导致了细胞周期阻滞、生长抑制和细胞凋亡[18]。
细胞周期阻滞涉及复杂的分子级联反应,各种基因的功能障碍可能导致细胞周期阻滞的发生和发展。研究表明,STAT1抗肿瘤效应是通过上调P53实现的[19],而P53的上调又可以促进P21的表达[20],使细胞周期阻滞于G1/S期,而细胞凋亡常发生于细胞周期的G1期,从而导致细胞发生凋亡[21]。正常情况下细胞分裂周期进程的转化由Cyclin-CDK(Cyclin-dependent kinase)复合物对细胞精确而严密的调控,例如CyclinE-CDK2、CyclinA-CDK2及其抑制剂(CKI)P21Cip1、P27Kip1的活性来动态调节细胞进程。研究表明,P53可诱导P21Waf1调控Cyclin E/CDK2和Cyclin A/CDK2复合物使RB磷酸化,P53和RB通路共同调控细胞周期G1/S转换,而肿瘤细胞中这两条通路往往同时失调[22]。
B细胞淋巴瘤-2(bcl-2)家族蛋白被认为是程序性细胞死亡和凋亡的关键调节因子,在人类癌症中具有突出作用[23]。根据其功能可分为两类蛋白亚群[24]:一类为凋亡抑制蛋白(bcl-2、bcl-xL、bcl-xY等),是抗癌治疗的主要靶点; 另一类为凋亡促进蛋白(bax、bix、bad等)。所有bcl-2家族蛋白都具有共同的bcl-2同源(BH)结构域。bcl-2蛋白能调节内质网和线粒体中适宜的Ca2+浓度,使其保持动态平衡,避免线粒体中由于Ca2+浓度过高而引起细胞凋亡。此外,bcl-2还依靠抑制线粒体释放细胞色素C来抑制细胞的凋亡,同时还可以抑制Smac/DIABLO的释放[25]。Caspase-8是死亡受体介导的凋亡途径中关键的启动因子,细胞凋亡依赖一类对天冬氨酸特异的半胱氨酸蛋白酶(Caspase)产生的级联反应。Caspase-8能够通过寡聚而自身切割活化,并能激活下游半胱氨酸蛋白酶,产生凋亡效应[26]。
本实验中,我们通过Western blot检测了P53、P21、bcl-2、Caspase-8的表达情况,结果表明,STAT1组的P53、P21、Caspase-8表达明显增加,bcl-2表达明显降低,其机制可能为STAT1可上调P53、P21、Caspase-8,下调bcl-2,使细胞周期阻滞于G0/G1期,而细胞凋亡常发生于细胞周期的G1期,从而导致细胞发生凋亡。这说明STAT1调控细胞增殖、凋亡作用是经多分子信号途径来实现的,这可能是脑胶质瘤发生的机制之一,但此推测还需要大量的实验进一步验证和研究。
作者贡献
黄 平:实施研究,数据分析,文章撰写
窦长武:提出研究思路,设计研究方案
鞠海涛、王宏伟:指导实验,获取研究经费
肖 瑞:修改文章内容
牛丽丽:指导实验,采集数据
| [1] | Ostrom QT, Gittleman H, Truitt G, et al. CBTRUS statistical report: primary brain and other central nervous system tumors diagnosed in the united states in 2011-2015[J]. Neuro Oncol, 2018, 20(suppl_4): iv1–iv86. DOI:10.1093/neuonc/noy131 |
| [2] | Stark GR, Darnell JE Jr. The JAK-STAT pathway at twenty[J]. Immunity, 2012, 36(4): 503–14. DOI:10.1016/j.immuni.2012.03.013 |
| [3] | Monnier A, Boniface R, Bouvet R, et al. The expression of EMX2 lead to cell cycle arrest in glioblastoma cell line[J]. BMC Cancer, 2018, 18(1): 1213. DOI:10.1186/s12885-018-5094-y |
| [4] | Munoz JL, Rodriguez-Cruz V, Ramkissoon SH, et al. Temozolomide resistance in glioblastoma occurs by miRNA-9-targeted PTCH1, independent of sonic hedgehog level[J]. Oncotarget, 2015, 6(2): 1190–201. |
| [5] | Waghmare I, Roebke A, Minata M, et al. Intercellular cooperation and competition in brain cancers: lessons from Drosophila and human studies[J]. Stem Cells Transl Med, 2014, 3(11): 1262–8. DOI:10.5966/sctm.2014-0086 |
| [6] | Castro MG, Candolfi M, Kroeger K, et al. Gene therapy and targeted toxins for glioma[J]. Curr Gene Ther, 2011, 11(3): 155–80. DOI:10.2174/156652311795684722 |
| [7] | 毛颖, 花玮. 精准神经外科:从宏观到微观[J]. 中华医学杂志, 2015, 95(31): 2510–1. [ Mao Y, Hua W. Application of precision medicine for neurosurgery[J]. Zhonghua Yi Xue Za Zhi, 2015, 95(31): 2510–1. DOI:10.3760/cma.j.issn.0376-2491.2015.31.006 ] |
| [8] | Brivanlou AH, Darnell JE Jr. Signal transduction and the control of gene expression[J]. Science, 2002, 295(5556): 813–8. DOI:10.1126/science.1066355 |
| [9] | Noack K, Mahendrarajah N, Hennig D, et al. Analysis of the interplay between all-trans retinoic acid and histone deacetylase inhibitors in leukemic cells[J]. Arch Toxicol, 2017, 91(5): 2191–208. DOI:10.1007/s00204-016-1878-5 |
| [10] | Hou Y, Li X, Li Q, et al. STAT1 facilitates oestrogen receptor α transcription and stimulates breast cancer cell proliferation[J]. J Cell Mol Med, 2018, 22(12): 6077–86. DOI:10.1111/jcmm.2018.22.issue-12 |
| [11] | Narkwa PW, Blackbourn DJ, Mutocheluh M. Aflatoxin B1 inhibits the type 1 interferon response pathway via STAT1 suggesting another mechanism of hepatocellular carcinoma[J]. Infect Agent Cancer, 2017, 12: 17. DOI:10.1186/s13027-017-0127-8 |
| [12] | Meissl K, Macho-Maschler S, Müller M, et al. The good and the bad faces of STAT1 in solid tumours[J]. Cytokine, 2017, 89: 12–20. DOI:10.1016/j.cyto.2015.11.011 |
| [13] | Zhang Y, Jin G, Zhang J, et al. Overexpression of STAT1 suppresses angiogenesis under hypoxia by regulating VEGF-A in human glioma cells[J]. Biomed Pharmacother, 2018, 104: 566–75. DOI:10.1016/j.biopha.2018.05.079 |
| [14] | Ju H, Li X, Li H, et al. Mediation of multiple pathways regulating cell proliferation, migration, and apoptosis in the human malignant glioma cell line U87MG via unphosphorylated STAT1[J]. J Neurosurg, 2013, 118(6): 1239–47. DOI:10.3171/2013.3.JNS122051 |
| [15] | Yang W, Wang H, Dou C, et al. A study on the correlation between STAT-1 and mutant p53 expression in glioma[J]. Mol Med Rep, 2018, 17(6): 7807–12. |
| [16] | Hainaut P, Wiman KG. 30 years and a long way into p53 research[J]. Lancet Oncol, 2009, 10(9): 913–9. DOI:10.1016/S1470-2045(09)70198-6 |
| [17] | Karimian A, Ahmadi Y, Yousefi B. Multiple functions of p21 in cell cycle, apoptosis and transcriptional regulation after DNA damage[J]. DNA Repair (Amst), 2016, 42: 63–71. DOI:10.1016/j.dnarep.2016.04.008 |
| [18] | Chen G, Wang H, Xie S, et al. STAT1 negatively regulates hepatocellular carcinoma cell proliferation[J]. Oncol Rep, 2013, 29(6): 2303–10. DOI:10.3892/or.2013.2398 |
| [19] | Chen J, Wang H, Wang J, et al. STAT1 inhibits human hepatocellular carcinoma cell growth through induction of p53 and Fbxw7[J]. Cancer Cell Int, 2015, 15: 111. DOI:10.1186/s12935-015-0253-6 |
| [20] | Atkins KM, Thomas LL, Barroso-González J, et al. The multifunctional sorting protein PACS-2 regulates SIRT1-mediated deacetylation of p53 to modulate p21-dependent cell- cycle arrest[J]. Cell Rep, 2014, 8(5): 1545–57. DOI:10.1016/j.celrep.2014.07.049 |
| [21] | Dimco G, Knight RA, Latchman DS, et al. STAT1 interacts directly with cyclin D1/Cdk4 and mediates cell cycle arrest[J]. Cell Cycle, 2010, 9(23): 4638–49. DOI:10.4161/cc.9.23.13955 |
| [22] | Yamasaki L. Role of the RB tumor suppressor in cancer[J]. Cancer Treat Res, 2003, 115: 209–39. |
| [23] | Shakeel E, Sharma N, Akhtar S, et al. Decoding the antineoplastic efficacy of Aplysin targeting Bcl-2: A de novo perspective[J]. Comput Biol Chem, 2018, 77: 390–401. DOI:10.1016/j.compbiolchem.2018.09.003 |
| [24] | Valentin R, Grabow S, Davids MS, et al. The rise of apoptosis: targeting apoptosis in hematologic malignancies[J]. Blood, 2018, 132(12): 1248–64. DOI:10.1182/blood-2018-02-791350 |
| [25] | Xue M, Ge Y, Yu C, et al. Apoptosis is induced by docosahexaenoic acid in breast cancer cells via death receptor and mitochondria-mediated pathways[J]. Mol Med Rep, 2017, 16(1): 978–82. |
| [26] | Werner AB, de Vries E, Borst J, et al. Bcl-2 family member Bfl-1/A1 sequesters truncated bid to inhibit is collaboration with pro-apoptotic Bak or Bax[J]. J Biol Chem, 2002, 277(25): 22781–8. DOI:10.1074/jbc.M201469200 |
 2019, Vol. 46
2019, Vol. 46


