文章信息
- 二甲双胍对人食管鳞癌侧群细胞的作用及机制
- Effect and Mechanism of Metformin on Side Population Cells of Human Esophageal Squamous Cell Carcinoma
- 肿瘤防治研究, 2019, 46(1): 20-25
- Cancer Research on Prevention and Treatment, 2019, 46(1): 20-25
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.18.1200
- 收稿日期: 2018-08-21
- 修回日期: 2018-10-26
2. 100021 北京,中国医学科学院北京协和医学院肿瘤医院肿瘤研究所分子肿瘤学国家重点实验室,病因及癌变研究室
2. Department of Etiology and Carcinogenesis and State Key Laboratory of Molecular Oncology, National Cancer Center/Cancer Hospital, Chinese Academy of Medical Sciences (CAMS) & Peking Union Medical College (PUMC), Beijing 100021, China
中国食管癌发病率位于全球食管癌发病率的第7位,死亡率居全球食管癌死亡率第10位[1]。而我国食管癌约90%病例是鳞状细胞癌[2]。目前食管癌的治疗方法主要是手术、放疗及化疗。迄今为止,尽管有多种可用的治疗选择,但食管癌的复发转移及其不良预后仍然是临床医学的难题。
自肿瘤干细胞(cancer stem cell, CSC)学说提出,众多学者把对食管癌的研究方向转到干细胞层面上来,以SP分选作为肿瘤干细胞的鉴定方式之一。Huang与Li等[3-4]用Hoechst 33342方法从食管癌细胞系和食管癌组织原代培养细胞中分离,鉴定出侧群(side population, SP)与非侧群(non-side population, NSP)细胞。SP细胞这群特殊的细胞具有高致瘤性、自我更新、多向分化、耐药的潜能,这些特性与肿瘤干细胞十分相似[5-7],因此SP分选渐渐成为研究肿瘤干细胞的重要方法,为进一步研究肿瘤干细胞的生物学功能和分子机制奠定了基础。
二甲双胍(metformin, Metf)在临床上广泛用于Ⅱ型糖尿病的治疗。对健康者的血糖并无明显影响。近年来,Metf的抗肿瘤作用受到广泛重视,因Metf对CSC具有抑制作用[8]。目前,Metf对食管癌CSCs的作用及机制尚需进一步研究,本文旨在研究二甲双胍对食管鳞癌SP细胞干性的作用及机制。
1 材料与方法 1.1 细胞株和主要试剂人食管鳞癌细胞系KYSE系列(30, 150, 180, 410, 450, 510)、S1、TE1、Ec109细胞购自协和医学院基础研究所。RPMI 1640培养基、胎牛血清购于美国Gibco公司。Hoechst 33342、盐酸二甲双胍购于美国Sigma-Aldrich公司。CCK-8试剂盒购于日本Dojindo化学公司。鼠抗β-actin单克隆抗体购于美国Santa Cruz公司。兔抗SOX2、OCT4单克隆抗体购于美国Abcam公司。山羊抗鼠二抗、山羊抗兔二抗购于北京中杉金桥公司。
1.2 细胞培养细胞系均用RPMI 1640(含10%胎牛血清)培养基于37℃、5%CO2的恒温培养箱培养。食管癌细胞进入对数生长期后,每2~3天用0.25%胰蛋白酶(含0.02%EDTA)传代一次.
1.3 SP细胞比例检测及分选取对数生长期的细胞,消化成单细胞悬液,PBS洗涤2遍,常规细胞计数,以1×106个细胞每毫升重悬于RPMI 1640培养基中(+2%FBS)。取1 ml重悬的液体,加入ABCG2抑制剂利血平,于37℃培养箱中避光孵育30 min,然后加入终浓度为5 μg/ml的荧光染料Hoechst 33342,于37℃培养箱中避光孵育90 min,期间间断振荡混匀。孵育结束后,用冷PBS洗涤细胞2次,离心收集,重悬于400 μl PBS中,用350 nm的紫外激光激发Hoechst 33342,用405/BP309(Hoechst蓝)滤光片测量荧光发射。流式细胞仪检测或分选。实验重复3次。
1.4 二甲双胍对细胞系SP比例的作用取处于对数生长期食管癌KYSE150细胞,消化成单细胞悬液,然后接种在6孔板中,待长到约6孔板面积的50%时,加入含不同浓度二甲双胍的新鲜细胞培养液,每个浓度设置3个平行孔;加入不同浓度二甲双胍后24 h后常规消化细胞为单细胞悬液,通过1.3步骤进行SP细胞比例检测。
1.5 使用CCK-8方法检测不同浓度二甲双胍对SP细胞增殖的影响取分选的SP细胞,常规细胞计数,按5 000个每孔接种于96孔板中过夜,第二天观察细胞贴壁情况良好后,每孔加入含不同浓度的二甲双胍培养基(终浓度分别为5、10、15、20 mmol/L),每个浓度设5个复孔,以不加药物的复孔为对照组。继续培养24和48 h后,加入配制好的CCK-8工作液,继续放入细胞培养箱中避光孵育2 h,于酶标仪中测定在450 nm处的吸光度(OD值)。吸光度(OD值)=实验组平均OD值-调零孔平均OD值。
1.6 二甲双胍对SP细胞平克隆形成能力的影响取分选的SP及NSP细胞,常规细胞计数,以300个每孔接种于6孔板,每孔加入含不同浓度的二甲双胍以及10%FBS的RPMI 1640培养基悬浮细胞,每个浓度设置3个平行孔,细胞置于37℃、5%CO2培养箱培养10~14天,至细胞克隆超过50个细胞时终止培养,无水甲醇溶液室温固定10 min,结晶紫室温染色20 min后流水冲洗染料,计数每孔克隆形成数。克隆形成率=每孔克隆形成数/每孔接种细胞数×100%。
1.7 二甲双胍对SP细胞成球能力的作用将分选后的细胞接种于6孔板中,加入不同浓度二甲双胍后48 h后将细胞常规消化为单细胞悬液,细胞计数,每孔2 000个细胞,接种于低吸附6孔板中,每个浓度设置3个平行孔,加入3 ml无血清成球培养基,将6孔板置于37℃、5%CO2培养箱中,培养10天,拍照并统计。
1.8 二甲双胍对SP细胞相关基因蛋白表达水平的影响取分选的SP细胞,PBS洗3次后加入含蛋白酶抑制剂的细胞裂解液进行总蛋白的提取。然后进行SDS-PAGE凝胶电泳分离,再将蛋白转至PVDF膜。经TBST/5%脱脂奶粉室温封闭后,依次孵育相应的一抗和二抗,最后进行显色。
1.9 统计学方法实验数据采用SPSS19.0统计学软件进行分析,本研究应用Student t test等检验方法,用GraphPad Prism 5.0软件制图,P < 0.05为差异有统计学意义。
2 结果 2.1 不同细胞系的SP比例为了明确细胞系的SP比例,本实验共检测9种食管鳞癌细胞系的SP比例,SP比例在0.2%~2%左右,且不同细胞系的SP比例不尽相同,见图 1。每种细胞系至少重复三次,经多次实验后,发现KYSE150细胞SP比例较稳定,遂对其进行分选及以下实验。
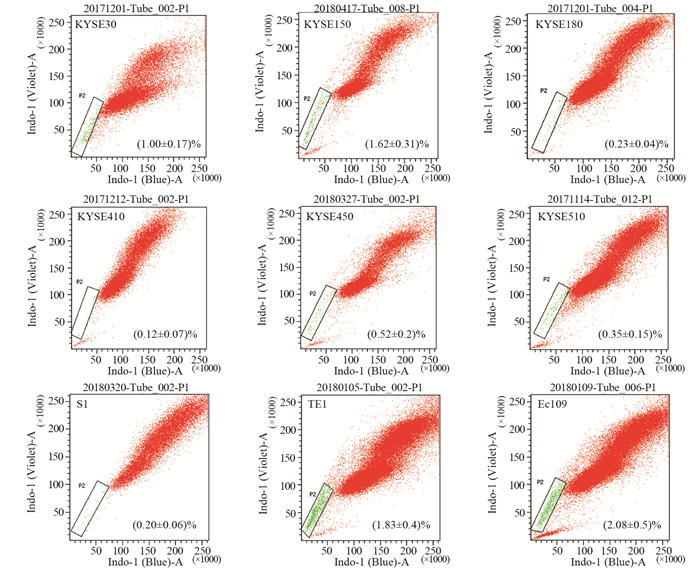
|
| 图 1 9种不同食管鳞癌细胞系的SP(side population)比例 Figure 1 SP radte of nine different esophageal squamous cell lines |
KYSE150细胞通过不同浓度的二甲双胍作用24 h后进行SP检测,发现对照组SP比例为(1.54±0.45)%,5 mmol/L二甲双胍作用24 h后的SP比例为(1.02±0.39)%,10 mmol/L二甲双胍作用24 h后SP比例降为(0.53±0.32)%,与对照组相比差异均有统计学意义(P=0.03和P=0.001)。由此可知二甲双胍能降低SP的比例,且SP比例的下降程度与二甲双胍浓度呈正相关性,见图 2。
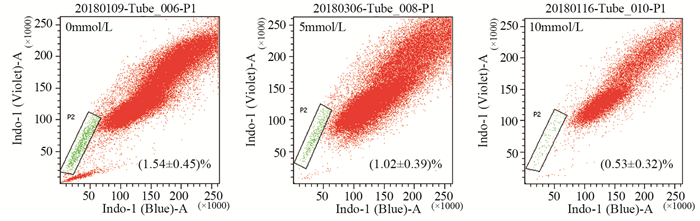
|
| 图 2 不同浓度二甲双胍对KYSE150 SP比例的影响 Figure 2 Effect of different concentrations of metformin on SP rate of KYSE150 |
分选后的SP细胞给予不同浓度二甲双胍作用24或48 h后,通过CCK-8方法检测细胞增殖,5 mmol/L二甲双胍处理SP细胞24 h后,细胞增殖并未受到影响,其余实验组测得细胞增殖均受到不同程度抑制,且细胞的增殖抑制程度与二甲双胍浓度及给药时间呈显著正相关性,见图 3。
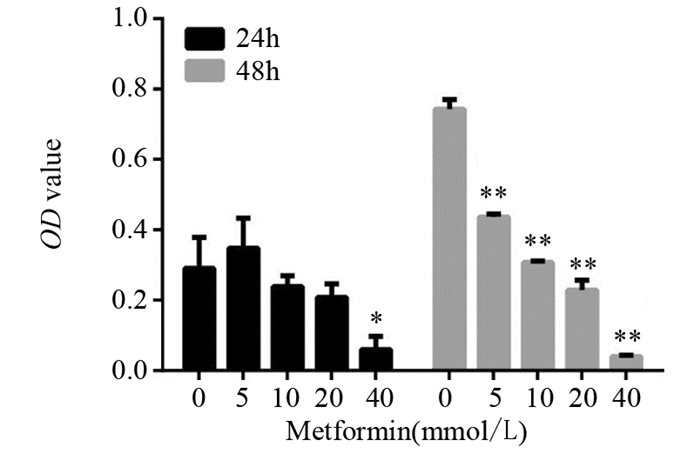
|
| *: P < 0.05, **: P < 0.01, compared with 0mmol/L group 图 3 不同浓度二甲双胍对SP细胞增殖的影响 Figure 3 Effect of different concentrations of metformin on proliferation of SP cells |
14天后观察分选后SP细胞的克隆形成情况,发现SP细胞形成克隆较NSP细胞的克隆较大且多,0 mmol/L二甲双胍SP细胞平均克隆数目为(122.2±10.31)个,NSP细胞平均克隆数目为(51.4±4.58)个,而在培养基中加入5 mmol/L二甲双胍组均未见克隆长出,差异有统计学意义(P=0.000),见图 4。
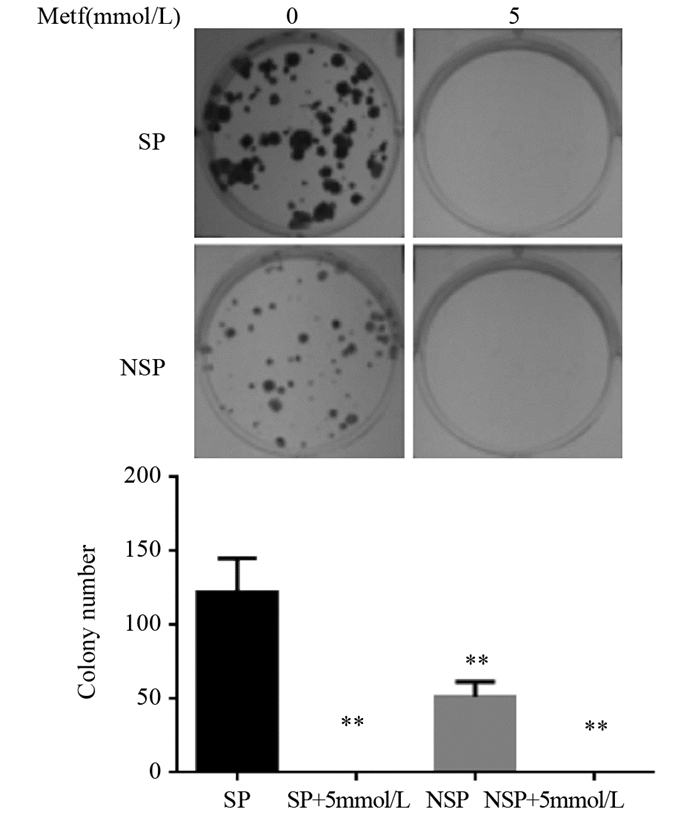
|
| **: P < 0.01, compared with SP group; NSP: non-side population 图 4 不同浓度二甲双胍对SP、NSP细胞克隆形成能力的影响 Figure 4 Effect of different concentrations of metformin on clonality of SP and non-side population (NSP) cells |
食管癌KYSEl50经不同浓度二甲双胍处理48 h后接种6孔板中,10天后结束培养并观察拍照,SP细胞中0 mmol/L二甲双胍组成球数目为(26.00±2.31)个,5 mmol/L二甲双胍组成球数目为(9.67±1.20)个,两者差异有统计学意义(P=0.003)。NSP细胞中0 mmol/L二甲双胍组成球数目为(9.00±1.16)个,5 mmol/L二甲双胍组成球数目为(1.67±0.67)个,两者差异有统计学意义(P=0.005),见图 5。
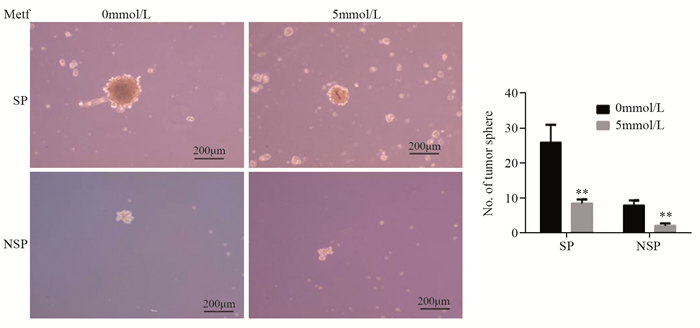
|
| Metf: metformin; **: P < 0.01, compared with SP group and NSP group respectively 图 5 不同浓度二甲双胍对SP、NSP细胞成球能力的影响 Figure 5 Effect of different concentrations of metformin on sphere-forming efficiency of SP and NSP cells |
分选后的SP细胞经不同浓度二甲双胍处理24 h后提取总蛋白,发现细胞中干细胞相关基因SOX2以及OCT4的表达均有不同程度的降低,见图 6。
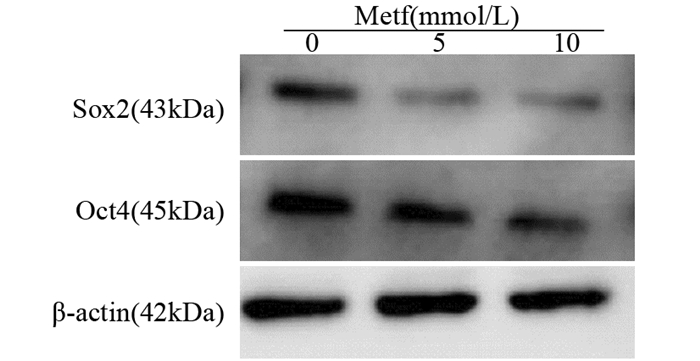
|
| 图 6 不同浓度二甲双胍对SP细胞相关基因蛋白表达水平的影响 Figure 6 Effect of different concentrations of Metf on expression of related genes protein in SP cells |
我国食管癌患者就诊时大多处于中晚期,无论是手术还是放化疗,其临床效果及预后均不能让人满意,甚至大多数患者在病理性完全缓解后早期出现远处转移。据统计,我国食管癌患者5年生存率约为20.9%[9]。尽管目前有一些新药物包括靶向药应用于食管癌的治疗,但对于绝大多数终末期食管癌患者来说,预后依然相对较差。放化疗后的复发转移仍然是患者预后差的主要原因。
肿瘤干细胞被认为是肿瘤细胞内具有无限分裂潜能、自我更新能力和固有化疗耐药性的一小部分细胞[10-11],虽只占肿瘤细胞的很少部分,但却有着强大的致瘤性、转移性和放疗抵抗性。肿瘤干细胞学说的提出很好地解释了有关肿瘤的发生、发展、转移、复发及耐药性等问题,并且提供了更多的肿瘤治疗和临床应用思路,若能够降低肿瘤干细胞的比例,将会在一定程度上降低患者的复发转移,改善肿瘤患者的预后。
目前流行病学研究显示Metf可以降低多种实体瘤的发生,范洪君等[12]以甲基苄基亚硝胺诱发大鼠食管癌,并用Metf治疗,其结果显示:Metf明显抑制食管癌的发生。Li和Wang等[13-14]的研究证明Metf抑制食管癌细胞增殖,并增强了食管癌对顺铂的敏感度。Honjo等[15]研究证明:因Metf靶向CSC和mTOR,所以Metf抑制食管癌细胞生长并且增强了食管癌细胞对5-Fu毒性敏感度。目前的研究支持以前的临床观察,即Metf用于临床治疗对食管癌患者有益,能够补充其他治疗,有效治疗食管癌。
在本实验中测得的9种食管鳞癌细胞系的SP细胞与NSP细胞比例在0.2%~2%左右,这个比例与世界文献报道的数值一致,结果表明:我们分离SP细胞的技术是科学的、可信的。SP细胞与NSP细胞比例各不相同,这与其恶性程度有一定的关系[16-17];同时放化疗的长期应用也可以富集SP细胞,因此SP/NSP的比例也可能与细胞系来源的患者是否经过放化疗有关。KYSE150来源为日本49岁女性低分化食管鳞癌,并经过放疗,这与其有着稳定的SP/NSP比例有一定的关系。平板克隆形成是检测单个肿瘤细胞增殖能力的简单方法,能形成克隆的细胞必为能贴壁并具有增殖活力的细胞;成球实验反应了细胞的干性,有许多实验研究,通过细胞成球实验来获得干细胞[18-19];SOX2及OCT4均为干细胞相关基因,对维持干细胞多向分化及自我更新能力有着非常重要的作用。Bao等[20]对胰腺癌的研究显示二甲双胍可以抑制胰腺癌细胞的增殖、克隆形成及成球能力,并降低CD44、EpCAM、EZH2、Notch-1、Nanog及Oct4等干性相关基因的表达从而杀伤胰腺癌干细胞。Honjo等[15]对食管腺癌的相关研究,结果显示二甲双胍可以抑制食管腺癌干性相关基因的表达并且抑制PI3K/mTOR信号转导通路增加氟尿嘧啶对食管腺癌干细胞的杀伤能力。
从本实验可看出,二甲双胍可以降低KYSE150细胞系的SP数量,抑制分选的SP细胞的增殖、平板克隆形成、成球实验等,并能够降低SOX2、OCT4等干细胞相关基因的表达,并且随着二甲双胍浓度的增高,其降低效果更明显。由此可知,二甲双胍能够在一定程度上降低食管癌细胞的干性,其可能也是通过降低干细胞相关基因的表达来杀伤干细胞,不过其具体机制仍需进一步深入研究。
二甲双胍作为临床上常用的治疗2型糖尿病的药物,其安全性及不良反应已知、价格低廉,已有多篇文章报道其对不同肿瘤的抑制作用等,通过本研究发现,二甲双胍能够杀伤肿瘤干细胞,在一定程度上降低肿瘤干细胞的比例,这可能为食管癌的临床治疗提供一个新的思路,为食管癌患者提供一个更有效的治疗方法。
作者贡献
邵凯迪:完成实验,并对原始数据进行初步分析,撰写原稿;王留兴:指导实验过程,帮助数据分析;陆士新:构思、设计实验,修改稿件并定稿
| [1] | 段纪俊, 严亚琼, 杨念念, 等. 中国恶性肿瘤发病与死亡的国际比较分析[J]. 中国医学前沿杂志(电子版), 2016, 8(7): 17–23. [ Duan JJ, Yan YQ, Yang NN, et al. International comparision analysis of China's cancer incidence and mortality[J]. Zhongguo Yi Xue Qian Yan Za Zhi(Dian Zi Ban), 2016, 8(7): 17–23. ] |
| [2] | Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65(2): 87–108. DOI:10.3322/caac.21262 |
| [3] | Huang D, Gao Q, Guo L, et al. Isolation and identification of cancer stem-like cells in esophageal carcinoma cell lines[J]. Stem Cells Dev, 2009, 18(3): 465–73. DOI:10.1089/scd.2008.0033 |
| [4] | Li H, Gao Q, Guo L, et al. The PTEN/PI3K/Akt pathway regulates stem-like cells in primary esophageal carcinoma cells[J]. Cancer Biol Ther, 2011, 11(11): 950–8. DOI:10.4161/cbt.11.11.15531 |
| [5] | He XK, Su TT, Si JM, et al. Metformin Is Associated With Slightly Reduced Risk of Colorectal Cancer and Moderate Survival Benefits in Diabetes Mellitus: A Meta-Analysis[J]. Medicine (Baltimore), 2016, 95(7): e2749. DOI:10.1097/MD.0000000000002749 |
| [6] | Heckman-Stoddard BM, Gandini S, Puntoni M, et al. Repurposing old drugs to chemoprevention: the case of metformin[J]. Semin Oncol, 2016, 43(1): 123–33. DOI:10.1053/j.seminoncol.2015.09.009 |
| [7] | Tian RH, Zhang YG, Wu Z, et al. Effects of metformin on survival outcomes of lung cancer patients with type 2 diabetes mellitus: a meta-analysis[J]. Clin Transl Oncol, 2016, 18(6): 641–9. DOI:10.1007/s12094-015-1412-x |
| [8] | Saini N, Yang X. Metformin as an anti-cancer agent: actions and mechanisms targeting cancer stem cells[J]. Acta Biochim Biophys Sin(Shanghai), 2018, 50(2): 133–43. |
| [9] | 张思维, 郑荣寿, 左婷婷, 等. 中国食管癌死亡状况和生存分析[J]. 中华肿瘤杂志, 2016, 38(9): 709–15. [ Zhang SW, Zheng RS, Zuo TT, et al. Mortality and survival analysis of esophageal cancer in China[J]. Zhonghua Zhong Liu Za Zhi, 2016, 38(9): 709–15. DOI:10.3760/cma.j.issn.0253-3766.2016.09.014 ] |
| [10] | Alvero AB, Chen R, Fu HH, et al. Molecular phenotyping of human ovarian cancer stem cells unravels the mechanisms for repair and chemoresistance[J]. Cell Cycle, 2009, 8(1): 158–66. DOI:10.4161/cc.8.1.7533 |
| [11] | 吕转, 李砺锋, 范智蕊, 等. 干细胞基因Lgr5在食管鳞癌组织中的表达及其临床意义[J]. 肿瘤防治研究, 2016, 43(10): 863–9. [ Lyu Z, Li LF, Fan ZR, et al. Expression and Clinical Significance of Stem Cells Gene Lgr5 in Esophageal Squamous Cell Carcinoma Tissues[J]. Zhong Liu Fang Zhi Yan Jiu, 2016, 43(10): 863–9. DOI:10.3971/j.issn.1000-8578.2016.10.008 ] |
| [12] | 范洪君.大鼠食管癌变及其化学预防研究[D].北京: 中国医学科学院北京协和医学院, 2017. [ Fan HJ. Esophageal carcinogenesis in rats and the chemoprevention study[D]. Beijing: Chinese Academy of Meical Sciences & Peiking Union Medical College, 2017. ] http://cdmd.cnki.com.cn/Article/CDMD-10023-1017225040.htm |
| [13] | Li PD, Liu Z, Cheng TT, et al. Redox-dependent modulation of metformin contributes to enhanced sensitivity of esophageal squamous cell carcinoma to cisplatin[J]. Oncotarget, 2017, 8(37): 62057–68. |
| [14] | Wang F, Ding X, Wang T, et al. Metformin inhibited esophageal squamous cell carcinoma proliferation in vitro and in vivo and enhanced the anti-cancer effect of cisplatin[J]. PLoS One, 2017, 12(4): e0174276. DOI:10.1371/journal.pone.0174276 |
| [15] | Honjo S, Ajani JA, Scott AW, et al. Metformin sensitizes chemotherapy by targeting cancer stem cells and the mTOR pathway in esophageal cancer[J]. Int J Oncol, 2014, 45(2): 567–74. DOI:10.3892/ijo.2014.2450 |
| [16] | Bapat SA, Mali AM, Koppikar CB, et al. Stem and progenitor-like cells contribute to the aggressive behavior of human epithelial ovarian cancer[J]. Cancer Res, 2005, 65(8): 3025–9. DOI:10.1158/0008-5472.CAN-04-3931 |
| [17] | Li L, Xie T. Stem cell niche: structure and function[J]. Annu Rev Cell Dev Biol, 2005, 21: 605–31. DOI:10.1146/annurev.cellbio.21.012704.131525 |
| [18] | 尹晓然, 冯诚, 马一楠, 等. OE19肿瘤干细胞的无血清分离培养以及肿瘤干细胞特性的鉴定[J]. 山西医科大学学报, 2017, 48(8): 800–7. [ Yin XR, Feng C, Ma YN, et al. Serum-free suspension culture and identification of cancer stem cells from human OE19 cell line[J]. Shanxi Yi Ke Da Xue Xue Bao, 2017, 48(8): 800–7. ] |
| [19] | 遇珑, 舒雄, 何永燕, 等. 胃癌干细胞单克隆抗体联合顺铂靶向治疗胃癌的实验研究[J]. 现代肿瘤医学, 2017, 25(7): 1001–5. [ Yu L, Shu X, He YY, et al. Experimental study on the treatment of gastric cancer by targeting specific antigen positive gastric cancer stem cell monoclonal antibody in combination with cisplatin[J]. Xian Dai Zhong Liu Yi Xue, 2017, 25(7): 1001–5. DOI:10.3969/j.issn.1672-4992.2017.07.002 ] |
| [20] | Bao B, Wang Z, Ali S, et al. Metformin inhibits cell proliferation, migration and invasion by attenuating CSC function mediated by deregulating miRNAs in pancreatic cancer cells[J]. Cancer Prev Res (Phila), 2012, 5(3): 355–64. DOI:10.1158/1940-6207.CAPR-11-0299 |
 2019, Vol. 46
2019, Vol. 46


