文章信息
- 长链非编码RNA-MALAT1对前列腺癌细胞增殖及凋亡的影响
- Effects of Long Non-coding RNA-MALAT1 on Proliferation and Apoptosis of Prostate Cancer Cells
- 肿瘤防治研究, 2019, 46(5): 411-416
- Cancer Research on Prevention and Treatment, 2019, 46(5): 411-416
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.18.1198
- 收稿日期: 2018-10-21
- 修回日期: 2018-12-29
2. 570100 海口,海口市中医医院耳鼻喉科
2. Department of Ear-nose-throat, Haikou Hospital of Traditional Chinese Medicine, Haikou 570100, China
前列腺癌(prostate cancer, PCa)是男性泌尿生殖系统发病率较高的恶性肿瘤之一,近年来我国前列腺癌发病率呈上升趋势[1]。因此,研究前列腺癌的致癌机制,开发新的研究方法,对挽救前列腺癌患者的生命具有重大意义。随着二代测序技术的发展,大量对长链非编码RNA(long non-coding RNA, lncRNA)的深入研究结果发现一些异常表达的lncRNA与肿瘤的发生与发展有关[2-4]。
肺腺癌转移相关转录子1(metastasis-associated lung adenocarcinoma transcript 1, MALAT1)属于lncRNA中的一种,研究发现,MALAT1的表达与癌细胞的增殖、转移、成瘤率及血管生成密切相关[5]。本研究以激素依赖性的前列腺癌细胞株PC3、LNCaP为对象,构建MALAT1过表达及干扰模型,通过对MALAT1过表达(或干扰后)前列腺癌细胞生物学行为变化的检测,探讨MALAT1在前列腺癌增殖中的作用机制,为研究前列腺癌发生发展机制奠定一定的基础。
1 材料与方法 1.1 实验材料激素依赖性前列腺癌细胞株PC3和LNCaP(武汉华联科生物技术有限公司,中国武汉);载体pCDH、pSICOR(Addgene,美国);RPMI 1640培养基(HyClone,美国);胎牛血清(Gibco,美国);TRIzol(Ambion,美国);YBR Green PCR试剂盒(KAPA Biosystems,美国);反转录试剂盒(TaKaRa,中国大连);PBS、胰蛋白酶、MTT、瑞氏-姬姆萨复合染液(Bioswamp,中国);细胞周期检测试剂盒、凋亡检测试剂盒(BD,美国);Matrigel(Corning,美国);兔抗人Cyclin D1单克隆抗体、兔抗人Bcl-2单克隆抗体、兔抗人Bax单克隆抗体及兔抗人ERK1/2单克隆抗体(Abcam,英国);兔抗人p-ERK1/2单克隆抗体(CST,美国)。
1.2 细胞复苏与培养将冻存的PC3及LNCaP细胞从液氮罐中取出后,移至37℃水浴中,将细胞悬液吸至离心管中,1 000 r/min离心3 min,弃上清液,在含10%胎牛血清的新鲜RPMI 1640培养基中培养,并置于37℃、含体积分数为5%CO2的培养箱内。
1.3 构建MALAT1过表达及siRNA载体为了探讨lncRNA-MALAT1对前列腺癌细胞增殖的作用机制,本研究构建了MALAT1过表达载体pCDH-MALAT1和干扰载体pSICOR-shMALAT1,以及起对照作用的过表达空载体和干扰空载体。MALAT1-siRNA序列:5’-TGTACTATCCCATCACTGAAG-3’。
1.4 荧光定量PCR检测MALAT1相对表达量利用TRIzol提取PC3细胞的总RNA,反转录生成cDNA,进行Real-time PCR扩增。MALAT1扩增引物序列:上游引物:5’-CCGCTGCTATTAGAATGC-3’;下游引物:5’-CTTCAACAATCACTACTCCAA-3’。内参基因β-Actin上游引物:5’-ACACTGTGCCCATCTACG-3’;下游引物:5’-TGTCACGCACGATTTCC-3’。PCR反应条件:95℃ 3 min;95℃ 5 s;56℃ 10 s;72℃ 25 s,共39个循环。
1.5 MTT检测细胞增殖取对数生长期细胞,调整浓度并分于96孔板,每种细胞设置3个复孔,37℃培养过夜。根据实验分组:(1)对照组(Control);(2)过表达空载体组(EV);(3)干扰空载体组(si-EV);(4)MALAT1过表达组(MALAT1);(5)MALAT1-siRNA干扰组(si-MALAT1),分组处理细胞,继续培养24、48和72 h。取出不同分组的细胞培养板,每孔加入20 μl MTT溶液(5 mg/ml),继续培养4 h。最后用酶联免疫检测仪测量各孔490 nm处的吸光度值。
1.6 流式细胞仪检测细胞周期及凋亡收集胰酶消化处理后的不同细胞,PBS清洗两次以后,加入400 µl碘化丙啶(propidium iodide, PI)溶液(50 μg/ml),避光染核10 min,用流式细胞仪测定细胞含量,确定细胞在有丝分裂各个时期所占的比例。将细胞重悬于200 μl结合缓冲液中,并加入5 μl Annexin V-FITC和5 μl PI溶液,轻轻混匀,4℃避光孵育30 min。最后,加入300 μl缓冲液,随即用流式细胞仪检测各组细胞凋亡情况。
1.7 基质胶检测成管能力在96孔板中加入50 μl Matrigel基质胶,在凝胶过程中,消化各组细胞并用PBS重悬,制备细胞悬液,加入100 μl细胞悬浮液。37℃孵育,14 h后观察细胞成管情况。
1.8 平板克隆检测细胞成瘤率取对数生长期的细胞,胰蛋白酶消化处理后吹打成单个细胞,并培养于含10%胎牛血清的培养液中备用。将细胞梯度稀释,放置于37℃、5%CO2及饱和湿度的培养箱中培养2~3周。4%多聚甲醛固定细胞,加适量GIMSA染色液进行染色。
1.9 Western blot检测细胞周期及凋亡相关蛋白表达本研究利用Western blot实验检测了Cyclin D1、Bcl-2、Bax及ERK1/2和p-ERK1/2蛋白的表达水平,实验过程如下:提取细胞蛋白并置于沸水浴中10 min,使蛋白变性。利用SDS-PAGE胶分离蛋白,电泳结束后湿转法将蛋白转印至PVDF膜上。5%脱脂奶粉室温封闭2 h,加入一抗室温孵育1 h,PBST洗膜3次,再加入二抗(1:10 000稀释HRP标记),室温孵育1 h。PBST洗涤三次后用ECL化学发光检测并拍照。
1.10 统计学方法实验数据以平均值±标准差(x±s)表示,应用SPSS22.0软件对以上实验所获得的数据进行统计学分析,多组间比较采用单因素方差分析,且P < 0.05为差异有统计学意义。
2 结果 2.1 MALAT1在PC3中的相对表达量荧光定量PCR检测前列腺癌细胞株PC3对照组、EV组、si-EV组、MALAT1组及si-MALAT1组中lncRNA-MALAT1的相对表达量。对照组与EV组、si-EV组的MALAT1相对表达量之间的差异无统计学意义;与对照组相比,MALAT1组中MALAT1表达量明显上调(P < 0.01),si-MALAT1组中MALAT1表达量明显下调(P < 0.01),说明MALAT1过表达和干扰细胞株构建成功,见图 1。
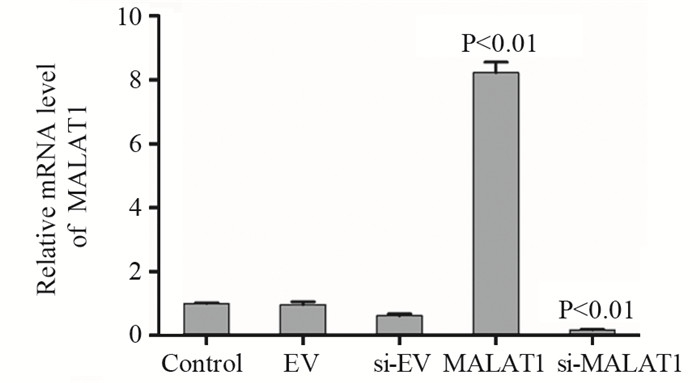
|
| P<0.01: compared with Control group; EV: empty vector of MALAT1 overexpression; si-EV: empty vector of MALAT1 interference; MALAT1: MALAT1 overexpression group; si-MALAT1: MALAT1 interference group 图 1 PC3中MALAT1的相对表达量 Figure 1 Relative expression of MALAT1 mRNA in PC3 cells |
MTT检测了培养24、48及72 h的PC3和LNCaP细胞株的细胞增殖情况,描绘对照组和四组实验组细胞的生长曲线。结果显示,MALAT1组的前列腺癌细胞体外增殖能力明显高于对照组和EV组(P < 0.01);si-MALAT1组的前列腺癌细胞的增殖能力明显低于对照组和si-EV组(P < 0.01),见图 2。
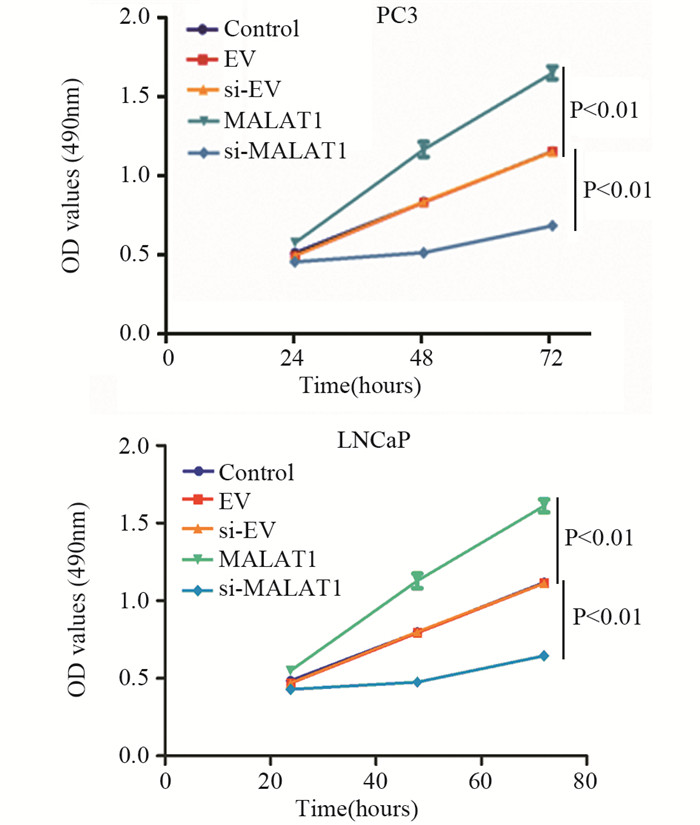
|
| 图 2 MALAT1对细胞增殖能力的影响 Figure 2 Effects of MALAT1 on proliferation of PC3 and LNCaP cells in vitro |
PC3和LNCaP细胞中MALAT1组处于静止期和DNA合成前期(G0/G1期)的细胞数量多于对照组,在DNA合成期(S期)的细胞少于对照组;si-MALAT1组处于G0/G1期的细胞数量少于对照组,而S期细胞多于对照组,见图 3。MALAT1组的细胞凋亡率与对照组细胞凋亡率相近;si-MALAT1组的细胞凋亡率高于对照组,见图 4。
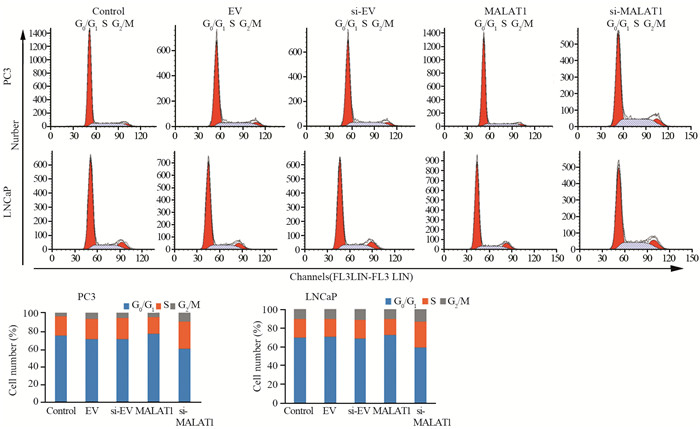
|
| 图 3 MALAT1对PC3、LNCaP细胞周期的影响 Figure 3 Effects of MALAT1 on cell cycle of PC3 and LNCaP cells |
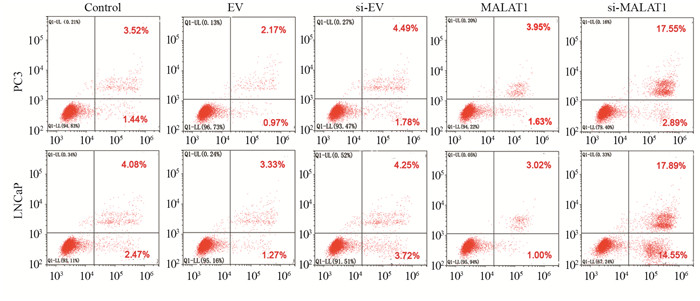
|
| 图 4 MALAT1对PC3、LNCaP细胞凋亡的影响 Figure 4 Effects of MALAT1 on apoptosis of PC3 and LNCaP cells |
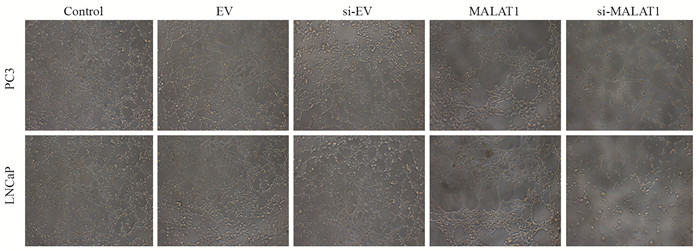
PC3、LNCaP细胞中,与对照组比较,MALAT1组细胞形成的管状结构更多,在主要的管状结构附近聚集的血管内皮层细胞也更多,更容易形成分支。而si-MALAT1组的内皮层细胞少,基本没有形成管状结构,见图 5。
|
| 图 5 MALAT1对PC3、LNCaP细胞血管形成的影响(×100) Figure 5 Effects of MALAT1 on angiogenesis of PC3 and LNCaP cells (×100) |
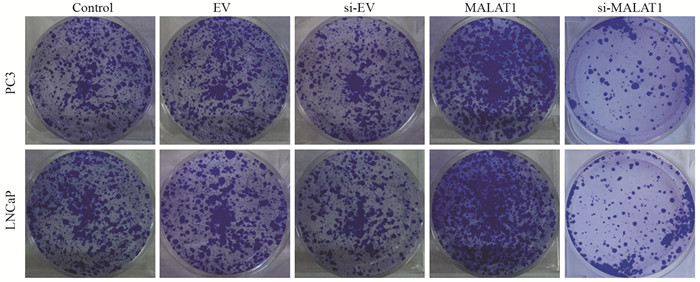
MALAT1组的PC3、LNCaP细胞的克隆数量明显多于对照组,说明MALAT1组细胞的克隆形成能力明显增强。si-MALAT1组的细胞数量明显少于对照组,克隆形成能力减弱,见图 6。
|
| 图 6 MALAT1对PC3、LNCaP细胞克隆形成能力的影响 Figure 6 Effects of MALAT1 on clone formation of PC3 and LNCaP cells |
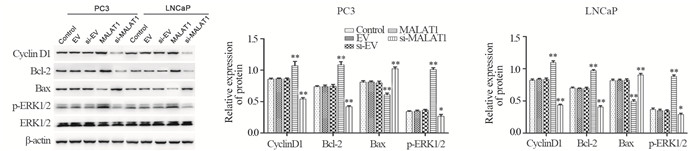
与对照组相比,MALAT1组细胞中参与周期调控的Cyclin D1蛋白、抗凋亡蛋白Bcl-2及磷酸化的细胞外信号调节激酶(p-ERK1/2)的表达水平显著升高(P < 0.01),而促凋亡蛋白Bax的表达水平明显降低(P < 0.01);si-MALAT1组的Cyclin D1、Bcl-2和p-ERK1/2蛋白表达水平显著降低(P < 0.05或P < 0.01),Bax表达水平升高(P < 0.01),见图 7。
|
| *: P<0.05, **: P<0.01 vs. Control group 图 7 MALAT1对Cyclin D1、Bcl-2、Bax及p-ERK1/2表达的影响 Figure 7 Effects of MALAT1 on expression of Cyclin D1, Bcl-2, Bax and p-ERK1/2 |
前列腺癌的发病率随着生活质量的提高呈现上升趋势,对前列腺癌的发生和发展研究也随之增多。近些年研究发现lncRNA在前列腺癌的发生发展过程中扮演了重要的角色:Chung等研究发现PRNCR1(前列腺非编码RNA1)-siRNA会减弱前列腺癌细胞的生存、增殖能力和雄激素受体的活性,揭示PRNCR1通过影响雄激素受体活性参与前列腺癌的发生过程,为前列腺癌的发病机制提供了新的认识[6];lncRNA SOCS2-ASI可以促进前列腺癌细胞的生长、抑制凋亡,对前列腺癌的发生发展影响甚大[7];Liu等发现lncRNA-PVTI在前列腺癌发生过程中表达上调,进一步研究其影响机制,发现lncRNA-PVTI与miR-146a存在调控关系,过表达lncRNA-PVTI或沉默miR-146a,可明显提高前列腺癌细胞的活力,抑制细胞凋亡[8]。
MALAT1是一种致癌性的长链非编码RNA,参与癌细胞的增殖、转移等过程,在宫颈癌、结直肠癌、非小细胞肺癌以及食管鳞状细胞癌等癌细胞中都表达上调[9-12]。Cai等发现,MALAT1在人骨肉瘤细胞和组织中都表达上调,而敲除MALAT1显著抑制了骨肉瘤细胞的增殖和迁移,并诱导了细胞的周期阻滞和凋亡,这些结果表明MALAT1在骨肉瘤中有促癌的作用[13]。Ren等的研究表明MALAT1也参与了前列腺癌细胞的发展过程,发现MALATI-siRNA抑制了前列腺癌细胞的增殖、迁移和侵袭,并在G0/G1期诱导周期阻滞,可作为去势抗性前列腺癌的潜在治疗靶点[14]。Cyclin D1是周期蛋白家族成员之一,细胞从G1期进入S期需要Cyclin/CDK进行调控[15]。本研究结果发现MALAT1过表达后细胞增殖能力增强,且促进了细胞从G0/G1期向S期转换,进一步检测周期蛋白Cyclin D1表达,显示MALAT1过表达组的Cyclin D1蛋白表达量显著高于对照组,而干扰组降低,该结果说明MALAT1过表达促进Cyclin D1高表达,从而促进了细胞增殖。对细胞凋亡情况进行研究,发现MALAT1过表达组凋亡率降低,干扰组升高,MALAT1过表达组的抗凋亡因子Bcl-2高表达,而促凋亡因子Bax低表达,MALAT1表达干扰后结果相反,说明MALAT1过表达会抑制癌细胞凋亡,干扰MALAT1表达则促进细胞凋亡。本研究还检测了各组细胞p-ERK1/2蛋白相对表达量,结果显示MALAT1过表达组高表达p-ERK1/2,推测MALAT1促进了ERK1/2信号通路的激活,进而影响前列腺癌细胞的生物学行为发生变化。
综上所述,MALAT1过表达促进前列腺癌细胞的增殖,抑制凋亡,在前列腺癌的发生、发展过程中发挥重要的作用。而干扰MALAT1的表达后,抑制了癌细胞的增殖,并促进其凋亡,推测抑制MALAT1表达会对前列腺癌的治疗具有非常重要的意义,但lcnRNA-MALAT1对前列腺癌的具体作用机制还需进一步深入研究。
作者贡献
宋 鹏:设计研究方案、实施研究过程、撰写论文
龙 彤:课题设计、撰写论文
梁培育:提出研究思路、分析试验数据、审核论文
欧善际:实施研究过程、资料搜集整理、修改论文
| [1] | Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115–32. DOI:10.3322/caac.21338 |
| [2] | Yang F, Zhang L, Huo XS, et al. Long noncoding RNA high expression in hepatocellular carcinoma facilitates tumor growth through enhancer of zeste homolog 2 in humans[J]. Hepatology, 2011, 54(5): 1679–89. DOI:10.1002/hep.24563 |
| [3] | Wan G, Hu X, Liu Y, et al. A novel non-coding RNA lncRNA-JADE connects DNA damage signalling to histone H4 acetylation[J]. EMBO J, 2013, 32(21): 2833–47. DOI:10.1038/emboj.2013.221 |
| [4] | Wu P, Zuo X, Deng H, et al. Roles of long noncoding RNAs in brain development, functional diversification and neurodegenerative diseases[J]. Brain Res Bull, 2013, 97: 69–80. DOI:10.1016/j.brainresbull.2013.06.001 |
| [5] | Li Y, Wu Z, Yuan J, et al. Long non-coding RNA MALAT1 promotes gastric cancer tumorigenicity and metastasis by regulating vasculogenic mimicry and angiogenesis[J]. Cancer Lett, 2017, 395: 31–44. DOI:10.1016/j.canlet.2017.02.035 |
| [6] | Chung S, Nakagawa H, Uemura M, et al. Association of a novel long non‐coding RNA in 8q24 with prostate cancer susceptibility[J]. Cancer Sci, 2011, 102(1): 245–52. DOI:10.1111/cas.2010.102.issue-1 |
| [7] | Misawa A, Takayama KI, Urano T, et al. Androgen-induced lncRNA SOCS2-AS1 Promotes Cell Growth and Inhibits Apoptosis in Prostate Cancer Cells[J]. J Biol Chem, 2016, 291(34): 17861–80. DOI:10.1074/jbc.M116.718536 |
| [8] | Liu HT, Fang L, Cheng YX, et al. LncRNA PVT1 regulates prostate cancer cell growth by inducing the methylation of miR‐146a[J]. Cancer Med, 2016, 5(12): 3512–9. DOI:10.1002/cam4.900 |
| [9] | Jiang Y, Li Y, Fang S, et al. The role of MALAT1 correlates with HPV in cervical cancer[J]. Oncol Lett, 2014, 7(6): 2135–41. DOI:10.3892/ol.2014.1996 |
| [10] | Zheng HT, Shi DB, Wang YW, et al. High expression of lncRNA MALAT1 suggests a biomarker of poor prognosis in colorectal cancer[J]. Int J Clin Exp Pathol, 2014, 7(6): 3174–81. |
| [11] | Ji P, Diederichs S, Wang W, et al. MALAT-1, a novel noncoding RNA, and thymosin beta4 predict metastasis and survival in early-stage non-small cell lung cancer[J]. Oncogene, 2003, 22(39): 8031–41. DOI:10.1038/sj.onc.1206928 |
| [12] | Cao X, Zhao R, Chen Q, et al. MALAT1 might be a predictive marker of poor prognosis in patients who underwent radical resection of middle thoracic esophageal squamous cell carcinoma[J]. Cancer Biomark, 2015, 15(6): 717–23. DOI:10.3233/CBM-150513 |
| [13] | Cai X, Liu Y, Yang W, et al. Long noncoding RNA MALAT1 as a potential therapeutic target in osteosarcoma[J]. J Orthop Res, 2016, 34(6): 932–41. DOI:10.1002/jor.23105 |
| [14] | Ren S, Liu Y, Xu W, et al. Long noncoding RNA MALAT-1 is a new potential therapeutic target for castration resistant prostate cancer[J]. J Urol, 2013, 190(6): 2278–87. DOI:10.1016/j.juro.2013.07.001 |
| [15] | 钟伟枫, 刘思平, 潘斌, 等. 龙葵素通过诱导细胞周期G1/S阻滞抑制裸鼠前列腺癌细胞Du145移植瘤生长[J]. 南方医科大学学报, 2016, 36(5): 665–70. [ Zhong WF, Liu SP, Pan B, et al. Solanine inhibits prostate cancer Du145 xenograft growth in nude mice by inducing cell cycle arrest in G1/S phase[J]. Nan Fang Yi Ke Da Xue Xue Bao, 2016, 36(5): 665–70. DOI:10.3969/j.issn.1673-4254.2016.05.013 ] |
 2019, Vol. 46
2019, Vol. 46
