文章信息
- PD-1/PD-L1抑制剂对比化疗一线治疗晚期非小细胞肺癌的Meta分析
- Efficacy and Safety of PD-1/PD-L1 Inhibitor Versus Chemotherapy in First-line Treatment of Advanced Non-small Cell Lung Cancer: A Meta-analysis
- 肿瘤防治研究, 2019, 46(5): 440-446
- Cancer Research on Prevention and Treatment, 2019, 46(5): 440-446
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2019.18.1190
- 收稿日期: 2018-09-29
- 修回日期: 2018-12-20
肺癌是目前世界范围内最常见的恶性肿瘤,其中晚期非小细胞肺癌(non-smal1 cel1 lung cancer, NSCLC)约占80%~85%[1]。其中有30%~40%的晚期NSCLC患者有表皮生长因子受体(epidermal growth factor receptor, EGFR)、间变性淋巴瘤激酶(ALK)驱动基因突变,可通过小分子靶向药物治疗获益,但仍有60%~70%晚期NSCLC无EGFR/ALK驱动基因突变,只能通过化疗来控制疾病进展[2-3]。然而化疗带来的生存获益有限,有Ⅲ期临床试验表明,晚期NSCLC接受以铂类为基础的一线化疗其中位无进展生存期为4~6月,平均总生存期为10~13月[4]。因此,我们需要探索新的且有效的一线治疗方案来改善晚期NSCLC患者的生存与预后。
近年来,晚期NSCLC患者的免疫治疗成为继分子靶向治疗之后的新热点,其中以程序性死亡受体1(programmed cell death-1, PD-1)/程序性死亡配体1(programmed cell death-ligand 1,PD-L1)为靶点的免疫治疗药物如:派姆单抗(Pembrolizumab),纳武单抗(nivolumab)及阿特朱单抗(atezolizumab)已自2015年起经FDA批准用于晚期NSCLC的二线治疗,及PD-1/PD-L1表达阳性(TPS≥50%)且无EGFR、ALK等驱动基因突变的晚期NSCLC的一线治疗,并获得了良好的治疗效果[5]。但是PD-1/PD-L1抑制剂是否优于化疗一线治疗晚期NSCLC,目前国内外未见相关系统评价。本研究旨在系统评价PD-1/PD-L1抑制剂对比化疗一线治疗晚期NSCLC的有效性及安全性,以期为临床决策提供最佳循证医学证据。
1 资料与方法 1.1 检索联机检索Web of science、PubMed、The Cochrane Library、EMbase、CNKI和万方数据库,以及ASCO会议摘要内容、The New England Oncology、The Lancet Oncology、Journal of Clinical Oncology等杂志,从建库至2018年6月,以“Non-small cell lung cancer、Anti-PD-1、Anti-PD-L1、immunotherapy、Nivolumab、Pembrolizumab、Atezolizumab、PD-1/PD-L1抑制剂、非小细胞肺癌、免疫治疗”为检索词,以不同组合进行文献检索及手工检索,并追踪纳入文献的参考文献,收集国内外发表的关于PD-1/PD-L1抑制剂对比化疗一线治疗晚期NSCLC的临床随机对照试验(randomized controlled trials, RCTs)。语种不限,当多篇报道相同时,只评估最新文献。
1.2 纳入和排除标准 1.2.1 研究对象(1)病理诊断为非小细胞肺癌;(2)TNM分期为ⅢB~Ⅳ期;(3)既往未接受过治疗的非小细胞肺癌患者。
1.2.2 研究类型Ⅱ~Ⅲ期随机对照试验,无论是否采用盲法。 1.2.3 干预方法(1)试验组采用PD-1/PD-L1抑制剂联合化疗,对照组为化疗;(2)试验组采用单药PD-1/PD-L1抑制剂,对照组为化疗。要求对给药的途径、剂量、周期予详细描述。
1.2.4 结局指标(1)无进展生存期(progression-free survival, PFS);(2)总生存期(overall survival, OS);(3)高客观有效率(overal1 response rate, ORR);(4)3~4级不良反应:按照1988年WHO抗癌药物毒副作用标准或常见不良反应事件评价标准CTCEA4.0版。
1.2.5 排除标准(1)非临床试验及RCT研究;(2)原始文献未给出Kaplan-Meier生存曲线或数据不全,无法获得风险比(hazard ratio, HR)数据的文献;(3)研究对象及干预措施不符合纳入标准;(4)结局指标不明确的研究。
1.3 文献筛选和资料提取2人独立筛选文献资料及结局指标包括:研究名称、发表年份、样本量、干预措施、PFS、OS及其HR与95%CI、ORR、3~4级不良反应发生例数。如有三臂研究,只提取符合纳入标准与和研究相关指标。
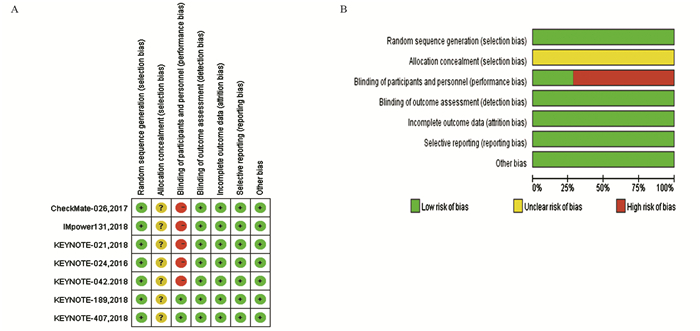
1.4 文献质量评价标准采用Cochrane系统评价手册5.3对纳入研究进行质量评估,从随机对照研究、分配隐藏、参与者和研究人员的盲法、结局评价的盲法、不全性结局指标、选择性报告及其他偏倚7个方面进行评价。依据评价结果,将纳入文献分为“高风险”、“低风险”和“情况不明”[6]。
1.5 统计学方法采用RevMan 5.3软件进行Meta分析。PFS及OS采用HR及其95%可信区间(confidence interval, CI)为效应分析统计量,二分类变量如ORR及不良反应发生率采用相对危险度(relative risk, RR)及其95%CI为效应分析统计量。文献无HR及95%CI者,按Prmar等研究者[7]推荐,K-M生存曲线或Log rank检验P值计算HR,用方差倒数法估计及合并HR及95%CI[8]。每个分析均进行异质性检验,如I2≤50%或P≥0.05,各研究间具有较好同质性,采用固定效应模型进行合并及分析;如I2 > 50%或P < 0.05,各研究间存在异质性,采用随机效应模型分析,并对可能导致异质性的因素进行敏感度分析。定义双侧界值P < 0.05为差异有统计学意义。对纳入文献的偏倚风险评价应用Stata12作Begg’s test或Egger’s test分析。
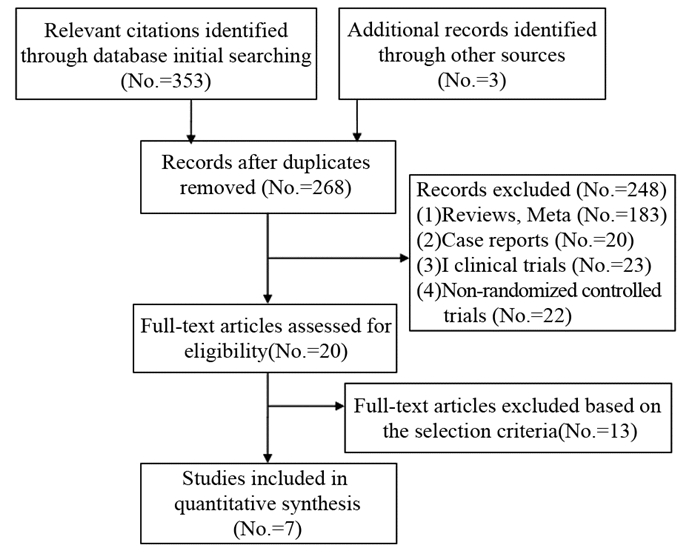
2 结果 2.1 文献检索和筛选结果初检获356篇,剔除重复文献后余268篇,阅读题目摘要排除非随机对照试验、个案报道及综述等选出20篇,通过阅读全文,最终余7篇[9-15],见图 1。
|
| 图 1 文献检索及筛选流程图 Figure 1 Flow diagram of literature retrieval and screening |
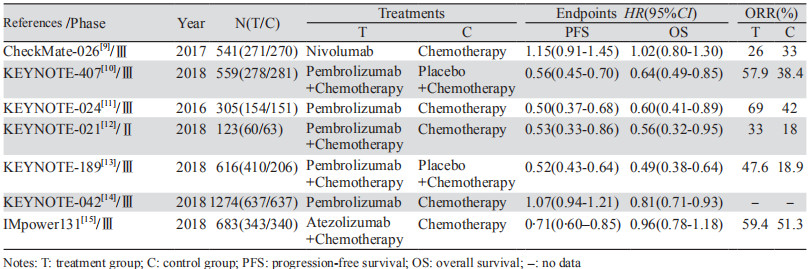
本研究共纳入7项RCT,7篇英文。共有晚期非小细胞肺癌4 101例,实验组,即免疫治疗组为接受PD-1/PD-L1抑制剂+化疗或单药PD-1/PD-L1抑制剂方案治疗,共2 153例;对照组,即为接受化疗或安慰剂+化疗治疗方案,共1 948例。其中4篇文献报道PD-1/PD-L1抑制剂+化疗vs.化疗[10, 12-13, 15],3篇文献报道PD-1/PD-L1抑制剂vs.化疗[9, 11, 14]。纳入文献基本特征见表 1,质量评价见图 2。
|
| 图 2 文献质量评价 Figure 2 Quality assessment of literatures |
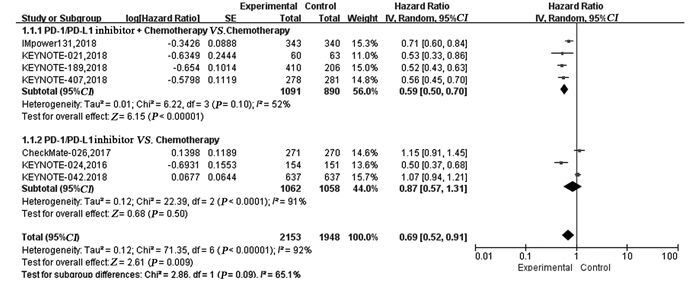
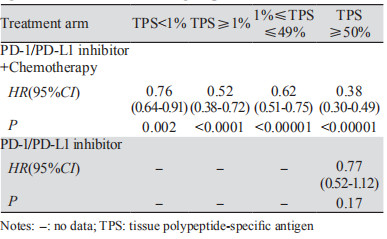
7项RCT的PFS之间存在一定异质性(P < 0.00001, I2=92%),故采用随机效应模型进行荟萃分析并绘制森林图。结果显示PD-1/PD-L1抑制剂+化疗对比化疗可显著延长晚期NSCLC患者的PFS(HR=0.59, 95%CI: 0.50~0.70, P < 0.00001);而单药PD-1/PD-L1抑制剂对比化疗在延长PFS方面无明显优势,两组差异无统计学意义(HR=0.87, 95%CI: 0.57~1.31, P=0.50),见图 3。亚组分析显示,与化疗相比,无论PD-L1表达程度如何,PD-1/PD-L1抑制剂+化疗一线治疗晚期NSCLC患者均可显著延长PFS,见表 2。且PD-L1表达程度越高,疗效获益更显著。单药PD-1/PD-L1抑制剂一线治疗PD-L1高表达(TPS≥50%)的晚期NSCLC对延长PFS未见明显优势(HR=0.77, 95%CI: 0.52~1.12, P=0.17)。
|
| 图 3 试验组与对照组相比对无进展生存期(PFS)的Meta分析 Figure 3 Meta-analysis results of PFS between experimental and control group |
|
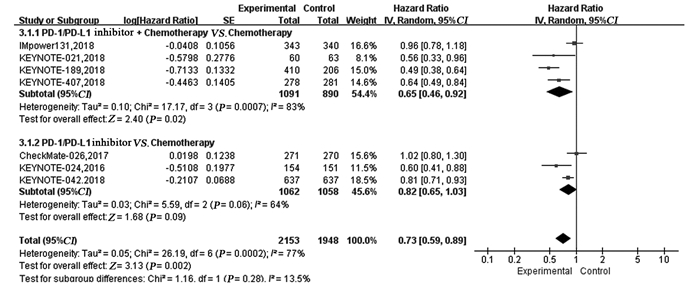
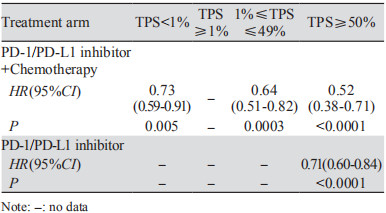
7项RCT OS之间存在一定异质性(P=0.0002, I2=77%),故采用随机效应模型进行荟萃分析并绘制森林图。结果显示PD-1/PD-L1抑制剂+化疗对比化疗可显著延长晚期NSCLC患者的OS(HR=0.65, 95%CI: 0.46~0.92, P=0.02);单药PD-1/PD-L1抑制剂对比化疗在延长OS方面无明显优势,两组差异无统计学意义(HR=0.82, 95%CI: 0.65~1.03, P=0.09),见图 4。亚组分析显示与化疗相比,无论PD-L1表达程度如何,PD-1/PD-L1抑制剂+化疗一线治疗晚期NSCLC患者均可显著延长OS,且PD-L1表达程度越高,疗效获益更显著,见表 3。单药PD-1/PD-L1抑制剂一线治疗PD-L1高表达的(TPS≥50%)晚期NSCLC可显著延长OS(HR=0.71, 95%CI: 0.60~0.84, P < 0.0001),差异有统计学意义,见表 3。
|
| 图 4 试验组与对照组相比对总生存期(OS)的Meta分析 Figure 4 Meta-analysis results of OS between experimental and control groups |
|
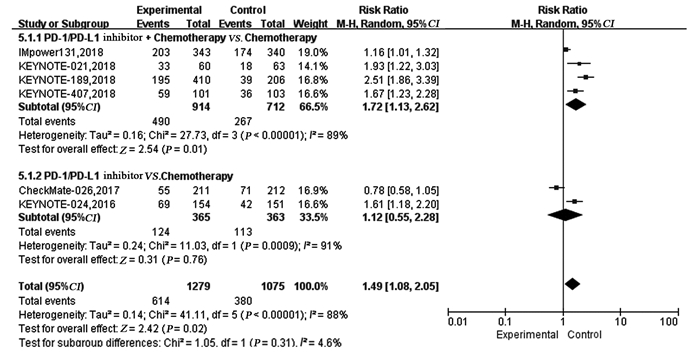
本项研究纳入分析的7项RCT有6项研究[9-13, 15]报道了ORR,各研究间存在一定异质性(P < 0.00001, I2=88%),故采用随机效应模型进行荟萃分析并绘制森林图。结果显示PD-1/PD-L1抑制剂+化疗ORR是化疗的1.72倍,两组差异有统计学意义(RR=1.72, 95%CI: 1.13~2.62, P=0.01);单药PD-1/PD-L1抑制剂ORR是化疗的1.12倍,两组差异无统计学意义(RR=1.12, 95%CI: 0.55~2.28, P=0.76),见图 5。
|
| 图 5 试验组与对照组相比对客观有效率(ORR)的Meta分析 Figure 5 Meta-analysis results of ORR between experimental and control groups |
本文纳入的7项RCT,其中有6项报道了3~4级的不良反应事件,各研究间存在一定异质性(P < 0.00001,I2=97%),故采用随机效应模型分析。结果显示PD-1/PD-L1抑制剂+化疗3~4级不良反应发生率是化疗的1.09倍,两组差异无统计学意义(HR=1.09, 95%CI: 0.99~1.20, P=0.09);单药PD-1/PD-L1抑制剂3~4级不良反应发生率是化疗的0.43倍,两组差异有统计学意义(RR=0.43, 95%CI: 0.36~0.52, P < 0.00001),见图 6。
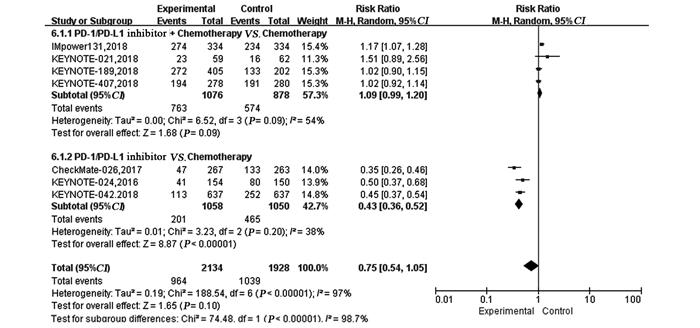
|
| 图 6 试验组与对照组相比对3~4级不良反应的Meta分析 Figure 6 Meta-analysis results of grade 3-4 toxicities between experimental and control groups |
本文采用Egger回归法和Begg秩相关法评价,结果显示无明显发表偏倚(Begg’s test: P=0.764; Egger’s test: P=0.292),见图 7。
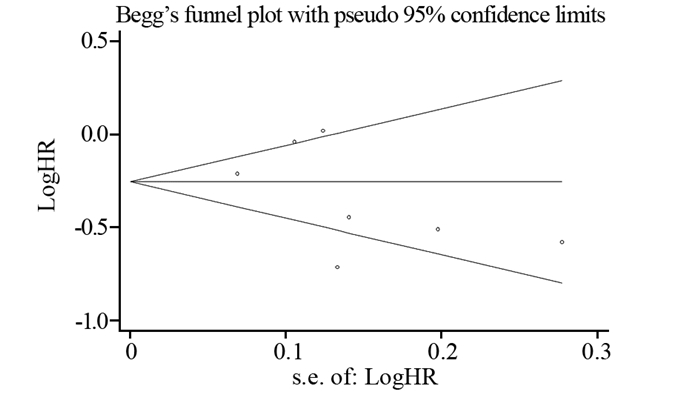
|
| 图 7 试验组对比对照组总生存期的漏斗图 Figure 7 Begg's funnel plot of OS between experimental and control groups |
目前晚期NSCLC一线治疗仍以化疗为主,对于EGFR敏感基因18-21位点突变的NSCLC,可以选择如表皮生长因子受体酪氨酸激酶抑制剂吉非替尼、厄洛替尼、阿法替尼等靶向药物;对于ALK融合基因阳性的NSCLC可以选择克唑替尼等。近年来,随着对信号转导通路及基因的进一步研究,免疫检查点特异性阻滞剂在晚期NSCLC的一线治疗中展现出了巨大的潜力,NSCLC的免疫治疗进入了一个新阶段[16]。PD-1和PD-L1是一对免疫抑制性因子,PD-L1是PD-1的主要配体,在很多恶性肿瘤细胞中过表达,其中包括NSCLC。PD-1和PD-L1为抑制性共刺激分子,可抑制CD4+T/CD8+T细胞的增殖和活化,负性调控机体免疫应答过程,从而促进肿瘤的逃逸、生长及转移。因此,阻断PD-Ll与PD-l的相互作用,提高免疫系统的活性,为肿瘤患者的抗癌治疗提供了一项突破性措施[17-18]。Pembrolizumab和Nivolumab是针对PD-1的完全人源化免疫球蛋白G(IgG4)拮抗剂单克隆抗体。多项研究[10-11, 13-14]表明Pembrolizumab单药或联合化疗一线治疗晚期NSCLC可以改善患者的OS和ORR,FDA于2015年批准其用于治疗NSCLC。Nivolumab对比多西他赛二线治疗晚期NSCLC,展现出较高的中位生存期[19-20],而CheckMate-026[9]研究显示Nivolumab单药对比化疗一线治疗晚期NSCLC在PFS、OS方面未显示出明显优势。Atezolizumab是一种人源化抗PD-L1的免疫球蛋白G1单克隆抗体,IMpower131[15]研究结果表明Atezolizumab联合化疗对比化疗一线治疗晚期NSCLC展现出更长的PFS。为了进一步验证PD-1/PD-L1抑制剂在晚期NSCLC患者一线治疗中的作用和安全性,本研究进行了系统的荟萃分析。
本项研究共纳入7项RCT研究进行荟萃分析,与化疗相比,PD-1/PD-L1抑制剂联合化疗相对单药PD-1/PD-L1抑制剂一线治疗晚期NSCLC在延长PFS(P < 0.00001)、OS(P=0.02)及提高ORR(P=0.02)方面更有优势。亚组分析显示无论PD-L1表达如何,PD-1/PD-L1抑制剂联合化疗一线治疗晚期NSCLC均可临床获益,PD-L1表达程度越高,疗效获益越显著。且为PD-L1低表达、鳞状NSCLC的患者一线治疗带来更多选择。这与KEYNOTE-407[10]、IMpower131[15]及KEYNOTE-189[13]等临床研究相一致。单药PD-1/PD-L1抑制剂对比化疗一线治疗PD-L1高表达(TPS≥50%)的晚期NSCLC可显著延长患者OS,但对延长PFS未见明显优势。这与KEYNOTE-042[14]临床研究结果相一致。由于单药PD-1/PD-L1抑制剂一线治疗晚期NSCLC研究尚少,其中仅有KEYNOTE-042一项研究针对PD-L1的不同表达程度(TPS≥1%、TPS≥50%、1%≤TPS≤49%)进行亚组分析,故而未能进行数据合并。且该研究结果显示单药PD-1/PD-L1抑制剂(Pembrolizumab)治疗可显著延长PD-L1 TPS≥1%晚期NSCLC患者OS,潜在扩大了单药PD-1/PD-L1抑制剂(Pembrolizumab)在PD-L1表达阳性晚期NSCLC患者的一线治疗地位。但由于目前样本量少,是否在大样本中仍具有生存优势,暂时还不得而知,仍需要进一步研究。
安全性方面,本研究对PD-l/PD-L1抑制剂和化疗在晚期NSCLC患者中的不良反应进行了比较。文献中提到的治疗相关不良反应主要包括皮疹、脱发、腹泻、贫血、恶心、肌痛、食欲下降、肺炎、中性粒细胞减少症。与化疗相比,PD-l/PD-L1抑制剂联合化疗对比化疗无新发不良反应,未显著增加3~4级不良反应。单药PD-1/PD-L1抑制剂对比化疗在晚期NSCLC患者的一线治疗中,就安全性方面存在优势。然而,本项研究纳入的各研究间存在一定异质性,考虑原因有以下几点:(1)肿瘤是多因素疾病,影响预后的因素较多,需长期随访,增加了临床试验的难度,影响数据的真实性。(2)各研究提供的样本含量大小不一,所得数据本身有偏差,经过荟萃分析后偏差积累更大。
综上所述,本研究肯定了PD-1/PD-L1抑制剂在一线治疗晚期NSCLC治疗中的临床获益。相对化疗,PD-1/PD-L1抑制剂联合化疗为PD-L1低表达、鳞状NSCLC患者带来的总体生存意义更大。PD-L1表达阳性的患者,不愿意接受化疗或不适合化疗及靶向治疗,可以优先选择单纯PD-1/PD-L1抑制剂作为一线治疗,且PD-L1表达越高,疗效受益越大。与化疗相比,PD-1/PD-L1抑制剂联合化疗及单纯PD-1/PD-L1抑制剂均具有良好的安全性。当然目前PD-1/PD-L1抑制剂的研究尚少,对于其有效性、安全性及适用人群,仍有待于在更长时间临床实践中继续观察监测。
作者贡献
魏 瑜: 文献筛选、数据分析、论文撰写
张 莉: 文献筛选、论文指控及审核
| [1] | Ricciuti B, Leonardi GC, Metro G, et al. Targeting the KRAS variant for treatment of non-small cell lung cancer: potential therapeutic applications[J]. Expert Rev Respir Med, 2016, 10(1): 53–68. DOI:10.1586/17476348.2016.1115349 |
| [2] | Jackman D, Pao W, Riely GJ, et al. Clinical definition of acquired resistance to epidermal growth factor receptor tyrosine kinase inhibitors in non-small-cell lung cancer[J]. J Clin Oncol, 2010, 28(2): 357–60. |
| [3] | Blakely CM, Watkins TBK, Wu W, et al. Evolution and clinical impact of co-occurring genetic alterations in advanced-stage EGFR-mutant lung cancers[J]. Nat Genet, 2017, 49(12): 1693–704. DOI:10.1038/ng.3990 |
| [4] | 魏瑜, 杨媚, 张建清, 等.含铂双药对比非铂单药二线治疗晚期非小细胞肺癌的系统评价[J].中华肿瘤防治杂志, 2015, 22(4): 239-99.[ [ Wei Y, Yang M, Zhang JQ, et al. Systematic Review: Comparison of Platinum-based doublet versus non-Platinum single-agent as second-line treatment of advanced non-small-cell lung cancer[J]. Zhonghua Zhong Liu Fang Zhi Za Zhi, 2015, 22(4): 239-99.] ] |
| [5] | Kazandjian D, Suzman DL, Blumenthal G, et al. FAD Approveal Summary: Nivolumab for the treatment of metastatic non-small cell lung cancer with progression on or after Platinum-Based chemotherapy[J]. Oncologist, 2016, 21(5): 634–42. |
| [6] | Higgins J, Green S. Cochrane handbook for systematic reviews of interventions, version 5.1.0(updatedmarch2011)[M]. Coehrane Colloboration, 2011: 79-87. |
| [7] | Parmar MK, Torri V, Stewart L, et al. Extracting summary statistics to perform meta-analysis of the published literature for survival endpoints[J]. Stat Med, 1998, 17(24): 2815–34. DOI:10.1002/(ISSN)1097-0258 |
| [8] | Altman DG, Bland JM. Interaction revisited: the difference between two estimates[J]. BMJ, 2003, 326(7382): 219. DOI:10.1136/bmj.326.7382.219 |
| [9] | Carbone DP, Reck M, PazaAres L, et al. First-Line Nivolumab in Stage IV or Recurrent Non-Small-Cell Lung Cancer[J]. N Engl J Med, 2017, 376(25): 2415–26. DOI:10.1056/NEJMoa1613493 |
| [10] | Luis G, Paz-Ares, Alexander Luft, et al. Phase 3 study of carboplatin-paclitaxel/nab-paclitaxel (Chemo) with or without pembrolizumab (Pembro) for patients (Pts) with metastatic squamous (Sq) non-small cell lung cancer (NSCLC)[J]. J Clin Oncol, 2018, 36(suppl): 105. |
| [11] | Reck M, Rodríguez-Abreu D, Robinson AG, et al. Pembrolizumab versus Chemotherapy for PD-L1-Positive Non-Small-Cell Lung Cancer[J]. N Engl J Med, 2016, 375(19): 1823–33. DOI:10.1056/NEJMoa1606774 |
| [12] | Borghaei H, Langer CJ, Gadgeel S, et al. 24-month overall survival from KEYNOTE-021 cohort G: Pemetrexed-carboplatin plus pembrolizumab as first-line therapy for advanced nonsquamous NSCLC[J]. J Thorac Oncol, 2019, 14(1): 124-29. |
| [13] | Gandhi L, Rodríguez-Abreu D, Gadgeel S, et al. Pembrolizumab plus Chemotherapy in Metastatic Non-Small-Cell Lung Cancer[J]. N Engl J Med, 2018, 378(22): 2078–92. DOI:10.1056/NEJMoa1801005 |
| [14] | Lopes G, Wu YL, Kudaba I, et al. Pembrolizumab (pembro) versus platinum-based chemotherapy (chemo) as first-line therapy for advanced/metastatic NSCLC with a PD-L1 tumor proportion score (TPS) ≥1%: Open-label, phase 3 KEYNOTE-042 study[J]. J Clin Oncol, 2018, 36(18-suppl): abstr LBA4. |
| [15] | Socinski MA, Rittmeyer A, Shapovalov D, et al. IMpower131: Progression-free survival (PFS) and overall survival (OS) analysis of a randomised phase Ⅲ study of atezolizumab+carboplatin+paclitaxel or nab-paclitaxel vs. carboplatin+nab-paclitaxel in 1L advanced squamous NSCLC[J]. Ann Oncol, 2018, 29(suppl-8): abstr LBA65. |
| [16] | Merelli B, Massi D, Cattaneo L, et al. Targeting the PD1/PD-Ll axis in melanoma: Biological rationale, clinical challenges and opportunities[J]. Crit Rev Oncol Hematol, 2014, 89(1): 140–65. DOI:10.1016/j.critrevonc.2013.08.002 |
| [17] | Freeman GJ, Long AJ, Iwai Y, et al. Engagement of the PD-1 immunoinhibitory receptor by a novel B7 family member leads to negative regulation oflymphocyte activation[J]. J Exp Med, 2000, 192(7): 1027–34. DOI:10.1084/jem.192.7.1027 |
| [18] | Topalian SL, Hodi FS, Brabmer JR, et al. Safety, activity, and immune correlates of anti-PD-1 antibody in cancer[J]. N Engl J Med, 2012, 366(26): 2443–54. DOI:10.1056/NEJMoa1200690 |
| [19] | Borghaei H, PazAres L, Hom L, et al. Nivolumab versus docetaxel in advanced non squamous non-small-cell lung cancer[J]. N Engl J Med, 2015, 373(17): 1627–39. DOI:10.1056/NEJMoa1507643 |
| [20] | Brahmer J, Reckamp KL, Baas P, et al. Nivolumab versus docetaxel in advanced squamous cell non-small-cell lung cancer[J]. N Engl J Med, 2015, 373(2): 123–35. DOI:10.1056/NEJMoa1504627 |
 2019, Vol. 46
2019, Vol. 46